ANCA相關性血管炎合并血小板減少的臨床特點分析
彭昭,孫金磊,張慧娟,郭匡金,李天方,劉升云
(1.鄭州大學第一附屬醫院 風濕免疫科,河南 鄭州 450052;2.北京大學第一醫院 風濕免疫科,北京 100034)
抗中性粒細胞胞漿抗體(antineutrophil cytoplasmic antibody,ANCA)相關性血管炎(ANCA-associated vasculitis,AAV),包括肉芽腫性多血管炎、顯微鏡下多動脈炎以及嗜酸性肉芽腫性多血管炎,是一種全身性壞死性小血管炎[1]。臨床上除發熱、乏力等非特異表現外還可出現呼吸系統、消化系統、心血管系統等多系統受累。皮膚-肺-腎受累比較常見,而很少出現血液系統受累[2-3]。目前有關AAV合并血小板減少的報道較少,因此本研究對合并血小板減少的AAV患者臨床特點進行分析以提高對該臨床合并癥的認識。現收集鄭州大學第一附屬醫院2010年1月至2019年9月期間住院的17例AAV合并血小板減少患者的一般資料、臨床表現、實驗室指標、治療方案及預后情況,分析AAV合并血小板減少的患者的臨床特點。
1 資料與方法
1.1 一般資料 選取2010年1月至2019年9月期間在鄭州大學第一附屬醫院住院的AAV合并血小板減少患者17例(血小板減少組),同時選取同期未合并血小板減少的患者51例(血小板正常組),共收集68例AAV患者。其中合并血小板減少17例:男5例,女12例,中位發病年齡為57(34,67)歲,發熱10例,8例腎活檢提示AAV腎損傷,咯血、肺出血5例,神經系統受累3例,鼻竇炎1例,AAV相關性耳聾2例,胸腔積液11例,心包積液4例。未合并血小板減少51例患者:男18例,女33例,中位發病年齡為62(50,67)歲,發熱18例,腎活檢提示AAV腎損傷28例,咯血、肺出血1例,胸腔積液12例,腹腔積液3例。納入及排除標準包括:(1)符合Chapel Hill會議制定的分類及診斷標準[1,4],不合并其他結締組織病;(2)血小板減少標準為住院期間血常規出現至少2次血小板計數<100×109L-1;(3)有高質量及結果明確的骨髓穿刺結果。排除血液系統和脾功能亢進。
1.2 方法 收集并回顧性分析AAV合并血小板減少患者的一般資料、臨床表現、實驗室指標、治療方案及預后情況。(1)一般資料:性別、起病年齡、病程、臨床表現及影像學檢查結果;(2)實驗室檢查:白細胞計數、血紅蛋白濃度、血小板計數、紅細胞沉降率(erythrocyte sedimentation rate,ESR)、C反應蛋白(C-reactive protein,CRP)、血肌酐、尿素氮、尿紅細胞、尿蛋白、C3、C4、ANCA檢測,其中ANCA檢測包括間接免疫熒光法檢測抗中性粒細胞胞漿抗體核周型(perinuclear-antineutrophilic cytoplasmic antibody,p-ANCA)、抗中性粒細胞胞漿抗體胞漿型(cytoplasmic-antineutrophilic cytoplasmic antibody,c-ANCA),酶聯免疫吸附法檢測蛋白酶3(proteinase 3,PR3)和髓過氧化物酶(myeloperoxidase,MPO)為靶抗原的血清 PR3-ANCA及MPO-ANCA、白蛋白水平等;(3)治療方案:糖皮質激素、血漿置換、丙種球蛋白、免疫抑制劑、血液透析使用情況;(4)結局指標:死亡。
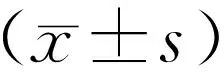
2 結果
2.1 一般表現和實驗室檢查 血小板減少組骨髓穿刺結果提示:骨髓抑制患者1例, 未報告骨髓巨核細胞數值患者1例,骨髓巨核細胞數目為84(0~200)個,且血小板抗體陽性4例。與血小板正常組相比,血小板減少組出現咯血、胸腔積液、腹腔積液比例均高于血小板正常組(均P<0.05);血小板減少組血紅蛋白濃度、C3水平、白蛋白水平均低于血小板正常組,CRP水平、c-ANCA陽性率高于血小板正常組,MPO-ANCA水平、p-ANCA陽性率均低于血小板正常組(均P<0.05)。見表1。

表1 兩組患者臨床資料比較
注:a腎臟活檢證明為ANCA相關性血管炎腎臟受累;ESR—紅細胞沉降率;CRP—C反應蛋白;MPO—髓過氧化物酶;PR3—蛋白酶3;p-ANCA—抗中性粒細胞胞漿抗體核周型;c-ANCA—抗中性粒細胞胞漿抗體胞漿型。
2.2 治療及預后 17例AAV合并血小板減少的患者均采用糖皮質激素治療,6例聯合環磷酰胺治療,6例聯合血漿置換治療,2例聯合丙種球蛋白治療。治療后好轉8例,死亡7例,2例因預后差,自動出院后失訪。其中8例合并腎臟受累的患者,3例單用糖皮質激素治療后2例死亡,5例患者聯合血漿置換治療后均好轉。
血小板減少組死亡率(43.8%)高于血小板正常組(7.8%),差異有統計學意義(P<0.05)。采用K-M法比較兩組間中位生存期,血小板減少組中位生存期(32.82個月)短于血小板正常組(65.63個月),差異有統計學意義(P<0.05)。見圖1。

圖1 AAV合并血小板減少患者生存曲線
3 討論
AAV合并血小板減少的機制尚不明確,王丹等[5]認為血小板減少是繼發于AAV的免疫性血小板減少。研究證實,當血小板被激活后可以釋放CD154分子,血小板相關的CD154與內皮細胞表面CD40相互作用,上調細胞間黏附分子1與CCL2,誘導內皮細胞損傷[6]。同時,研究表明血小板相關的CD154分子參與了免疫性血小板減少性紫癜(immune thrombocytopenic purpura,ITP)的形成[7]。在一項多中心臨床研究中發現,使用抗CD154單克隆抗體治療難治性ITP有很好的效果[8]。本研究中除1例患者骨髓抑制,1例骨髓巨核細胞數目為0,1例患者骨髓穿刺結果未報告骨髓巨核細胞數值以外,其余骨髓穿刺均未見骨髓抑制,同時有4例血小板抗體陽性。因此血小板減少很可能是繼發于該病的免疫性血小板減少。
Xu等[9]證實白蛋白水平低的AAV患者體內炎性指標高,而且低白蛋白水平往往提示預后不良。在本研究中血小板減少組的血清白蛋白水平明顯低于正常組,且血小板減少組死亡率明顯升高。同時,補體旁路途徑參與AAV的形成[10-11]。Coughlan等[10]發現補體C3水平越低,AAV患者的臨床預后越差。本研究中血小板減少組C3水平低于血小板正常組,并且通過生存分析發現血小板減少組生存期較血小板正常組明顯下降。
AAV患者的基本治療方案為激素聯合免疫抑制劑,必要時聯合血漿置換、丙種球蛋白等能提高患者生存率[12]。根據2017年歐洲風濕病協會推薦在出現快速進展性腎小球腎炎,或肌酐水平≥500 μmol·L-1時可考慮血漿置換[13]。在血小板減少合并腎臟受累的8例患者中,3例單用激素治療2例死亡,聯合血漿置換的5例患者均好轉。因此本研究認為對于AAV的治療必要時聯合血漿置換有利于降低患者死亡率。
但本研究仍存在不足,本研究為小樣本、單中心、回顧性研究,造成部分數據缺失,導致無法進行疾病活動度評分,可能對結果造成誤差。仍需要嚴謹的大樣本隊列研究得出明確結論。
綜上所述,免疫性血小板減少可能繼發于AAV。血小板減少可能是AAV預后不良的標志,當患者出現血小板減少時更容易出現咯血、腹腔積液、胸腔積液、CRP升高、C3下降和低白蛋白血癥,早期診斷與治療對改善AAV的預后有重要意義。

