結直腸癌患者腫瘤組織浸潤巨噬細胞PD-L1表達及其臨床意義①
陸 峰 陳威鵬 顏 勛 于建秀 錢 雷③
(濱海縣人民醫院普外科,鹽城 224500)
結直腸癌(colorectal cancer,CRC)是最常見的具有高死亡率的惡性腫瘤之一,發病率在許多國家都在增加,每年在全世界范圍內影響超過120萬人[1]。患者腫瘤組織內含有較多腫瘤浸潤免疫細胞,如T淋巴細胞、自然殺傷細胞(NK)和單核巨噬細胞,其中,巨噬細胞是腫瘤微環境中最豐富的免疫細胞群,作為先天免疫系統中的抗原呈遞細胞,具有調節腫瘤組織內免疫細胞的功能[2]。巨噬細胞可通過表達程序性細胞死亡蛋白配體1(PD-L1)與T淋巴細胞表面程序性細胞死亡蛋白1(PD-1)結合,抑制T淋巴細胞增殖和活化,導致T淋巴細胞對腫瘤細胞殺傷作用下降,引起腫瘤細胞免疫逃逸[3]。研究表明,腫瘤浸潤巨噬細胞與乳腺癌等腫瘤預后不良相關[4],但結直腸癌腫瘤組織中巨噬細胞比例及其PD-L1表達,及其對T淋巴細胞增殖的影響缺乏研究,本研究通過檢測結直腸癌腫瘤組織中巨噬細胞比例及其PD-L1表達,探討其在結直腸癌中的作用。
1 資料與方法
1.1資料
1.1.1研究對象 選擇2017年1月~2018年8月在濱海縣人民醫院住院結直腸癌患者26例,收集手術切除的組織標本,所有患者病理結果確診為結直腸癌。分別取離體30 min內腫瘤邊緣組織和距離腫瘤組織5 cm的相匹配的癌旁良性組織0.5 cm×0.5 cm×0.5 cm作為癌組織和癌旁組織,立即放入裝有4℃ 磷酸鹽緩沖液(PBS)的保存管內。納入標準:病例均為首次發現,術前未行任何放、化療。排除標準:患者伴感染、自身免疫性疾病。患者年齡(62.9±5.3)歲,其中男性18例,女性8例。結腸癌13例,直腸癌13例;組織類型:管狀腺癌20例,黏液腺癌6例;TNM分期:Ⅰ+Ⅱ期8例,Ⅲ+Ⅳ期18例,該研究由濱海縣人民醫院倫理審查委員會批準,所有患者知情同意。
1.1.2儀器和試劑 人結腸癌細胞系SW480和單核細胞系THP-1購自上海生物細胞研究所;異硫氰酸熒光素(FITC)-鼠抗人CD3單克隆抗體(mAb)、藻紅蛋白(PE)-鼠抗人CD4 mAb、葉綠素蛋白(PerCP)-cy5.5鼠抗人CD8 mAb、FITC-鼠抗人CD64 mAb、PE-鼠抗人CD11b mAb、PerCP-cy5.5鼠抗人PD-L1 mAb、PerCP-cy5.5鼠抗人CD163 mAb、別藻青蛋白(APC)鼠抗人-CD206 mAb和紅細胞裂解液均為BD Biosciences產品;用于增殖測定的羧基熒光素琥珀酰亞胺酯(CFSE)購自Thermo Fisher;膠原酶-P購自Sigma公司;細胞濾網購自美國BD Falcon公司;抗PD-1抗體購自Bristol-Myers Squibb公司;RPMI1640和DMEM細胞培養液購自Invitrogen公司;采用美國BD CantoⅡ流式細胞分析儀檢測細胞表面標記。
1.2方法
1.2.1腫瘤浸潤免疫細胞分離 根據文獻[5]分離腫瘤浸潤免疫細胞,將新鮮癌組織和癌旁組織在含有抗生素(慶大霉素和青霉素)的PBS中洗滌,用無菌手術刀機械解離組織,將樣品切成約1 mm3的組織塊,并在PBS中加入膠原酶P(1 mg/ml)酶促消化,在37℃、5%CO2輕輕搖動30 min。將上清液用70 μm細胞濾網過篩,用含10% 胎牛血清(FBS)和抗生素的DMEM培養液重懸細胞,終濃度為2×105個/ml。在完成分離方案后,立即熒光染色,流式細胞術分析細胞表面標志。
1.2.2巨噬細胞誘導及單個核細胞分離 先將單核細胞系THP-1誘導分化為巨噬細胞,將THP-1細胞接種在24孔板(5×105個/孔),在RPMI1640培養基中加入佛波酯(100 ng/ml)刺激培養24 h,懸浮的單核細胞分化為貼壁生長的巨噬細胞。采用Ficoll-Hypaque密度離心法獲得健康體檢者外周血單個核細胞(PBMC),用RPMI1640培養基重懸,濃度為2×105個/ml,接種于24孔板。
1.2.3細胞共培養體系 人結腸癌細胞系SW480在DMEM培養基中培養,接種于6孔細胞培養板(5×105個/孔),分別將巨噬細胞(2.5×105個/室)和單個核細胞(2.5×105個/室)接種于Transwell小室,然后將Transwell小室置于6孔板上,建立非接觸共培養體系,在37℃和5%CO2下共孵育5 d(共培養組),以不含人結腸癌細胞的巨噬細胞和單個核細胞的共培養體系為空白對照組。收集共培養細胞,PBS洗滌后,根據 CD64+CD11b+陽性選取巨噬細胞,然后流式細胞術檢測CD163、CD206及PD-L1陽性細胞比例;根據CD3選取淋巴細胞,檢測CD4+,CD8+T細胞表面PD-1陽性率。
1.2.4流式細胞術檢測 取100 μl巨噬細胞和/或單個核細胞懸液,加入10 μl FITC-鼠抗人CD3 mAb、10 μl PE-鼠抗人CD4 mAb、10 μl PerCP-cy5.5鼠抗人CD8 mAb及APC-鼠抗人PD-1 mAb;取100 μl 細胞懸液,加入10 μl FITC-鼠抗人CD64 mAb、10 μl PE-鼠抗人CD11b mAb、10 μl PerCP-cy5.5鼠抗人PD-L1 mAb、或10 μl PerCP-cy5.5鼠抗人CD163 mAb、或10 μl APC鼠抗人-CD206 mAb標記細胞,并在4℃下黑暗中孵育30 min,然后用PBS洗滌并重懸。同時用匹配的同種型抗體用作陰性對照。使用流式細胞儀分析細胞表面標記。根據腸道巨噬細胞表面CD64+CD11b+表達,檢測組織中巨噬細胞比例[6]。
1.2.5增殖試驗 PBMC、巨噬細胞與人結腸癌細胞系SW480共培養,用不含有腫瘤細胞的培養體系作對照組,加入終濃度為5 μg/ml抗-PD-1抗體阻斷PD-L1/PD-1相互作用,在37℃和5%CO2下共孵育5 d。此后用CFSE-FITC對細胞進行熒光染色,通過流式細胞術檢測增殖。

2 結果
2.1流式細胞術檢測結直腸癌組織中免疫細胞比例 與癌旁組織相比,腫瘤組織中巨噬細胞和CD4+/CD3+T細胞比例顯著上升,CD8+/CD3+T細胞比例顯著下降,差異均有統計學意義(P<0.05),結果見表1。
2.2結直腸癌組織巨噬細胞表面分子檢測 根據CD64+CD11b+陽性選取巨噬細胞,然后檢測其表面PD-L1、CD206和CD163表達(圖1)。與癌旁組織相比,結直腸癌組織浸潤巨噬細胞PD-L1、CD206和CD163陽性細胞比例顯著上升,差異均有統計學意義(P<0.05),結果見表2。
表1 結直腸癌與癌旁組織浸潤細胞比較
Tab.1 Comparison of infiltrating cells between colorectal cancer and adjacent tissues

GroupsnMacrophages(%)CD4+/CD3+T cell(%)CD8+/CD3+T cell(%)Cancer tissue265.6±0.61)20.9±6.41)4.6±1.71)Paracancerous tissue260.9±0.30.8±0.341.4±10.5 t35.7215.9917.64P<0.001<0.001<0.001
Note:Cancer tissue vs paracancerous tissue,1)P<0.05.
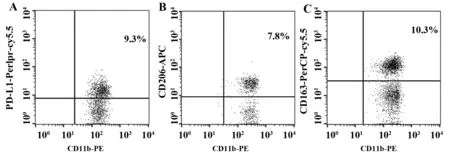
圖1 流式細胞術檢測結直腸癌患者巨噬細胞分子的表達Fig.1 Analysis of molecules expression on macrophages in colorectal cancer by flow cytometryNote: A.Percentage of PD-L1 positive macrophage;B.Percentage of CD206 positive macrophage;C.Percentage of CD163 positive macrophage.
表2 結直腸癌與癌旁組織浸潤巨噬細胞表面分子比較
Tab.2 Comparison of molecules expression on macropha-ges between colorectal cancer and adjacent tissues
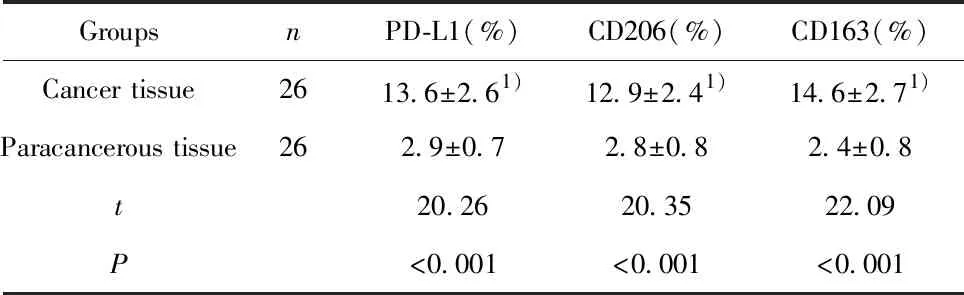
GroupsnPD-L1(%)CD206(%)CD163(%)Cancer tissue2613.6±2.61)12.9±2.41)14.6±2.71)Paracancerous tissue262.9±0.72.8±0.8 2.4±0.8 t20.2620.3522.09P<0.001<0.001<0.001
Note:Vs paracancerous tissue,1)P<0.05.
2.3與結腸癌細胞共培養的單核巨噬細胞表面分子表達 與對照組相比,與結腸癌細胞共培養的巨噬細胞表面PD-L1、CD206和CD163表達顯著上升,差異均有統計學意義(P<0.05),結果見表3。
2.4與結腸癌細胞共培養的淋巴細胞表面PD-1檢測 與對照組相比,與結腸癌細胞共培養的淋巴細胞表面PD-1表達顯著上升,差異有統計學意義(P<0.05),結果見表4。
2.5與結腸癌細胞和巨噬細胞共培養的淋巴細胞增殖檢測 與空白對照組相比,與結腸癌SW480細胞和巨噬細胞共培養的淋巴細胞增殖率顯著下降,與結腸癌SW480細胞共培養組相比,抗-PD-1對照組淋巴細胞增殖率顯著上升,差異均有統計學意義(P<0.05),結果見表5。
表3 與結腸癌細胞共培養巨噬細胞表面分子表達
Tab.3 Molecules expression on macrophage surface co-cultured with colon cancer cells

GroupsPD-L1(%)CD206(%)CD163(%)Co-culture group14.2±2.11)32.6±6.51)35.1±5.81)Control group6.3±1.412.9±3.320.2±4.6t15.9613.7710.26P<0.001<0.001<0.001
Note:Vs control group,1)P<0.05.
表4 共培養的淋巴細胞表面PD-1陽性率比較
Tab.4 Percentage of PD-1 positive lymphocytes co-cultured with colon cancer cells

GroupsCD4+T cell PD-1(%)CD8+T cell PD-1(%)Co-culture group4.7±2.51)2.8±0.61)Control group1.5±0.51.1±0.3t6.4012.92P<0.001<0.001
Note:Vs control group,1)P<0.05.
表5 共培養的淋巴細胞增殖率比較
Tab.5 Proliferative rates of lymphocyte co-cultured with macrophage and SW480 cells
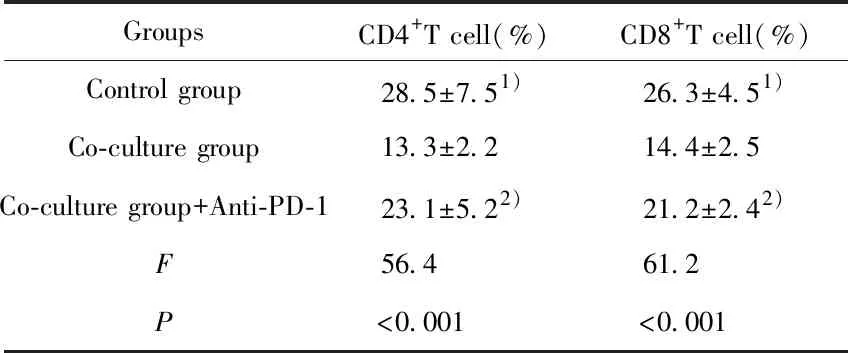
GroupsCD4+T cell(%)CD8+T cell(%)Control group28.5±7.51)26.3±4.51)Co-culture group13.3±2.214.4±2.5Co-culture group+Anti-PD-123.1±5.22)21.2±2.42)F56.461.2P<0.001<0.001
Note:Vs co-culture group,1)P<0.05;vs co-culture group,2)P<0.05.
3 討論
機體免疫系統與腫瘤細胞之間的相互作用在腫瘤進展中起著重要作用,腫瘤的免疫編輯理論認為,在腫瘤細胞逃逸期,腫瘤快速生長形成一個抑制免疫細胞的微環境。在此微環境中,可識別并消除腫瘤細胞的CD8+T細胞和NK細胞等,細胞毒性T淋巴細胞(cytotoxic T lymphocyte,CTL)功能受損,在體外分離和培養時增殖能力和細胞因子分泌功能降低[7],另一方面,調節性T細胞、腫瘤相關巨噬細胞(TAM)、腫瘤相關粒細胞和髓系來源抑制細胞(myeloid-derived suppressor cells,MDSCs)可促進癌細胞的增殖和轉移[8]。TAM分泌高水平的IL-10和低水平的IL-12,促進血管的生成、腫瘤的侵襲和轉移。因此,通過癌癥疫苗接種、免疫檢查點治療和過繼性CTL轉移治療等免疫療法可調節腫瘤組織浸潤免疫細胞的功能,最大化CTL的殺腫瘤能力,抑制TAM等的促腫瘤作用。
腫瘤浸潤性免疫細胞是腫瘤免疫微環境的重要組織部分,代表了宿主對腫瘤免疫應答的狀態。本次研究證實,與癌旁組織相比,腫瘤組織中巨噬細胞和CD4+/CD3+T細胞比例顯著上升,CD8+/CD3+T細胞比例顯著下降。腫瘤相關巨噬細胞是實體腫瘤中最豐富的細胞類型,其向腫瘤的浸潤與大多數實體瘤的預后不良有關[9]。Galon等[10]研究表明,原發性結直腸癌腫瘤浸潤CD8+T淋巴細胞比例降低與腫瘤侵襲性和分期增加有關,患者存活率下降,臨床預后不良。卵巢癌、乳腺癌、胰腺癌和膽道癌的不良預后也與腫瘤浸潤低比例的CD8+T細胞相關[11]。上述結果表明,淋巴細胞和巨噬細胞作為宿主防御的第一線,通過識別和響應腫瘤細胞,在結直腸癌的進展中起重要作用。
巨噬細胞是一類極具異質性的細胞群體,在體內外不同的微環境下,表現出獨特的表型,并具有功能的差異。根據功能的差異,巨噬細胞主要分為經典型(M1)或替代型(M2)。M1巨噬細胞負責促進炎癥、抗腫瘤和免疫反應,M2巨噬細胞也稱為腫瘤相關巨噬細胞,參與腫瘤血管生成[12]。TAMs來源于循環單核細胞,由腫瘤細胞分泌的單核細胞趨化因子CCL2/MCP-1募集到腫瘤部位,腫瘤細胞通過分泌腫瘤細胞因子和前列腺素等多種機制抑制巨噬細胞的抗腫瘤作用[13]。本次研究通過流式細胞術驗證,腫瘤浸潤的單核巨噬細胞高表達CD163和CD206,呈M2極化。Li等[14]研究證實高比例的M2巨噬細胞極化與結直腸癌患者預后不良密切相關。
本研究還發現,腫瘤浸潤的巨噬細胞高表達PD-L1。在特異性免疫應答中,巨噬細胞表面PD-L1與T細胞表面免疫檢查點PD-1受體結合,通過傳遞的內在負調節機制,誘導效應T細胞凋亡,抑制其發揮抗腫瘤作用[15]。本次研究通過體外實驗也證實,與結腸癌腫瘤細胞共培養的巨噬細胞表面PD-L1 表達上升。腫瘤細胞會釋放一些具有免疫抑制功能的分子,如TGF-β、IL-10等,并能誘導調節T細胞表達細胞毒T淋巴細胞相關抗原(CTLA-4),誘導T淋巴細胞無反應性,導致免疫系統產生對腫瘤的免疫耐受[16]。
巨噬細胞作為抗原提呈細胞,還參與適應性免疫應答,通過表達PD-L1與T細胞表面PD-1結合,抑制T細胞功能。從小鼠和人類實體腫瘤分離的巨噬細胞在體外可直接抑制T細胞反應和NK細胞的細胞毒性[17]。本次研究證實,與結腸癌腫瘤細胞和巨噬細胞共培養的淋巴細胞增殖下降,此抑制作用可被抗-PD-1抗體部份阻斷,表明巨噬細胞通過高表達PD-L1與PD-1+T細胞相互作用。與此一致的是,Wu等[18]證實結直腸癌腫瘤浸潤淋巴結中CD8+T細胞的PD-1表達顯著上調,產生細胞因子(IL-2和IFN-γ)和穿孔素功能力下降。在乳腺癌小鼠模型中,去除TAM增強了CD8+T細胞介導的抗腫瘤免疫力[19],TAM與腫瘤細胞浸潤CD8+T細胞的物理接觸抑制了T細胞的完全活化并阻止其進入腫瘤細胞[20],因此,抑制TAM是提高免疫療法療效的重要方法[21]。
綜上所述,本研究表明結直腸癌腫瘤組織中存在高比例的巨噬細胞,CD8+/CD3+T淋巴細胞比例降低,且巨噬細胞高表達PD-L1,淋巴細胞高表達PD-1。通過體外實驗證實,腫瘤微環境可誘導巨噬細胞PD-L1和淋巴細胞PD-1表達,巨噬細胞通過PD-L1與PD-1+T細胞相互作用抑制T細胞增殖,從而降低T細胞免疫功能,可能在腫瘤細胞免疫逃逸過程中發揮作用。因此對腫瘤微環境中巨噬細胞極化狀態和PD-1/PD-L1信號通路的抑制對于CRC的治療具有重要的作用。

