體質量指數對中樞性性早熟女童GnRH激發試驗結果的影響
王 靜,沈春榮
(臺州市立醫院兒內科,浙江 臺州 318000)
中樞性性早熟(central precocious puberty,CPP)是指男孩9歲前、女孩8歲前由于下丘腦-垂體-性腺軸功能提前啟動出現的生殖器官迅速發育并呈現第二性征的內分泌疾病[1]。近年來全球兒童肥胖的發病率呈逐年增高趨勢,與此同時女童青春期啟動時間顯著提前,促性腺激素釋放激素(gonadotropin-releasing hormone,GnRH)激發試驗是臨床上常用的診斷中樞性性早熟的金標準,通過判斷下丘腦-垂體-性腺軸功能的啟動情況鑒別診斷中樞性性早熟及周圍性性早熟。有學者指出,體質量指數(body mass index,BMI)會影響GnRH激發試驗結果促黃體生成素(luteinizing hormone,LH)峰值,國外研究發現,性早熟兒童LH激發峰值與體質量指數呈負相關[2],但國內關于體質量指數對GnRH激發試驗促卵泡生成素(follicle-stimulating hormone,FSH)、LH基礎值和峰值影響的研究較少,本次研究欲通過探究BMI對GnRH激發試驗診斷中樞性性早熟女童LH峰值的影響,旨在為臨床上準確診斷中樞性性早熟女童LH峰值提供科學依據。
1資料與方法
1.1病例收集
選取2018年1月至2019年8月于臺州市立醫院診斷為特發性中樞性性早熟(idiopathic central precocious puberty,ICPP)的96例女童為研究對象。ICPP診斷標準參照中樞性性早熟診斷與治療共識(2015版)[1],并按照BMI將被研究兒童分為肥胖組、超重組和正常體重組,BMI=體質量(kg)/身高2(m2),BMI的Z分值≥2為肥胖,1~2為超重,<1為正常體質量[3]。納入標準:①年齡<18歲;②未服用過對肥胖有影響的藥物;③無遺傳代謝性疾病;④無嚴重心肝腎等器質性疾病;⑤患兒家屬均知情并同意參與本次研究。
1.2資料收集
由經過培訓的調查員采用標準技術方法測量受試兒童的身高、體重(清晨空腹體重),分別精確至0.1kg、0.1cm,按照BMI計算結果對患兒進行分組。第二性征評估采用Tanner分期標準,由統一培訓的兒科內分泌醫師進行評估。骨齡通過拍攝左手正位X線片(包括腕骨及橈尺骨下端),統一由醫院內分泌專科醫師按G-P圖譜法測算骨齡。卵巢及子宮容積通過超聲檢查計算(0.523×長×寬×厚度)[4],下丘腦-垂體磁共振成像檢查排除顱內占位病變。
1.3 GnRH激發試驗
患兒入院后第二天清晨空腹進行GnRH激發試驗,空腹肘靜脈注射戈那瑞林(國藥準字:H10960064),劑量為2.5ug/kg,最大量不超過100μg/kg,于注射時的0min、30min、60min、90min抽取5mL靜脈血置于膠促凝管中備用。在Access2全自動化學發光免疫分析儀中(武漢明德生物科技股份有限公司)用酶促化學發光檢測法檢測LH水平和FSH水平,操作嚴格按照說明書步驟進行。
1.4統計學方法
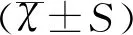
2結果
2.1兒童一般情況
共有96例女童完成本研究,其中正常組37例,超重組33例,肥胖組26例。各組BMI比較差異均有統計學意義(χ2=6.16~12.88,P<0.05),而年齡、骨齡、子宮容積、卵巢容積(t=0.05~1.04,P>0.05)、乳房分期(χ2=0.68~0.99,P>0.05)在三組兒童間比較差異均無統計學意義,見表1。
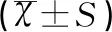
表1 三組患兒臨床特征Table 1 Clinical characteristics of children with ICPP in the three groups
2.2三組患兒LH及FSH基礎值、LH及FSH峰值和峰值LH/FSH比較
正常組、超重組和肥胖組兒童LH基礎值和FSH基礎值逐漸下降,組間兩兩比較,差異均具有統計學意義(t=5.30~12.80,P<0.05),LH峰值和峰值LH/FSH在超重組和肥胖組患兒均低于正常體重組(t=2.99~8.10,P<0.05),而超重組和肥胖組差異無統計學意義(t=0.59~1.89,P>0.05);FSH峰值在各組間差異均無統計學意義(P>0.05),見表2。

表2 各組性早熟患兒血清激素水平Table 2 Serum hormone levels of children with OCPP in the three groups
注:*指與正常組比較,差異有統計學意義;#指與超重組比較,差異有統計學意義。
3.討論
3.1兒童肥胖是性早熟的危險因素
近年來,兒童肥胖已經成為世界范圍內的公共健康問題,嚴重威脅兒童的健康發育。研究顯示兒童肥胖不僅和高脂血癥、高血糖、高胰島素血癥等有關[5],還是性早熟的危險因素。肥胖對女性激素水平的影響貫穿青春前期、青春期及成年期,肥胖可使女童性發育提前,但對其機制的研究由于混雜因素眾多目前尚沒有完全清楚[6]。因此探究BMI對GnRH激發試驗診斷中樞性性早熟女童LH及FSH基礎值、LH及FSH峰值水平的影響,對性早熟的診斷和進一步研究提供理論依據。
3.2 BMI與女童性激素水平的關聯性及關聯機制探討
本研究結果提示超重組和肥胖組兒童LH及FSH基礎值、LH峰值和峰值LH/FSH均低于正常體重組,提示青春期肥胖女童LH分泌減弱,與文獻報道的正常體質量者血清LH基礎值及LH峰值顯著高于超重及肥胖組結果一致[4,7]。具體機制尚未明確,較多的研究提示肥胖在一定程度上抑制了下丘腦-垂體-性腺軸的功能,可能與雌二醇、胰島素水平、瘦素等調節有關。有研究發現中樞性性早熟患兒中,肥胖組患兒雌二醇、胰島素水平和瘦素水平均高于正常體重組,且肥胖組患兒伴有較強的胰島素抵抗[4]。對人類和動物的研究表明雌激素在下丘腦起負反饋作用,可能與肥胖患兒低LH峰值相關。Sliwowska等[8]研究發現肥胖組ICPP患兒中存在高胰島素,并認為胰島素可能作用于下丘腦中特定的候選神經元,參與生殖功能的調節。Al-Safi等[9]的研究發現肥胖婦女的胰島素升高與低內源性LH分泌有關。BMI對LH分泌的影響也可能與瘦素調節有關。瘦素是控制食物攝入和能量平衡關鍵信號之一,通過中央和外圍受體參與多種生理功能。最近的研究發現外源脂肪因子(包括瘦素)通過與瘦素受體結合而改變下丘腦GnRH脈沖釋放,在一般人群中的研究發現高水平瘦素使GnRH脈沖釋放頻率增加并可促進青春期開始[10]。但是,在大多數肥胖個體中的研究發現,肥胖ICPP患兒血清瘦素濃度升高與體內瘦素抵抗有關,且肥胖ICPP患兒中瘦素信號傳導的神經生物學反應呈現出中樞瘦素作用不足,提示肥胖患兒存在瘦素抵抗與低LH峰值相關。
GnRH激發試驗是診斷中樞性性早熟診斷的金標準,能夠對促性腺激素軸活化水平進行準確檢測,而肥胖對青春期啟動激素水平有影響,可能對下丘腦促性腺激素釋放激素(GnRH)的分泌產生影響,因此對于肥胖患兒診斷中樞性性早熟LH峰值切點值得商榷[4]。
綜上所述,BMI與GnRH激發試驗女童性激素水平密切相關,體質量指數越高,LH基礎值、LH峰值、峰值LH/FSH比值越低,臨床上應該加以重視。

