慢性乙型肝炎發病過程中CD4 T細胞并非單純 “細胞毒”作用
程浩 王艷
T細胞在慢性乙型肝炎(CHB)的免疫發病機制中的重要作用眾所周知。雖然近年的相關研究主要集中在CD8 T細胞耗竭在慢性乙型肝炎發病機制中的作用,但自20世紀80年代開始,很多學者持續關注CD4 T細胞在宿主免疫中發揮的多種關鍵作用,包括CD4 T細胞促進B細胞成熟并產生抗體、誘導粒細胞趨化、通過CD40/CD40L相互作用參與抗原遞呈細胞活化,以及在特定轉錄因子和細胞因子調控下,分化為功能不同的亞群(包括產生IFNγ/IL-12的Th1細胞,主要產生IL-4的Th2細胞,依賴于轉錄因子RORγT產生IL-17/IL-21的Th17細胞和依賴于轉錄因子FoxP3的T-reg細胞),尤其在參與CD8 T細胞介導的HBV免疫反應中發揮了舉足輕重的作用。
對于CD4 T細胞在乙型肝炎病毒(HBV)慢性感染發病過程中的功能,多個科學家團隊歷經多年,通過很多的臨床和基礎研究,深入了解CD4 T細胞在CHB發病過程中并非一概“細胞毒”作用,而是更為精細的分工和調控,參與CHB的疾病發展和臨床預后。2006年Wedemeyer等對76例病毒性肝炎患者穿孔素陽性CD4+ T細胞進行檢測。結果顯示,穿孔素陽性的CD4 T細胞的表達與年齡、穿孔素陽性CD8 T細胞和穿孔素陽性CD4- / CD8-淋巴樣細胞存在顯著相關性,與肝臟炎癥反應和不良疾病結局均有關。業內更多關注CD4 T在慢性病毒性肝炎發病過程中通過穿孔素發揮的細胞毒作用。Racanelli等發現天然Treg可誘導CD4+ T細胞分化為誘導型Treg細胞(具有傳染性耐受/連鎖性抑制效應)。而外周Treg細胞的產生可能依賴于細胞因子IL-2。但Treg如何使肝炎病毒宿主在免疫應答過程中獲益并不十分清晰。在慢性肝炎長期免疫應答過程中,究竟Treg更多通過上調CD8 T活性誘導細胞凋亡還是最終抑制效應細胞活性尚有爭議。
2011年中國學者發出自己的聲音。Zhou等對72例CHB患者、27例HBV攜帶者、8例急性乙型肝炎(AHB)患者和26例健康對照進行血漿sIL-6R水平和外周血CD4 +IL-6R+ T細胞檢測和研究。該研究首次提出不同細胞因子(IL-6)誘導的不同亞群CD4 T細胞(CD4 + IL-6R + T細胞)功能不同,可能與乙型肝炎病毒慢性感染的不同臨床階段相關。另一項研究結果顯示CHB患者T細胞增殖水平降低,IFN-γ和IL-10水平升高;循環Treg細胞數量增加,CD4 T細胞PD-1表達和細胞毒T淋巴細胞相關抗原4的表達均上調;循環HBeAg可能參與調控CHB患者病毒特異性的T細胞功能下降;但T細胞檢測與CHB臨床不同免疫表型之間的相關性并未找到有利支持證據。
中國學者鄧國宏教授團隊通過對68例慢性HBV感染且ALT<2倍正常上限的患者和28例乙型肝炎急性發作患者的HBV特異性CD4 T細胞進行分析,根據研究結果首次提出CD4 T細胞不同分工的TNF-α/IFN-γ HBV特異性CD4 T細胞穩態及相互轉化與臨床疾病狀態相關(圖1)。這是CHB領域關于CD4 T細胞功能研究的重要研究結果,為未來對進一步深入理解CHB的免疫機制奠定了不可或缺的基礎。
該研究應用一組針對CD4 T細胞的HLA限制性抗原決定簇對包括核心(HBc)抗原和表面(HBs)抗原的HBV多肽進行了分析。既往曾有研究顯示,在急性HBV感染患者發生HBeAg和HBsAg血清學轉換的過程中,針對HBcAg和HBeAg的CD4 T細胞應答上調,提示針對這些蛋白的特異性T細胞對于病毒消除至關重要。但如果CHB患者未能產生針對HBc/HBs特異性T細胞的有效應答,將會導致患者感染持續慢性化。CHB患者隊列中,高病毒載量的HBeAg陽性患者體內特異性CD4 T細胞過高表達TNFα;而表達IFNγ的HBV特異性CD4 T細胞則在病毒清除階段(HBeAg血清轉化和 HBsAg消失)的患者中顯著上調。同時,HBsAg水平與針對HBs特異性表達IFNγ的CD4 T細胞呈負相關。與巨細胞病毒感染和細菌感染類似,HBV清除過程亦伴隨著表達IFNγ的抗原特異性CD4 T細胞的數量和比例的升高。
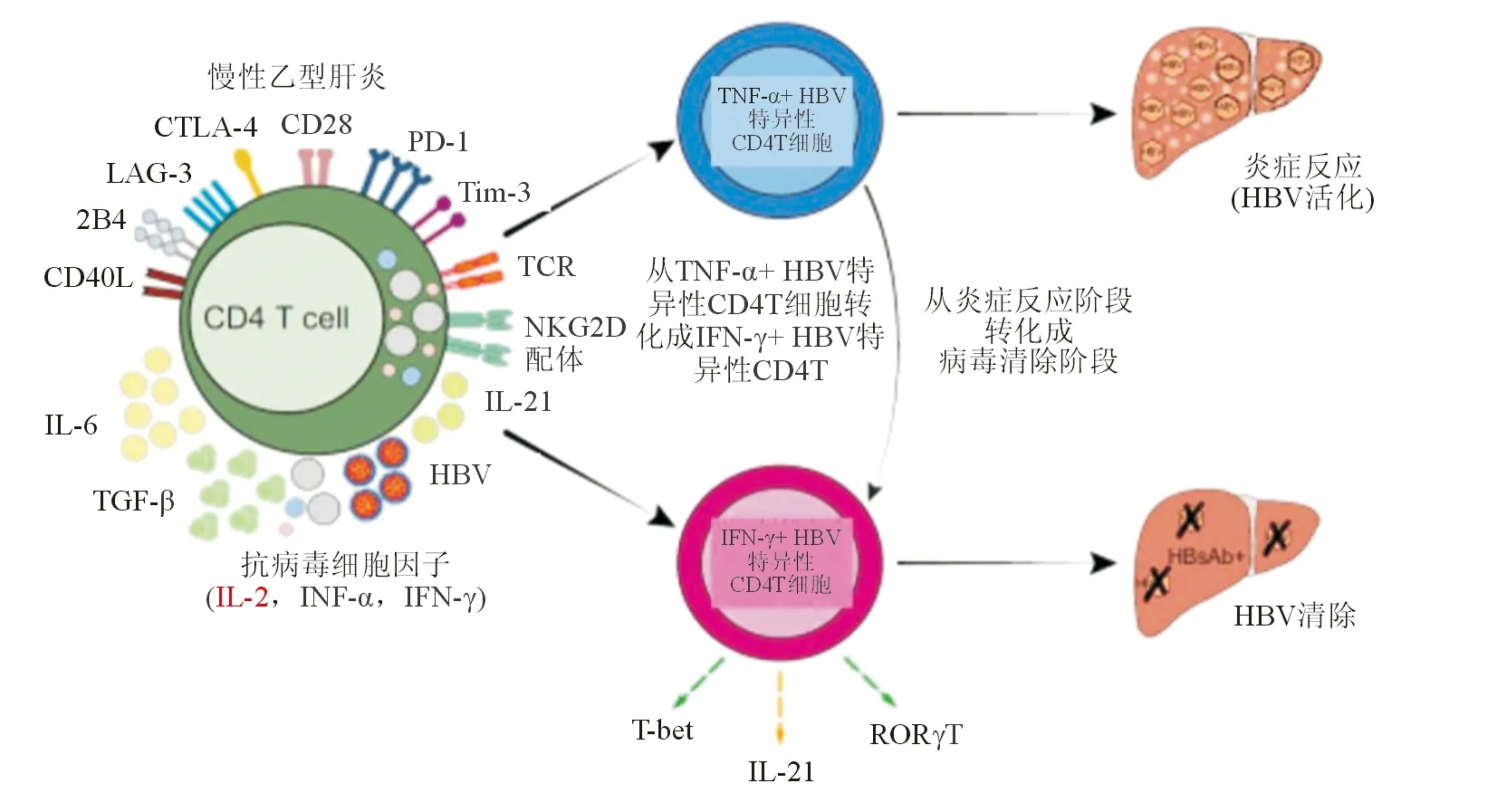
圖1 慢性乙型肝炎感染中CD4 T細胞表型
眾所周知,CHB病程中發生肝臟炎癥活化可能有助于HBsAg發生血清學消失,因此目前許多研究把停用核苷酸及核苷類似物(NA)治療后所導致的臨床復發作為一種潛在的治療策略,但很可能由于炎癥反應的不可控而導致肝衰竭。值得關注的是,本項研究發現,在NA抗病毒治療前肝臟炎癥反應程度嚴重的患者TNFα+病毒特異性CD4 T細胞應答顯著上調,且隨著NA抗病毒治療的開始,TNFα+病毒特異性CD4 T細胞顯著下降。同時,最終獲得HBsAg消失的患者檢測到表達IFNγ的病毒特異性CD4 T細胞應答上調。這些研究結果與以往關于活動性乙肝患者血清中TNFα高表達的結果相印證,再次表明TNFα可能參與肝損傷和肝臟免疫病理過程。另外,在獲得HBeAg和HBsAg 血清學轉換的患者體內定期復查均可檢測到TNFα/ IFNγ雙表達和單純表達IFNγ的CD4T細胞,證實病毒清除過程可能與產生TNFα的病毒特異性CD4 T細胞轉換為產生IFNγ的病毒特異性CD4 T細胞有關(見圖1)。兩種亞群均表達譜系特異性轉錄因子,而IL-21、T-bet和RORγT表達水平的差異可能與CD4T細胞向Th1和Th17分化相關。 當然,仍需要進一步的研究來全面詮釋闡明這一過程,同時,轉錄因子表達譜與單純表達TNFα的CD4T細胞的相關性也需要進一步的研究驗證
目前,T細胞分化調控細胞因子應答繼而可能改善患者炎癥反應(TNFα主導)獲得病毒清除(IFNγ主導)這一理念在CHB病理學和治療學方面的重要性并未得到足夠重視。更多關注抗病毒免疫應答過程中CD4 T細胞分化通路以及其與下游CD8 T細胞、B細胞和固有細胞之間的相互作用。未來期待對CHB患者肝內CD4 T細胞的相關檢測和實驗,期待對初治患者和抗病毒治療患者長期隨訪的動態監測數據,更期待針對患者的治療方案能夠上調CD4 T細胞的T-bet表達,促進IL-21產生,進而增強病毒特異性CD8 T細胞應答能力,為最終治愈HBV助力。