米曲霉形態對L-蘋果酸生產的影響
周 潔, 羅秋玲, 丁 強, 陳修來, 劉立明*
(1. 食品科學與技術國家重點實驗室,江南大學,江蘇 無錫214122;2. 江南大學 工業生物技術教育部重點實驗室,江蘇 無錫214122;3. 江南大學 糧食發酵工藝與技術國家工程實驗室,江蘇 無錫214122)
L-蘋果酸是一種重要的從可再生能源碳水化合物轉化的化學品, 已被美國能源部列為12 大構架化合物之一。 作為生物體TCA 循環的中間體,L-蘋果酸廣泛應用于食品、煙草、化工和醫藥行業[1]。其具體用途如下:1) 在食品行業:L-蘋果酸可以作為一種酸性和味覺增強劑代替檸檬酸,還可以作為食品保色保鮮劑和食品抗氧化劑等;2) 在煙草行業:蘋果酸衍生物(如酯類)能作為煙草調味劑;3)在化工行業:是良好的絡合劑、酯劑,用于牙膏配方、合成香料配方等,還可以作為除臭劑和工業洗滌劑的成分;4) 在醫藥行業,可作為抗癌藥物前體、血管吻合劑,同時還可以配合各種片劑使其具有水果味,并有助于在體內擴散、吸收。
目前,利用發酵法生產L-蘋果酸時主要使用米曲 霉 (Aspergillus oryzae)、 黃 曲 霉 (Aspergillusflavus)[2-4]。 雖然黃曲霉能高產L-蘋果酸,但其產生的黃曲霉毒素具有強致癌性, 不能作為食品添加劑。 而米曲霉作為食品安全菌株,廣泛用于發酵工業。 米曲霉作為絲狀真菌,在液態深層發酵過程中生長緩慢、機械剪切力耐受性較差,易形成絲狀、團狀和球狀等形態,形態的變化通常會引起發酵液流變性的改變,使其發酵過程變得十分復雜并且難以控制。 絲狀真菌在發酵過程中的形態受多個基因調控,其中包括hypA/podA、swoF和sepA等基因[5]。這些基因編碼的蛋白質控制細胞大小、菌絲極性或細胞間隔膜的間距來改變菌體形態。 菌體形態還受到營養條件(如碳氮源種類及其濃度、金屬離子的添加等)、環境條件(如溫度、pH 值、孢子濃度、攪拌轉速、通氣量、表面活性劑等外源添加物)等因素的影響[6-9]。
曲霉在液體深層發酵過程中,菌體宏觀和微觀形態的變化對代謝產物的合成有重要的影響,不同菌株積累代謝產物最佳形態各不相同。 Aftab Ahamed[10]等人在利用Aspergillus niger生產蛋白酶時發現,當菌體為球狀時蛋白酶產量低于150 U/g,而當菌體為絮狀時蛋白酶產量可超過350 U/g。 而Aspergillus niger生產檸檬酸則以球狀為佳,與菌球相比非菌球生產檸檬酸不僅產量低, 葡萄糖吸收率、氧氣吸收速率和二氧化碳釋放速率都處于低水平[11]。 此外,Aspergillus terreus生產衣康酸和洛伐他汀、Rhizopus oryzae生 產 富 馬 酸、Rhizopus arrhizus生產乳酸等最佳形態都為菌球[12-15]。 作者通過研究營養條件和環境條件對米曲霉菌體形態的影響,確定最佳形態并分析得到菌體形態與L-蘋果酸產量的關系,從而由此調控A. oryzae形態在發酵罐上獲得高產L-蘋果酸。
1材料與方法
1.1 材料
1.1.1 菌種A. oryzaeFMME 338 (CCTCC NO:M 2016401) 保藏于中國典型培養物保藏中心。
1.1.2 試劑 L-蘋果酸標準樣品:Sigma 公司產品;葡萄糖:山東西王生化科技有限公司產品;其他化學試劑均為分析純:國藥集團化學試劑有限公司產品。
1.1.3 培養基 斜面培養基 (g/L): 去皮馬鈴薯200,葡萄糖20,瓊脂15;自然pH。
種子培養基 (g/L): 葡萄糖60, 胰蛋白胨3,KH2PO40.75,K2HPO4·3H2O 0.98,MgSO4·7H2O 0.1,CaCl20.075,1 mL 微量元素溶液 (NaCl 5, FeSO4·7H2O 5,去離子水1 L)。
發酵培養基 (g/L): 葡萄糖120,CaCO3(60~100), 胰蛋白胨6,KH2PO40.2,K2HPO4·3H2O 0.2,MgSO4·7H2O 0.1,CaCl20.075,1 mL 微量元素溶液(同上) 。
1.2 實驗方法
1.2.1 培養方法 生孢培養: 從-80 ℃的甘油保藏管中取一環孢子懸液接種于斜面培養基,30 ℃恒溫培養箱中培養4~6 d;
種子培養: 將培養的成熟孢子用質量分數0.05%吐溫80 洗下,經玻璃珠打散后過濾制成孢子懸浮液,用血球計數板計數。 將孢子懸浮液轉接至種子培養基中,種子培養基的裝液量為250 mL 的三角瓶中裝入50 mL 培養基, 培養轉速200 r/min,在30 ℃下恒溫搖床培養24 h;
發酵培養(搖瓶):按體積分數10 %的接種體積分數,將液體種子接種到發酵培養基中,發酵培養基的裝液量為250 mL 三角瓶中裝入50 mL 培養基,轉速200 r/min,30 ℃下恒溫搖床培養6 d;發酵培養(發酵罐):按體積分數10%接種,將液體種子接種到發酵培養基中,發酵培養基的裝液量為30 L發酵罐裝入16 L 培養基,轉速200~600 r/min,通氣量1~3 vvm,30 ℃下培養6 d。
1.2.2 分析方法 L-蘋果酸和葡萄糖質量濃度測定:用高效液相色譜(HPLC) 分析檢測,色譜柱為AminexHPX-87H Ion (300 mm×250 mm),流動相為5 mmol/L H2SO4,流速為0.6 mL/min;柱溫為35 ℃;波長為215 nm; 進樣量為10 μL;L-蘋果酸質量濃度檢測器為紫外檢測器, 葡萄糖濃度檢測器為示差檢測器;生物量測定:采用干質量法,用2 N 的HCl 除去發酵液中的CaCO3, 將發酵液經濾紙過濾后用蒸餾水洗滌3 遍再抽濾, 置于干燥箱中60 ℃烘干至恒重,用稱重法測定其生物量;菌體形態測定:Canon IXUS115 數碼相機拍攝,菌球直徑使用千分尺測量。
2結果與討論
2.1 氮源對米曲霉菌體形態和產酸的影響
采用單因素實驗在搖瓶中研究有機氮源和無機氮源對A. oryzae 發酵過程中形態和產酸的影響(表1)。結果發現,當以胰蛋白胨和大豆蛋白胨為氮源時,產酸和菌體生長均好于其余氮源。 研究發現,氮源種類對A. oryzae 菌體形態有顯著的影響,除尿素以外,其他所有氮源都能使A. oryzae 在培養基中形成數量、大小都不同的菌球。 氮源對A.oryzae 形態和L-蘋果酸生產的影響如表1 所示。當黃豆粉為氮源時,菌球濃度、菌球直徑、單位體積發酵液菌球總體積(V 值)比胰蛋白胨時分別提高4.90%,4.22%和18.9%;比大豆蛋白胨時分別提高114.0%、28.0%和347.1%。當氮源為黃豆粉和胰蛋白胨時,菌體質量濃度(以干質量計算)在15~16 g/L 左右。 當大豆蛋白胨作為氮源時菌體質量濃度達到最高 (23.7 ± 0.74) g/L。當氮源為胰蛋白胨時,L-蘋果酸產量和得率比大豆蛋白胨時分別提高22.3%和36.6%; 比黃豆粉為氮源時分別提高58.8%和19.1%. 但是,以大豆蛋白胨為氮源時,葡萄糖消耗比胰蛋白胨和黃豆粉時分別高出10.7%和49.2%。 因此,胰蛋白胨是最佳有機氮源。 此外,無機氮源的添加不利于A. oryzae 的生長和L-蘋果酸的積累。 當氮源為尿素時,A. oryzae 在發酵液中以大量菌絲和少量菌球狀呈現(圖1)。 以(NH4)2SO4和NH4Cl 為 氮 源 時, 菌 球 濃 度 分 別 為(110±6) 個/mL 和(86±4)個/mL,菌球直徑分別為(0.625±0.01) mm 和 (0.652 ± 0.01) mm,V 值均不超過15.0 mm3/mL。 以(NH4)2SO4為氮源時,菌體質量濃度比尿素和NH4Cl 時分別提高125.0%和4.85%。 以NH4Cl 為氮源時L-蘋果酸產量比尿素和(NH4)2SO4時分別提高13.8%和5.60%。尿素為氮源時葡萄糖消耗比(NH4)2SO4和NH4Cl 為氮源時分別高出36.7%和27.1%。 然而,當NH4Cl 和(NH4)2SO4為氮源時得率比尿素時均提高47.4%。 所以,NH4Cl為最佳無機氮源。 結果表明,以胰蛋白胨為氮源時,菌球濃度、菌球直徑、V 值、菌體質量濃度、L-蘋果酸產量、葡萄糖消耗和產率比NH4Cl 為氮源時分別提高137.2%、81.7%、1329.0%、158.9%、303.0%、101.5%和100.0%。 表明有機氮源促進菌體生長、L-蘋果酸積累和葡萄糖消耗并提高產率。 因此,胰蛋白胨是最佳氮源。
2.2 CaCO3 質量濃度對米曲霉菌體形態和產酸的影響
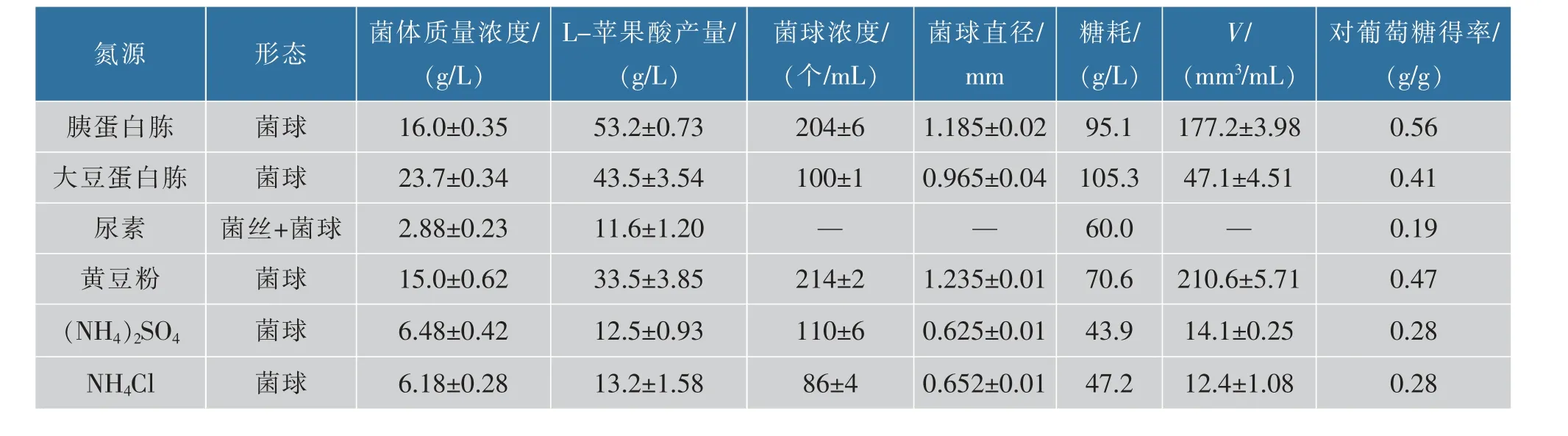
表1 氮源對米曲霉形態和L-蘋果酸生產的影響Table 1 Effect of nitrogen source on the morphology of Aspergillus oryzae and the production of L-malate
在培養基中添加CaCO3不僅能控制發酵過程的pH,中和蘋果酸形成鈣鹽沉淀,以固體顆粒存在的CaCO3對菌球形態也有明顯的影響。 研究表明,隨著CaCO3質量濃度從60 g/L 增加到100 g/L,A. oryzae 菌球濃度從208 個/mL 增加到250 個/mL,同時, 菌球直徑從1.173 mm 降低到0.810 mm,V值由(175.4±8.77)mm3/mL 降低到(69.4±1.70) mm3/mL。培養基中CaCO3質量濃度越高,固形物越多,對菌體的磨損程度就越高,菌球直徑逐漸減小。 此外,孢子在萌發過程中包裹一定量的CaCO3更有利于形成菌球。 CaCO3質量濃度對產酸和菌體濃度影響見圖2(a) (b)。 當CaCO3質量濃度為80 g/L 時,菌體濃度比當CaCO3質量濃度為60 g/L 和100 g/L 時分別高出13.7%和5.75%。 向培養基中添加80 g/L 的CaCO3時,最高在發酵144 h 后積累(59.7±1.71) g/L的L-蘋果酸, 比CaCO3質量濃度為60 g/L 和100 g/L時分別高出9.69%和5.87%。 在CaCO3質量濃度為80 g/L 時, 葡萄糖消耗比60 g/L 和100 g/L 時分別高出8.53%和1.38%。但是,CaCO3質量濃度為80 g/L時產率最高, 比60 g/L 和100 g/L 時分別提高1.79%和3.64%。 表明CaCO3最優質量濃度為80 g/L。
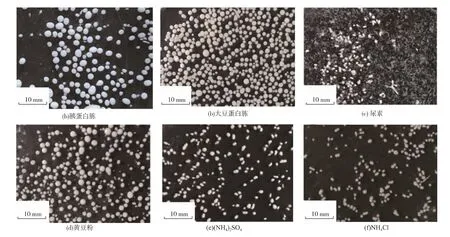
圖1 氮源對米曲霉形態的影響Fig. 1 Effect of nitrogen source on morphology of Aspergillus oryzae
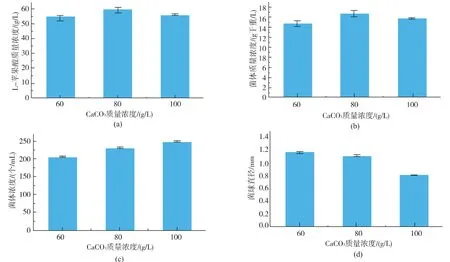
圖2 CaCO3 質量濃度對L-蘋果酸產量、菌體質量濃度、菌球濃度、菌球直徑和葡萄糖消耗的影響Fig. 2 Effect of concentration of CaCO3 on L-malate production,dry cell weight,pellet number,pellet size diameter and consumption of glucose
2.3 攪拌轉速對米曲霉菌體形態和產酸的影響
以搖瓶發酵優化結果為基礎,本工作研究了30 L 發酵罐中攪拌轉速對A. oryzae菌體形態和L-蘋果酸積累的影響。 當攪拌轉速為200 r/min 時,菌體在發酵罐中呈菌絲狀,當攪拌轉速在400~600 r/min范圍內,A. oryzae主要形成菌球, 隨著攪拌轉速的提高,單位體積發酵液中菌球濃度不斷增加,菌球直徑不斷減小(表2)。 攪拌轉速從400 r/min 提高到600 r/min 時,菌球濃度增加而菌球直徑減小。 攪拌轉速為600 r/min 時V值為(99.3±5.06) mm3/mL,比攪拌轉速是400 r/min 時降低了35.0%。不同轉速攪拌帶來的流體流動與剪切力會顯著影響菌體的形態,攪拌轉速越大,液體流動速度越快,剪切力越大,更利于形成數量多的小直徑菌球。 Park J P 等[16]考察了攪拌強度對蛹蟲草 (Cordyceps militaris) 菌體形態的影響, 研究表明攪拌轉速為300 r/min 時,菌球直徑小并且表面光滑, 但當攪拌轉速為50 r/min時,菌球大而松散。 菌體質量濃度也隨著攪拌轉速的提高而增加, 當攪拌轉速從200 r/min 增加到400 r/min時,菌體質量濃度提高了14.4%。原因可能是隨著攪拌轉速增加發酵液溶氧也不斷增加,從而利于菌體生長導致菌體質量濃度增加。 然而,當攪拌轉速繼續增加到600 r/min 時, 菌體質量濃度并沒有大幅度增加(約19.8 g/L)。 結果如圖3 所示,隨著攪拌轉速的提高,L-蘋果酸的產量也隨之增加, 當攪拌轉速是600 r/min 時, 最高積累83.0 g/L 的L-蘋果酸, 比攪拌轉速是200 r/min 和400 r/min 時分別提高了63.4% 和31.5%; 葡萄糖消耗比攪拌轉速是200 r/min 和400 r/min 時分別提高了24.1%和17.0%,產率比攪拌轉速是200 r/min 和400 r/min 時分別提高了31.4%和12.2%。 結果表明高攪拌轉速促進A. oryzae生長, 增加葡萄糖消耗和L-蘋果酸積累,最佳攪拌轉速是600 r/min。 在絲狀真菌發酵過程中, 在菌體形態和攪拌轉速之間有一種最優的狀態,在這種情況下,攪拌可能也會對細胞的氧氣供應進行調節[17]。
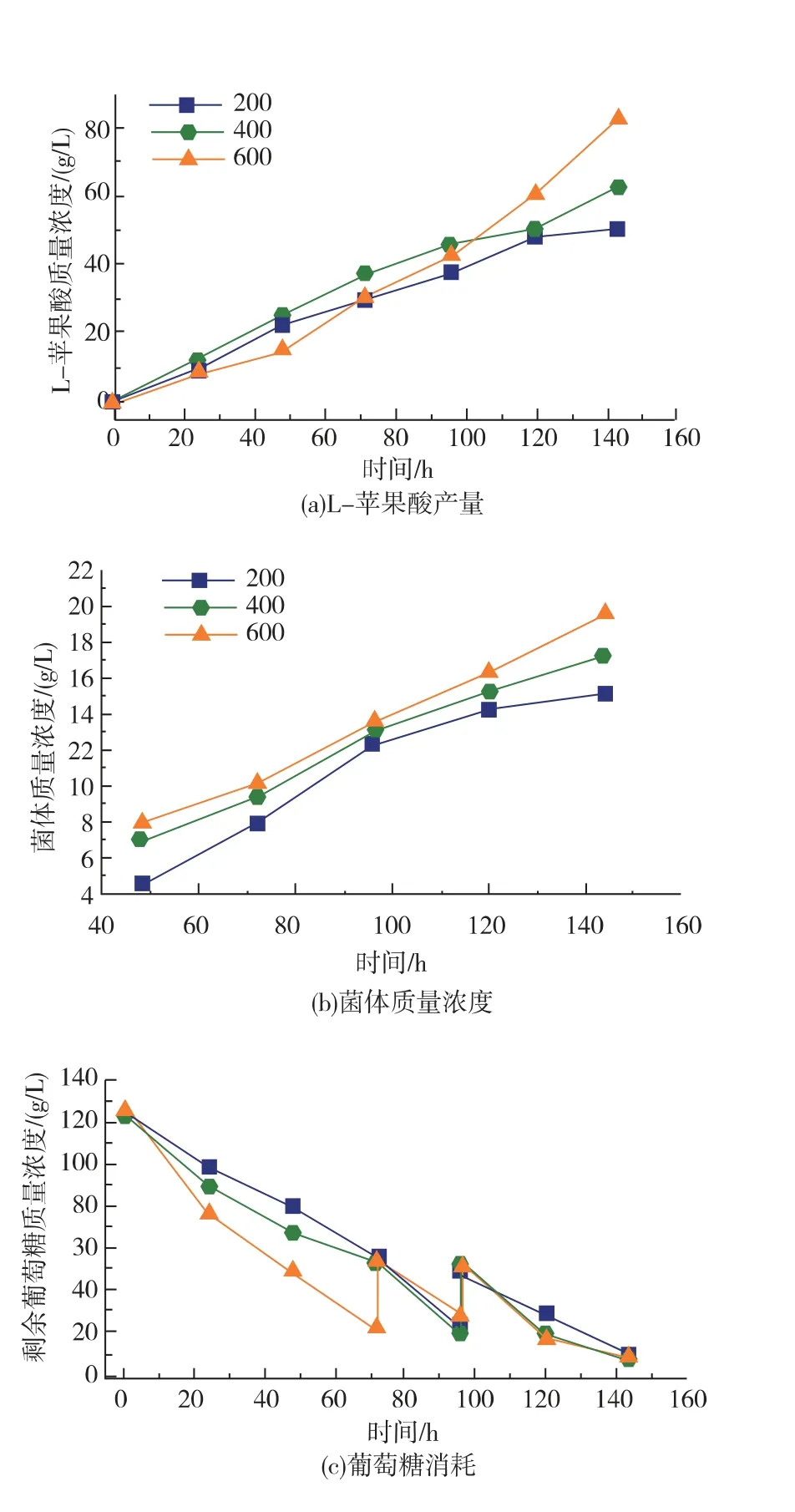
圖3 攪拌轉速對L-蘋果酸產量, 菌體質量濃度和葡萄糖消耗的影響Fig. 3 Effect of agitation speed on L-malate production,dry cell weight and consumption of glucose
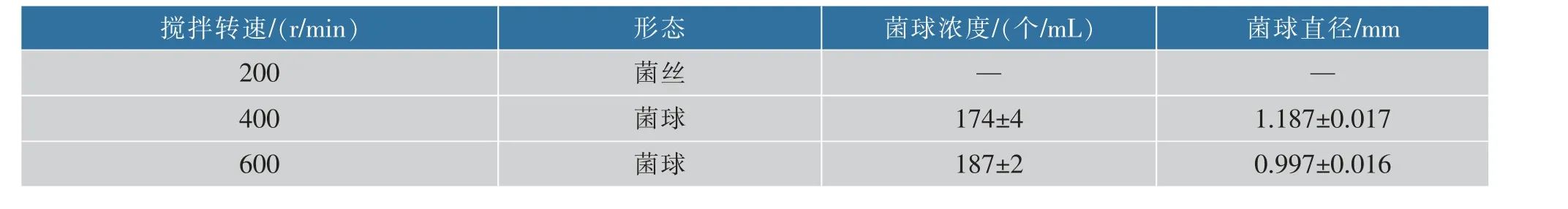
表2 攪拌轉速對菌體形態的影響Table 2 Effect of agitation speed on the morphology of Aspergillus oryzae
2.4 通氣對米曲霉菌體形態和產酸的影響
通氣條件同樣是影響發酵罐中溶氧水平的一個重要因素,因此進一步研究了通氣條件對A. oryzae菌體形態和產酸的影響。 如圖4 所示,隨著通氣量增加,單位體積發酵液菌球數量不斷增加,通氣量為3 vvm 時單位體積發酵液菌球濃度為(273±6) 個/mL,比通氣量為1 vvm 和2 vvm 時分別高出46.0%和8.76%。 通氣從1 vvm 提高到2 vvm 時菌球直徑從0.997 mm 降低為0.834 mm。 當通氣量為3 vvm 時,菌球直徑沒有進一步縮小(約0.832 mm)。 此外,通氣量為2 vvm 時,V 值比1 vvm 和3 vvm 時分別降低23.1%和10.2%。 菌體質量濃度隨著通氣量的提高也不斷增加,結果見圖4(b), 通氣量為3 vvm 最大菌體質量濃度為33.6 g/L,比通氣量為1 vvm 和2 vvm 分別高出69.8%和14.7%。 通氣量為2 vvm時,L-蘋果酸產量比1 vvm 和3 vvm 時分別提高32.5%和21.9%。 但是,葡萄糖消耗并沒有隨著通氣量的改變而發生明顯變化(~180 g/L),這表明增加通氣并不能促進葡萄糖消耗。 當通氣量為2 vvm時, 產率比1 vvm 和3 vvm 時分別提高34.8%和26.5%。因此,最適通氣量為2 vvm。結果表明氧氣的傳遞是影響L-蘋果酸在發酵罐中積累的一個重要因素,同樣的現象也存在于葡萄糖酸發酵過程中[9]。
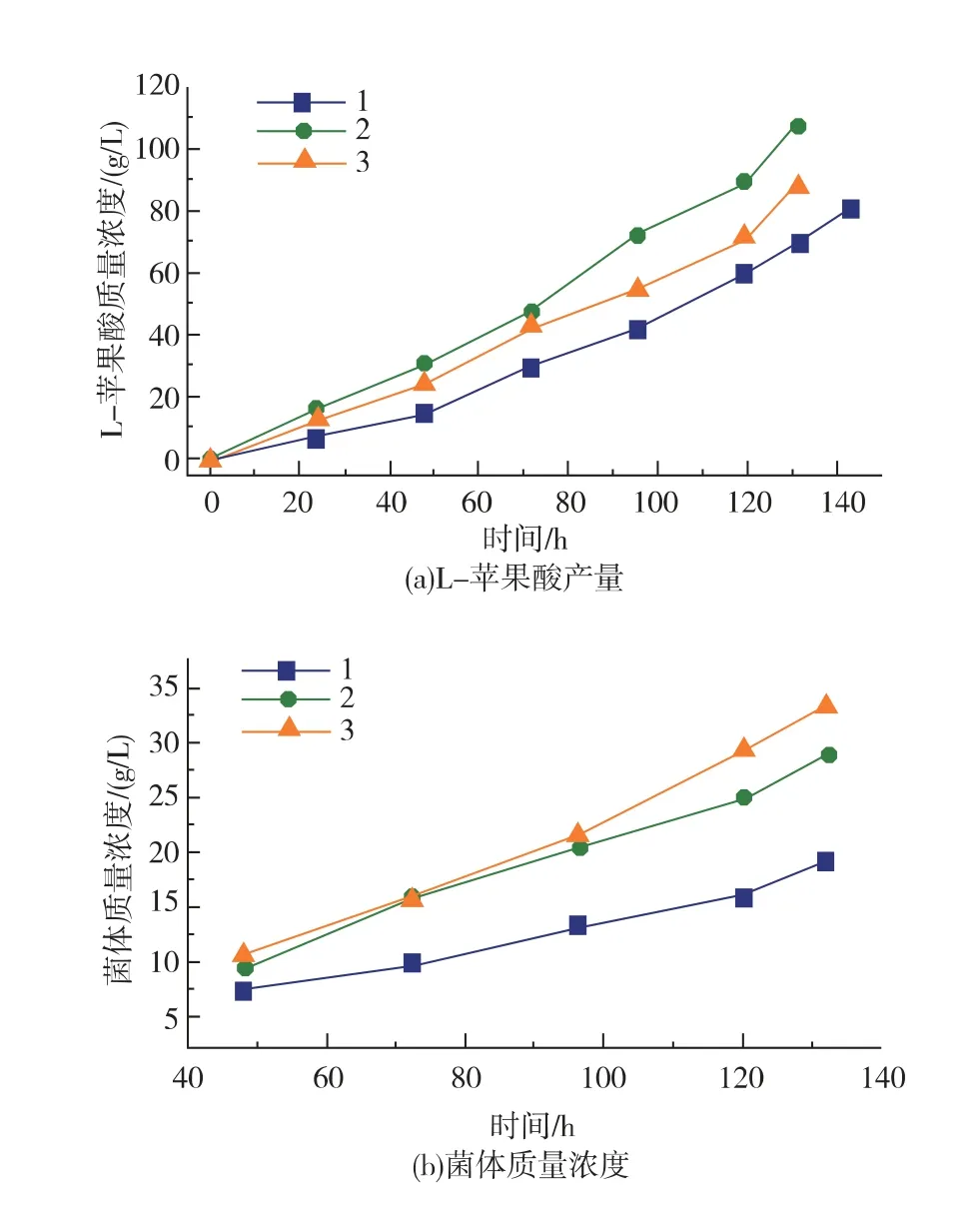
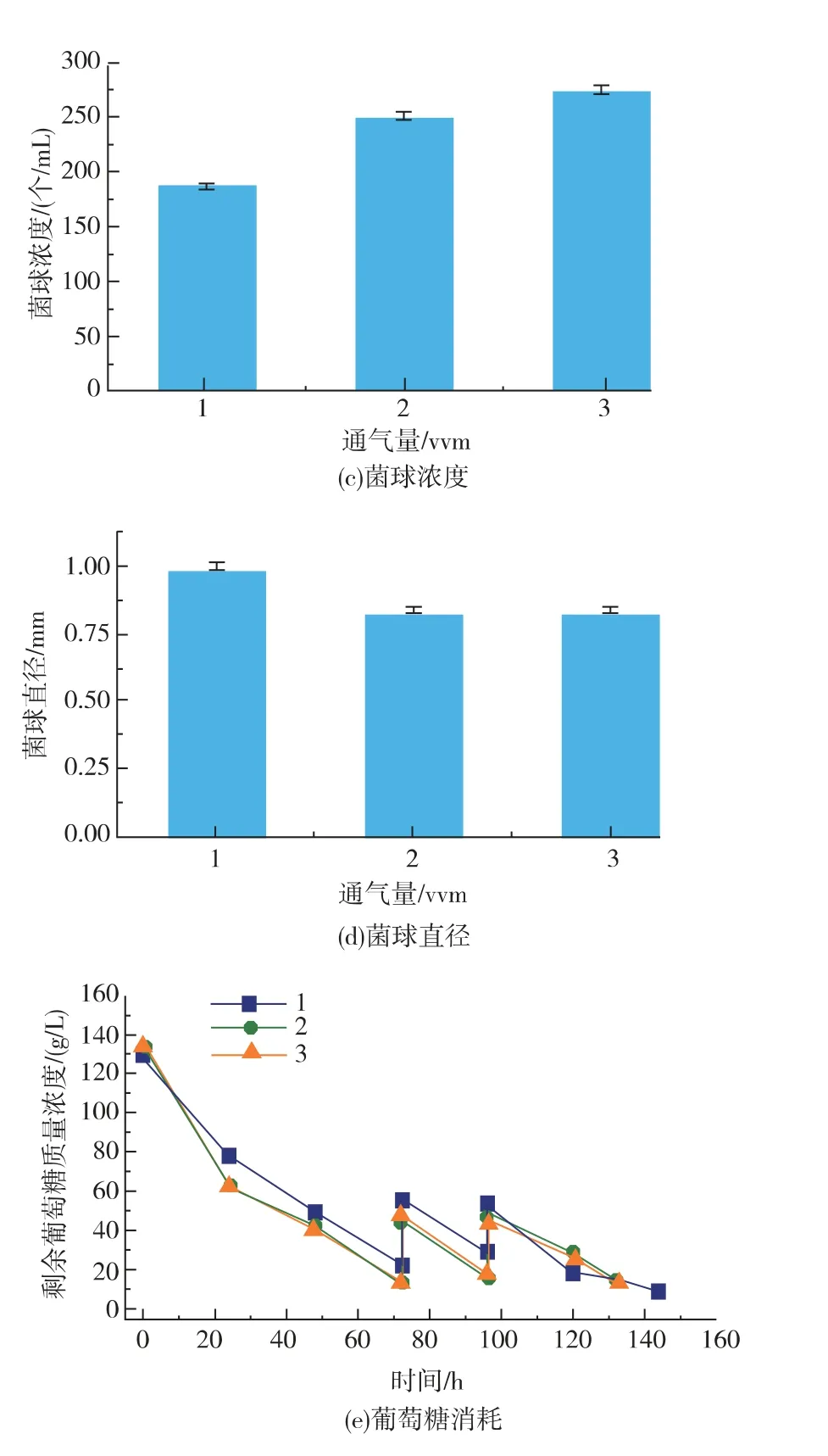
圖4 通氣量對L-蘋果酸產量、菌體質量濃度、菌球濃度、菌球直徑和葡萄糖消耗的影響Fig. 4 Effect of aeration rate on L-malate production,dry cell weight,pellet number,pellet size diameter and consumption of glucose
2.5 米曲霉形態對L-蘋果酸產量的影響
菌球形態與細胞代謝關系緊密,單位體積發酵液菌球總體積 (V 值) 與L-蘋果酸產量的關系如(圖5) 所示。 搖瓶上V 值與L-蘋果酸產量的關系是:y=-0.0046x2+1.1307x-0.6498,R2= 0.9897;發酵罐上V 值與L-蘋果酸產量的關系是:y=0.0091x2-2.6346x+253.53,R2=0.9684。 結果表明, 在搖瓶水平,L-蘋果酸產量隨著V 值增加先上升后降低;當V 值在122.9 mm3/mL 左右時,L-蘋果酸產量達到最高(約68.8 g/L)。 原因可能是當V 值低時,菌球個數和菌球直徑的值處于低水平,菌球內部結構疏松密度小不利于菌球生長和產酸, 而當V 值高時,菌球濃度和菌球直徑的值處于高水平,單位發酵液菌球數量增加導致發酵液粘稠,菌球直徑過小導致內部結構致密從而不利于O2和營養物質的傳遞[18]。在乳酸發酵過程中也出現了相似的情況,當菌球密度較低時內部中空不利于產酸, 而當菌球密度大于60 kg/m3時影響傳質抑制產酸[19]。 在發酵罐水平,L-蘋果酸產量隨V 值增加而逐漸降低, 當V 值為76.4 mm3/mL 時,L-蘋果酸產量最高為109.9 g/L。
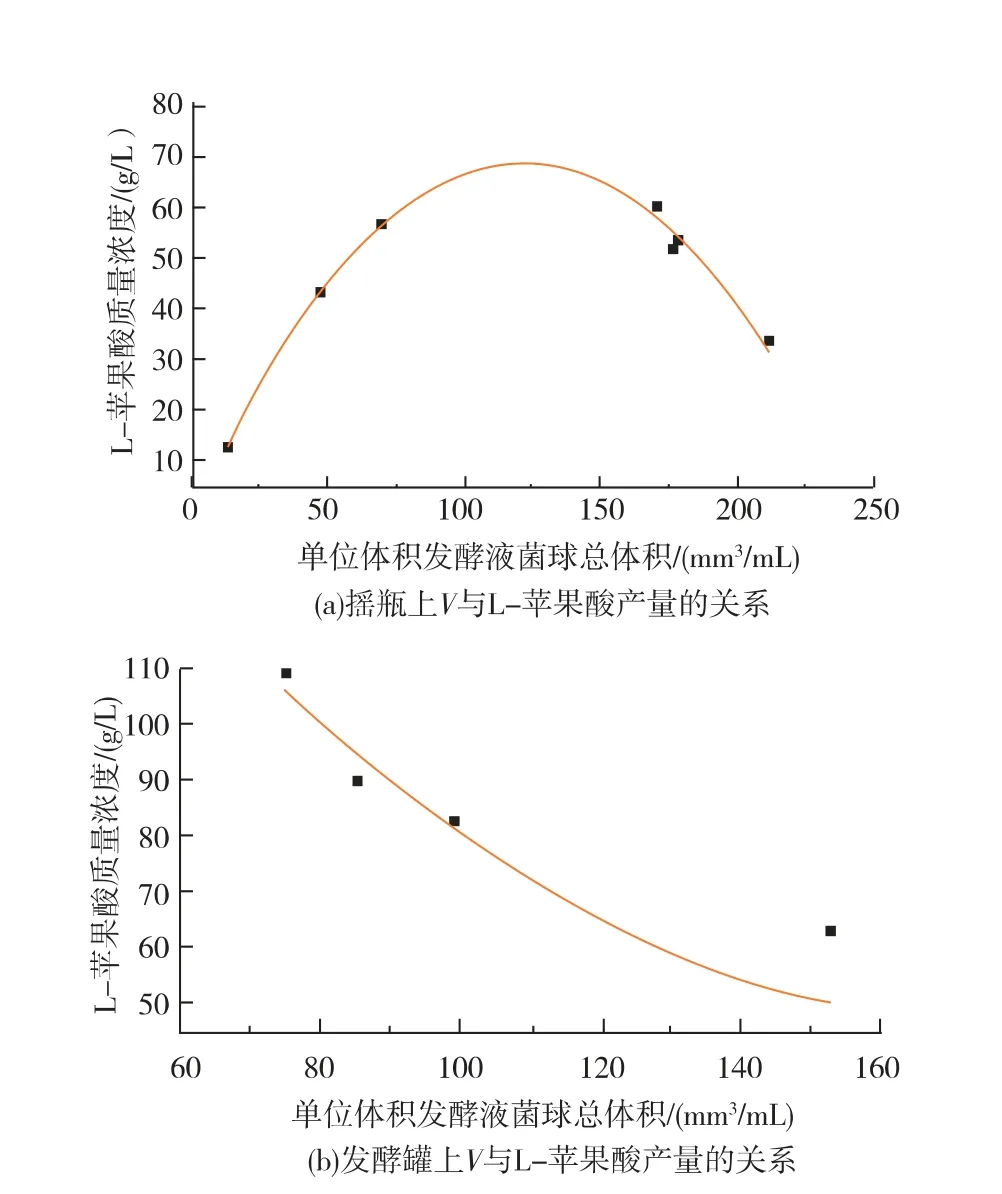
圖5 搖瓶上V 與L-蘋果酸產量的關系和發酵罐上V 與L-蘋果酸產量的關系Fig. 5 Relationship between the total of pellet in the unit volume fermentation (V) and L-malate production
3結 語
本文通過研究氮源種類、CaCO3質量濃度、攪拌轉速和通氣量對A. oryzae 菌體形態和L-蘋果酸產量的影響,得出最佳營養和環境條件為:胰蛋白胨為氮源,CaCO3質量濃度為80 g/L, 攪拌轉速600 r/min,通氣量2 vvm。以菌球濃度、菌球直徑和單位體積發酵液菌球總體積(V 值) 來表征形態,并研究得出V 值與L-蘋果酸產量的關系。 在30 L 發酵罐中:發酵132 h,菌球濃度251 個/mL,菌球直徑0.834 mm,V 值為76.4 mm3/mL,A. oryzae 消耗177.6 g/L 葡萄糖,L-蘋果酸質量濃度達到109.9 g/L,產率為0.62 g/g,生產強度達到0.83 g/(L·h)。

