紅鰭東方鲀及雜交鲀的腦和腎臟轉錄組比較分析
劉福君 保明秀 荊笛


摘要 為探究雜交鲀(紅鰭東方鲀×菊黃東方鲀)與紅鰭東方鲀差異的分子調節機制,利用Illumina高通量測序技術對紅鰭東方鲀及雜交鲀的腦、腎臟樣本組織進行轉錄組測序,篩選差異表達基因。結果表明:通過RNA-seq技術共篩選到2 207個DEGs (腦)和1 823個DEGs (腎臟)。其中在腦組織樣本中有1 068個DEGs表達上調,1 139個DEGs表達下調,腎臟組織樣本中有851個DEGs表達上調,972個DEGs表達下調;通過GO功能分類與KEGG富集分析,將腦組織的差異基因區分為60個功能類別及137個代謝途徑,包括G蛋白偶聯受體信號通路、跨膜轉運、分子功能調節劑、鈣離子結合等;腎臟組織的差異基因被區分為31個功能分類及142個代謝途徑,包括氧化還原酶活性、肽酶活性、蛋白水解、細胞外區域等。該研究探討了雜交鲀與紅鰭東方鲀生長發育差異過程的相關分子調控機制,可為后續相關研究提供初步理論參考與依據。
關鍵詞 紅鰭東方鲀;轉錄組;高通量測序;功能注釋
Abstract The study is to explore the molecular regulatory mechanism of the differences between the hybrid puffers fish(Takifugu rubripes×Takifugu flavidus) and Takifugu rubripes.In this study, Illumina highthroughput sequencing technology was used to sequence transcriptomes of the brain and kidney samples of Takifugu rubripes and hybrid puffers, screen differentially expressed genes. The results showed that 2 207 DEGs (brain) and 1 823 DEGs (kidney) were screened by RNAseq technology.Among them,1 068 DEGs were upregulated and 1 139 DEGs were downregulated in brain samples.And 851 DEGs were upregulated and 972 DEGs were downregulated in kidney samples.Through GO functional classification and KEGG enrichment analysis, the differential genes were divided into 60 functional categories and 137 metabolic pathways in the brain samples,which included Gprotein coupled receptor signaling pathway, transmembrane transport, molecular function regulator and calcium ion binding,etc..Differential genes in kidney tissue were divided into 31 functional categories and 142 metabolic pathways, which included oxidoreductase activity, peptidase activity, proteolysis and extracellular region,etc..This study discussed the mechanism of molecular regulation in the process of growth and development differences between hybrid puffers fish and Takifugu rubripes,which can provide a preliminary theoretical reference and basis for the followup research.
Key words Takifugu rubripes;Transcriptome;Highthroughput sequencing;Function notes
將帶有不同遺傳性狀的兩個親本進行雜交,產生的子代所具備的性狀均優于雙親的生物學現象,稱為雜交優勢(heterosis,hybrid vigor),比如雜交后代的抗逆性、早熟高產、品質優越等生物學現象。水產方面,我國成功培育了許多雜交鯉,如興國紅鯉與散鱗鏡鯉雜交產生的豐鯉、荷包紅鯉與沅江鯉雜交產生的荷沅鯉和建鯉、荷包紅鯉與湘江野鯉雜交產生的岳鯉等,研究發現雜交鯉產量至少增加30%,多者可達2.5倍以上[1-3],另外將鯽魚與其遠緣雜交的后代具有肉質鮮美、生長速度快、廣食性等優點[4-5]。
東方鲀屬屬于硬骨魚綱(Osteichthyes),鲀形目(Tetraodontiformes),鲀亞目(Tetraodontidei),鲀科(Tetraodontidae),在我國主要分布于東海、黃海及渤海[6],周邊地區主要分布在朝鮮半島和北太平洋西部的日本,代表物種是紅鰭東方鲀和菊黃東方鲀,其肉質營養豐富,蛋白含量高,是一種高經濟價值的魚類[7]。但是菊黃東方鲀的生長速度較慢,而紅鰭東方鲀是東方鲀中生長速率最快、體型最大的種類[8-9]。已有相關研究顯示紅鰭東方鲀和菊黃東方鲀的雜交后代,具有養殖存活率高、生長速度快等優良性狀,可利用其雜交優勢來進行增產增效。
轉錄組(transcriptome)有廣義與狹義上的解釋。廣義上轉錄組是指在特定條件下的細胞或組織的所有RNA總和,包括非編碼RNA (noncoding RNA)和信使RNA (mRNA),狹義上轉錄組是指細胞內全部轉錄出來的信使RNA,轉錄組具有空間與時間的限制,通過提供相應基因的時空表達情況來進一步確定其生理調節機制,具有高通量、高靈敏度、高準確性及成本相對較低等優勢,目前已廣泛應用于各種生物轉錄組的研究[10-12]。
該研究利用Illumina高通量測序技術對紅鰭東方鲀及雜交鲀進行轉錄組測序及比較分析,測序數據通過篩選、拼接和組裝,然后再進行功能分類、功能注釋及代謝途徑分析,以期為后期深入研究雜交河鲀生長發育的分子調控機制提供理論參考。
1 材料與方法
1.1 供試材料 試驗用魚為大連天正實業有限公司唐山咀東養殖場的紅鰭東方鲀和雜交鲀(紅鰭東方鲀×菊黃東方鲀),同一批孵化及同條件飼養情況下挑選活力較強、體格健壯、身體無損傷的成魚各10條。采樣所需的剪、咬骨鉗、鑷子、刀等器械均事先通過高壓滅菌鍋進行121 ℃,2 h滅菌,采樣前使用75%乙醇擦拭且經火焰消毒。將試驗魚現場解剖,分別取全腦及腎臟組織儲存于10倍體積的RNA later中,以便后續總RNA提取。
1.2 總RNA提取 cDNA文庫構建和測序
利用RNA提取試劑盒提取紅鰭東方鲀和雜交鲀(紅鰭東方鲀×菊黃東方鲀)的總RNA。為了保證試驗數據的高質量,上述提取的總RNA需要進行瓊脂糖凝膠電泳、紫外分光光度計和Aglient 2100方法檢測,主要包括樣品濃度、純度及完整性,A260/A280、A260/A230、28S/18S、RIN (RNA integrity number)。RNA質量要求有如下指標:RIN=7.0,A260/A280為1.8~2.0,28S/18S為1.5。通過完整性及純度檢測后,使用Oligo(dT)磁珠純化和進行mRNA的富集,隨后進行mRNA的分離及片段化,合成一鏈和二鏈cDNA。之后再進行3′末端加A,連接測序接頭末端修復,而后用AMPure XP beads篩選250~300 bp的cDNA,最后富集cDNA文庫。將上述cDNA文庫進行Illumina測序,首先過濾原始數據中低質量、末端質量低、含測序引物的reads,得到clean reads,然后再進行de novo拼接,最后通過CAP3軟件拼接來獲得最終Unigene序列集合[13]。使用DEGseq軟件找尋篩選差異表達基因(differentially expressed genes,DEGs)時以P<0.05作為標準[14]。
1.3 差異表達基因GO與KEGG富集分析
通過FPKM (fragments per kilobase of transcript per million fragments mapped)[14]方法對Unigenes進行DEGs表達量計算。通過軟件cuffdiff來分析轉錄本與基因水平上的差異表達,差異表達的基因和轉錄本需要滿足以下標準:計算表達倍數變化(fold change),需要|log2 FoldChange|>1;2個樣本中mapping reads數之和≥10;對P進行FDR校正得到Q,同時需要P≤0.05及Q≤1。最后將所得的差異表達基因單獨進行聚類分析、Pathway分析和GO功能分析。
2 結果與分析
2.1 轉錄組數據質控分析
分別取紅鰭東方鲀腦組織(H_B1)、腎臟組織(H_L1),雜交鲀(紅鰭東方鲀×菊黃東方鲀)的腦組織(Z_B2)和腎臟組織(Z_L2),利用RNA-seq技術對樣品文庫進行測序,分別得到Raw reads 59 463 756、48 936 330、49 340 508和49 165 672條;去除N含量超過10% (containing N)、帶有接頭(adapter related)和低質量(low quality)的reads以后得到Clean reads分別為58 214 792、48 236 284、48 530 284和47 363 626;Phred值大于20、30的堿基比例(Q20, Q30)分別為97.62%、98.20%、97.74%、98.12%(Q20)以及93.56%、94.75%、93.78、94.60% (Q30);總堿基數中堿基C和G數量總和占比分別為48.92%、53.79%、48.98%和52.56%(表1)。
2.2 差異基因的篩選
根據FPKM法[15-16]對樣品間差異進行分析,分別用紅色、藍色和綠色表示顯著上調基因、顯著下調基因和無顯著性差異基因,結果顯示共得到差異表達基因(DEGs)共2 207個(腦組織,圖1)和1 823個(腎臟組織,圖2)。其中雜交鲀的腦組織樣本相對于紅鰭東方鲀的腦組織樣本表達上調的DEGs有1 068個,表達下調的有1 139個。各差異表達基因的水平不同(log2FoldChange高度不同),差異水平變化主要存在于>2~≤7 (上調基因占48.36%, 下調基因占51.64%),其次為>0~≤2 (上調基因占45.23%,下調基因占54.77%),最后是>7~≤15 (上調基因占71.33%,下調基因占28.67%);而雜交鲀的腎臟組織樣本相對于紅鰭東方鲀的腎臟組織樣本表達上調的有851個,表達下調的有972個,同樣主要集中在>2~≤7 (上調基因占39.66%, 下調基因占60.34%),其次為0~≤2 (上調基因占55.14%, 下調基因占44.86%),最后是>7~≤15 (上調基因占49.36%,下調基因占50.64%) (表2)。
2.3 差異基因GO分析
差異表達基因經過GO富集分析可分為三大類,分別是描述基因產物及個體基因的分子功能(molecular function, MF),描述亞細胞結構、位置及大分子復合體的細胞組成(cellular component, CC)與描述參與基因編碼的生物學過程(biological process, BP)。對篩選到的差異表達基因進行GO富集分析,結果顯示在紅鰭東方鲀和雜交鲀的腦組織樣本中,差異表達基因可主要歸納于35個生物學過程、15個細胞組成以及10個分子功能(圖3)。
在生物學過程中以G蛋白偶聯受體信號通路(G-protein coupled receptor signaling pathway) (70個)和跨膜轉運(transmembranetransport) (66個)存在較多差異表達基因;在分子功能方面,差異表達基因集中于分子功能調節劑(molecular function regulator) (69個)以及鈣離子結合(calcium ion binding)(66個)。
而在腎臟組織樣本中,差異表達基因主要歸納于26個分子功能、4個生物學功能和1個細胞組成(圖4)。差異表達基因在分子功能中以氧化還原酶活性(oxidoreductase activity) (70個)和肽酶活性(peptidase activity) (66個)居多;生物學過程上集中在氧化還原過程(oxidationreduction process) (66個)及蛋白水解(proteolysis) (65個);在細胞組成上則存在于細胞外區域(extracellular region) (51個)。結果表明紅鰭東方鲀和菊黃東方鲀的雜交后代在生長發育上主要是通過以上富集途徑的差異表達基因來調控的。
2.4 KEGG代謝途徑分析
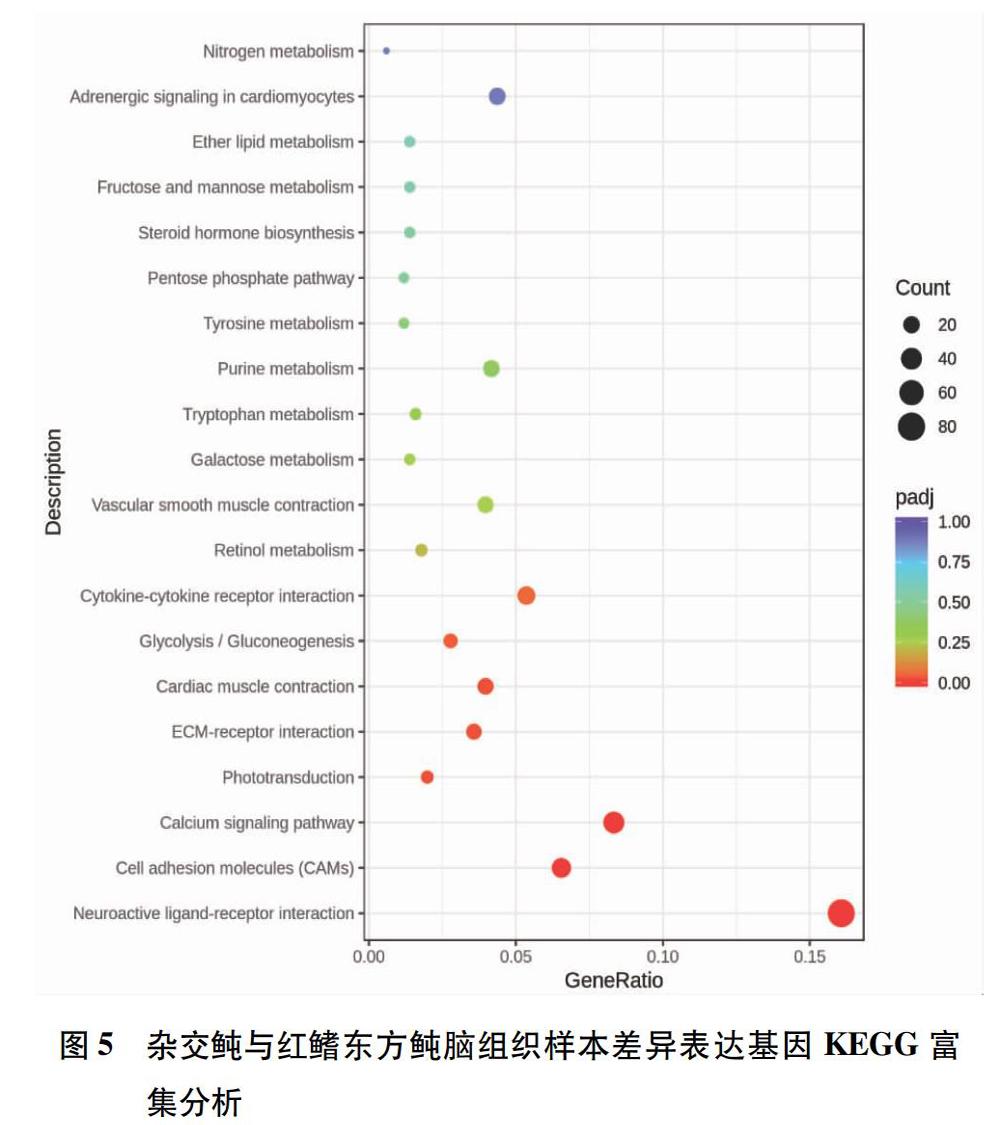
選取padj值最小的前20條通路(pathway),以顏色來區分不同padj范圍,點的大小來表示注釋到KEGG通路編號上的差異基因數,從而繪制散點圖。如圖5所示,腦組織樣品經過KEGG富集分析共建立了137條pathway,在神經活性配體-受體相互作用(neuroactive ligandreceptor interaction)中差異表達基因最多,共有81個;其次為鈣信號通路(calcium signaling pathway),達42個;細胞黏附分子(cell adhesion molecules,CAMs)達33個。另一方面,腎臟組織樣品經KEGG富集分析共建立了142條pathway,其中神經活性配體-受體相互作用達40個;NOD樣受體信號通路(NODlike receptor signaling pathway)達30個(圖6)。這些通路的padj值較小,說明這些通路的富集程度較高。結果表明紅鰭東方鲀和雜交鲀的腦組織和腎臟組織樣品中以神經活性配體-受體相互作用中相關差異基因的表達最為活躍。
3 討論與結論
通常情況下雜交后代會比親本的抗逆性強、早熟高產、品質優越等。前期已有相關研究顯示紅鰭東方鲀和菊黃東方鲀的雜交后代在生長速率方面顯著高于菊黃東方鲀,但未超過紅鰭東方鲀,而在肉質方面,雜交東方鲀和菊黃東方鲀保持了基本一致的極佳口感,且對低水溫、重金屬離子、鹽度的波動均有良好的抗逆性[17-19]。
該研究應用Illumina高通量測序技術對紅鰭東方鲀及雜交鲀(紅鰭東方鲀與菊黃東方鲀雜交后代F1)腦和腎臟的轉錄組測序,分別篩選到2 207個和1 823個差異表達基因進行GO富集分析和KEGG功能富集分析,結果顯示雜交鲀與紅鰭東方鲀的差異表達基因主要富集在神經活性配體-受體相互作用過程、NOD樣受體信號通路和鈣信號通路過程等,且在神經活性配體-受體相互作用過程中存在生長激素(growth hormone, GH)和催乳素(prolactin,PRL)的調控。在魚類的生長內分泌調控方面,催乳素和生長激素都是較為重要的影響因素[20],其對魚類的生長發育起到了重要作用,如催乳素可以維持體內外電解質和水的平衡、調節內分泌與新陳代謝、腦功能和行為協調、免疫調節和保護、繁殖以及促進生長和發育[21];而生長激素可以促進消化系統的氨基酸吸收及增加組織細胞的RNA合成進而促使魚體蛋白質合成,提高食物轉化率,還有調節魚類生殖功能、促進體細胞分裂、增強魚體免疫力和刺激骨骼肌肉組織發育等效果[22-23]。因此初步推測神經活性配體-受體相互作用過程、NOD樣受體信號通路和鈣信號通路過程可能是雜交鲀雜交優勢的主要由來,但還需要進一步研究證明。
該研究通過對紅鰭東方鲀及雜交鲀的轉錄組比較分析,揭示了神經活性配體-受體相互作用途徑可能參與調控出了雜交鲀的雜交優勢,為后期繼續進行雜交鲀和紅鰭東方鲀生長發育差異過程的相關分子調控機制的研究提供了初步理論依據與參考,有利于進一步提高雜交河鲀的經濟價值。
參考文獻
[1] 馬仲波,唐鋼勝,張峰,等.鯉魚三雜交[(荷包紅鯉♀×元江鯉? ♂)♀×鏡鯉? ♂]遺傳改良與利用的研究[J].淡水漁業,1984(6):25-27.
[2] 潘光碧,唐剛勝,杜森英,等.鯉鯽移核魚與散鱗鏡鯉雜交優勢及遺傳性狀的研究[J].水產學報,1989,13(3):230-238.
[3] 佟雪紅,董在杰,繆為民,等.建鯉與黃河鯉的雜交優勢研究及主要生長性狀的通徑分析[J].大連水產學院學報,2007,22(3):159-163.
[4] 陳學年,郭玉娟.彭澤鯽與興國紅鯉雜交優勢的研究與利用[J].淡水漁業,2000(9):14-16.
[5] 陳林,朱曉鳴,韓冬,等.芙蓉鯉鯽幼魚飼料適宜淀粉含量[J].水生生物學報,2016,40(4):690-699.
[6] 雷霽霖. 海水魚類養殖理論與技術[M].北京:中國農業出版社,2002:683-702.
[7] 韋眾.河鲀魚的生物學特性及其養殖(綜述)[J].安徽農業大學學報,1999,26(4):436-439.
[8] 萬玉美,趙海濤,張福崇.紅鰭東方鲀、菊黃東方鲀及其雜交F1幼魚耗氧率與窒息點研究[J].水產科學,2013,32(1):21-25.
[9] 趙海濤,萬玉美,張福崇,等.菊黃東方鲀(♀)×紅鰭東方鲀(♂)F1代及其親本肌肉營養成分的比較分析[J].大連海洋大學學報,2013,28(1):77-82.
[10] 劉偉,王騰蛟,唐海琳,等.高通量細菌鑒定方法研究進展[J].微生物學通報,2014,41(12):2501-2509.
[11] POLICHT F A,SONG M H,SITAILO S,et al. Analysis of genetic copy number changes in cervical disease progression[J]. BMC Cancer, 2010, 10(1):432-438.
[12] 張春蘭,秦孜娟,王桂芝,等.轉錄組與RNA-Seq技術[J].生物技術通報,2012(12):51-56.
[13] 李琳,馮帥,汪瑩,等.鼠傷寒沙門菌ATCC13311誘導耐藥株的轉錄組測序和分析[J].中國獸醫學報,2015,35(7):1088-1094,1111.
[14] ANDERS S,HUBER W.Differential expression analysis for sequence count data[J]. Genome Biol,2010, 11:1-12.
[15] TRAPNELL C,WILLIAMS B A,PERTEA G, et al. Transcript assembly and quantification by RNAseq reveals unannotated transcripts and isoform switching during cell differentiation[J].Nat Biotechnol,2010,28(5):511-515.
[16] TRAPNELL C,ROBERTS A,GOFF L,et al. Differential gene and transcript expression analysis of RNAseq experiments with TopHat and Cufflinks[J].Nat Protoc,2012,7(3): 562-578.
[17] 范文濤,劉海金,趙文江,等.菊黃東方鲀♀×紅鰭東方鲀 ♂雜交后代早期形態特征及生長速度的比較[J].水產學報,2011,35(7):1065-1071.
[18] 張福崇,萬玉美,方笑,等.鹽度對雜交東方鲀存活和攝食的影響[J].河北漁業,2012(12):2-6.
[19] 張福崇,趙海濤,萬玉美.雜交河魨F1代苗種生產與養殖技術研究[J].河北漁業,2011(10):19-21,32.
[20] 于力群,王厚鵬,朱作言,等.生長激素/催乳素家族配體和受體成員在斑馬魚早期胚胎中的表達比較和交叉活性分析[J].水生生物學報,2014,38(5):809-818.
[21] 張耀,郭定宗.催乳素結構與功能研究進展[J].動物醫學進展,2007,28(5):49-52.
[22] 匡剛橋,劉臻,魯雙慶.魚類生長激素基因的研究現狀及展望[J].水利漁業,2006(6):1-3.
[23] 徐斌,李德尚,張培軍.魚類生長激素的分子生物學和應用研究的進展[J].海洋與湖沼,1997(5):553-557.

