不同光質LED光源對魚腥草幼苗膜脂過氧化及抗氧化酶的影響
申圣圣 楊利艷 喬美玉 王昭清 王創云


摘 要: 以魚腥草為材料,以日光燈處理為對照,分析了不同光質LED光源(白、紅、黃、綠、藍LED燈)對魚腥草葉片活性氧、類黃酮含量及抗氧化酶的影響。結果表明,藍光下葉片中TBARS(硫代巴比妥酸)含量最高,較對照高30.18%,與希夫試劑染色結果相一致;過氧化氫產生最多,較對照高190.21%,與DAB染色結果一致;超氧陰離子產生速率在藍光下最高,為對照組的1.54倍,白光下最低;藍、綠光下脯氨酸含量是對照的2倍;藍光和黃光處理下,黃酮含量較對照提高了21.4%。藍、綠光提高了SOD2同工酶的表達,且在藍光下最高;藍、綠、紅、黃光處理分別誘導了更多的POD基因位點的表達;不同LED光質均提高了CAT抗氧化酶活性,其中藍、綠光下CAT同工酶的表達量明顯高于對照。綜上所述,藍色光處理可以有效提高幼苗的抗氧化能力,可為魚腥草品質的控制提供參考。
關鍵詞: 魚腥草; LED; 活性氧; 抗氧化; 黃酮
中圖分類號: S636.9? ?文獻標志碼: A? ?文章編號:1673-2871(2020)04-017-06
Abstract: In this study, Houttuynia cordata Thunb. was used as plant material, and the group with fluorescent lamp treatment was the control group. The effects of LED light with different light quality (white, red, yellow, green and blue LED lights) on reactive oxygen species, flavonoids content and antioxidant enzymes of Houttuynia cordata Thunb. leaves were analyzed. The results showed that under blue light, the TBARS content was the highest, 30.18% higher than the control group, which was consistent with Schiff reagent staining results. And hydrogen peroxide produced the most, 190.21% higher than the control group, which agreed with DAB staining. The superoxide anion production rate was the highest under blue light which was 1.54-fold compared with the control group, and it was the lowest under white light treatment. Proline content was 2-fold to the control group. The content of flavonoids increased by 21.4% in blue and yellow light treatments compared with the control group. Blue and green light enhanced the expression of SOD2 isoenzyme, and it was the highest under blue LED. Blue, green, red and yellow LED induced more POD gene loci expression, respectively. The various LED monochromatic light improved the CAT activity, within them, CAT activity in blue and green light treatment was obviously improved. In conclusion, blue light treatment can effectively improve the antioxidant capacity of seedlings.
Key words: Houttuynia cordata Thunb.; LED; Reactive oxygen species; Antioxidant
魚腥草(Houttuynia cordata Thunb.)又名折耳根,為多年生草本,全株有腥臭味,常呈紫紅色[1]。作為我國的傳統中藥植物,魚腥草不僅具有抗菌、抗病毒等藥用價值,同時富含大量的碳水化合物、膳食纖維、氨基酸和一些生命活動必需的礦質元素,是中國衛生部評定的藥食兩用植物[2]。近年來,隨著人們物質生活水平和保健意識的提高,可食用植物的保健價值受到越來越多的關注,天然抗氧化物質成為大眾關注的熱點。
光照是植物生長發育過程中的重要環境因子,它不僅是植物進行光合作用的能量來源,而且還作為環境信號對植物的代謝起調控作用[3-4]。20世紀50年代,試驗證實了光質的存在并發現其調控植物的生長。大量研究表明,光質對植物的光形態建成、光合特性、內源激素、生物產量以及抗氧化系統都有影響[5]。由于植物識別光質的受體不同,因此不同光質對植物發育及代謝的影響不盡相同[6]。光質的變化會引起植物代謝的相應改變,發光二極管(LED)作為新型半導體固態冷光源,具有發光效率高、發熱低、體積小、能耗低、壽命長等優點,能提供植物生長所需的特定光譜[7-8]。對LED單色光譜的光源進行組合能提高光合作用效率,節約能源[9]。目前LED光源已應用于植物組織培養、設施園藝、蔬菜栽培、溫室補光、種苗生產和芽苗菜培養等領域。有研究表明,單色LED紅光、藍光處理能夠提高植物抗氧化酶POD、SOD和CAT的活性,而綠光則有抑制作用[10]。不同光質處理如何影響魚腥草活性氧的產生,如何利用LED光源提高其抗氧化能力值得進一步研究。
筆者以不同光質LED光源培養魚腥草,通過組織化學染色對其在代謝過程中產生的一系列活性氧如TBARS(硫代巴比妥酸)、H2O2(過氧化氫)、O2-·(超氧陰離子)進行了測定,并分析了不同光質LED下黃酮的積累及抗氧化酶活性,以期為利用LED燈提高魚腥草抗氧化能力提供基礎研究。
1 材料與方法
1.1 材料
采用優質魚腥草(購自湖北宜昌)根莖進行繁殖。
1.2 方法
試驗于2017年4月12日至8月20日在山西臨汾,山西師范大學3號樓生物工程實驗室內進行。將新鮮魚腥草根莖放在盛有適量自來水的塑料水培槽中,置于光照培養箱中進行培養,溫度25 ℃/20 ℃,光照周期晝/夜(8 h/16 h),每3 d換水1次,待魚腥草根莖上的幼芽完全展開后,將長勢較好的魚腥草移栽到盛有25% Hoagland營養液的水培槽中按原條件培養。待第3片葉子完全展開后,移到溫室用不同光質的LED光源處理(表1),3周以后取材測定。
1.3 生理指標測定
1.3.1 TBARS含量的測定及脂質過氧化染色顯示? 以TBARS含量表示脂質過氧化。用0.1%(w)三氯乙酸溶液冰浴研磨提取,取上清,加入0.5%TBA(溶解于20%三氯乙酸),依次在450、532、600 nm測定吸光值[11],計算TBARS含量:TBARS含量(μmol·g-1)=6.45(OD532-OD600)-0.56×OD450。脂質過氧化程度根據希夫試劑染色法測定,染色后拍照[12]。
1.3.2 過氧化氫含量的測定及組織化學染色 用硫酸鈦比色法測定過氧化氫含量,測定波長412 nm的吸光度。以吸光度值為縱坐標,過氧化氫物質的量(nmol)為橫坐標,制作標準曲線并分析結果。用DAB染色法顯示過氧化氫含量[13-14]。
1.3.3 超氧陰離子的產生速率測定 用羥胺法測定超氧陰離子產生速率[15],530 nm處測定吸光度。超氧陰離子產生速率(nmol·min-1·g-1)=(n×V×1 000)/(Vs×t×m)。式中:n是由標準曲線所查的溶液中的超氧陰離子的物質的量(μmol);V是樣品提取液總體積(mL);Vs是測定時取樣液體積(mL);t是樣品與羥胺反應的時間(min);m是樣品鮮質量(g)。
采用NBT方法測定超氧陰離子含量:將魚腥草浸泡于0.1%的NBT染色,在乙醇中脫色后拍照[16]。
1.3.4 脯氨酸(Pro)含量的測定 用磺基水楊酸比色法測定[17]。脯氨酸含量(mg·g-1)=(C×V)/(W×Vs×103)。式中:C是根據回歸方程計算的脯氨酸含量(μg·mL);V是提取液總體積(mL);Vs是測定時取用樣液的體積(mL);W是樣品干質量(g)。
1.3.5 黃酮類化合物的測定 黃酮類化合物的提取以乙醇為溶劑,采用索氏回流法提取[18],以蘆丁為標品繪制標準曲線測定黃酮類物質的含量。黃酮含量(μg·mL-1)=C×V×10-6式中:C是從標準曲線查得的黃酮濃度(μg·mL-1);V是提取的濃縮液體積(mL);10-6是將μg·mL-1換算的系數。
1.3.6 同工酶電泳分析 稱取各處理組0.2 g魚腥草葉片,棄葉脈,制備粗酶液,離心、取上清與等體積上樣緩沖液,進行PAGE同工酶凝膠電泳,然后將凝膠置于盛有顯色液的培養皿中,于搖床上顯色觀察。
超氧化物歧化酶同工酶(SOD)染色采用氮藍四唑(NBT)光還原法;過氧化物酶(POD)同工酶采用聯苯胺染色法;過氧化氫酶(CAT)同工酶采用 FeCl3染色法[19-21]。
2 結果與分析
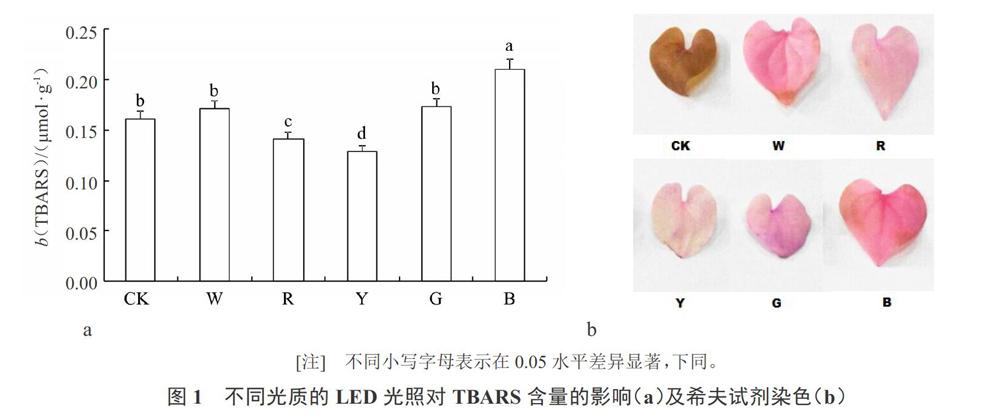
2.1 不同光質的LED光源對TBARS含量的影響
不同光質的LED光源培養條件下,魚腥草葉片TBARS含量變化如圖所示(圖1-a)。與對照組相比,在LED藍光、綠光、白光下,TBARS含量均有提高,分別提高了26.2%、13.0%、9.8%;在黃光、紅光下,TBARS含量分別降低了20.2%、8.2%;藍光下TBARS含量最高,表明LED藍光下葉片膜脂受到傷害最大。
在不同光質的LED下,魚腥草葉片希夫試劑的染色結果如圖所示(圖1-b),顏色深淺反應了膜脂的過氧化程度。其顏色變化由深到淺如下:藍光、綠光、白光、對照組、紅光、黃光,與TBARS測定結果一致。
2.2 不同光質的LED光源對過氧化氫含量的影響
在不同光質的LED培養下,魚腥草葉片過氧化氫含量變化如圖所示(圖2-a),與對照組相比,除紅光組外,其他光質處理極顯著地提高了過氧化氫的含量。紅光組、黃光組、綠光組、白光組和藍光組分別提高了6.6%、40.6%、75.8%、86.9%、170.0%,結果表明,不同光質的LED光源普遍使過氧化氫含量增加,用藍光處理時含量的變化最顯著。
DBA能和過氧化氫反應生成深褐色的聚合物,葉片顏色的深淺反應了過氧化氫的積累量。本試驗中,對照組中生成的聚合物顏色最淺,藍光照射下葉片的染色最深,與測定結果一致(圖2-b)。
2.3 不同光質的LED光源對魚腥草超氧陰離子生成速率及含量的影響
不同光質LED對魚腥草葉片超氧陰離子產生速率不同(圖3-a)。與對照組相比,藍光和黃光顯著提高了超氧陰離子的產生速率,分別提高了49.00%、38.18%;白光和綠光處理下超氧陰離子產生速率顯著降低。即超氧陰離子在LED藍光下產生速率最高,白光下最小。魚腥草葉片中NBT染色如圖(圖3-b)。LED藍光下葉片的染色最深,白光下葉片染色最淺,組織化學染色與試驗數據結果一致。
2.4 不同光質的LED光源對魚腥草葉片脯氨酸含量的影響
在不同光質的LED培養下,魚腥草葉片脯氨酸含量變化如圖所示(圖4),與對照組相比,不同光質的LED光源均顯著提高了魚腥草葉片中脯氨酸的含量,其中藍光與綠光組的脯氨酸含量最高,兩組間差異不顯著;紅光與白光組的脯氨酸含量差異不顯著,低于藍光、綠光組;黃光組與其他各組之間存在明顯的差異。藍光、綠光下脯氨酸的含量較其他光質處理高。
2.5 不同光質的LED光源對魚腥草葉片黃酮含量的影響
在不同光質的LED燈下 ,魚腥草葉片中的黃酮類化合物含量變化如圖5,不同波長的LED光均顯著提高了黃酮類物質的含量,紅、黃、綠、藍光組分別較對照提高了15%、22%、20%、22%,但這4組的黃酮類含量差異不顯著;LED白光組的黃酮類化合物含量較對照組變化也顯著。可以看出,藍光、黃光最大程度地提高了葉片中黃酮含量,綠光次之,說明LED光源能夠促進魚腥草黃酮類化合物的合成,且單色光源有顯著的促進作用。
2.6 對魚腥草葉片SOD同工酶的影響
SOD是生物體內重要的抗氧化酶,是清除自由基的首要物質,與體內的CAT和POD一起組成一條完整的防氧化鏈條,完成對超氧自由基的清除。在不同光質的LED燈下 ,魚腥草葉片中的SOD同工酶表達量變化如圖6、表2,結果顯示,藍色、綠色波長的LED光顯著提高了SOD1、SOD2同工酶的表達量,且在藍光下的表達量為最高,黃光抑制了SOD1、SOD2的表達量,但最大程度激發了SOD3的表達。說明藍色LED光對清除魚腥草超氧自由基起到積極作用。
2.7 對魚腥草葉片POD同工酶的影響
在不同光質的LED燈下,魚腥草葉片中的POD同工酶表達量變化如圖7、表3,POD是對環境變化非常敏感的氧化酶。本試驗結果發現,紅、黃、綠、藍光處理分別誘導了更多的POD基因位點表達,其中,綠光誘導了POD3、POD4和POD7 3條譜帶;紅光、藍光則誘導了POD3、POD7;白光處理與對照組POD基因的表達一致。比較各譜帶的IOD可知:POD1、POD2、POD5和POD6的表達量在大多LED單色光處理下均高于對照組。說明LED光源能夠促進魚腥草對POD同工酶的表達,且多數情況下單色光源有顯著的促進作用。
2.8 對魚腥草CAT同工酶的影響
在不同光質的LED燈下,魚腥草葉片中的CAT同工酶表達量變化如圖8、表4,經多次不同的凝膠染色方法對CAT同工酶染色確定,魚腥草的CAT同工酶僅有一條酶帶。不同光質影響了CAT的表達量,但并沒有誘導更多的CAT基因位點表達。對IOD分析表明CAT的表達量依次為綠光>白光>藍光>紅光>黃光>對照,即以上光質均提高了CAT的表達。表明單色LED光源對CAT同工酶含量的表達具有促進作用。
3 討論與結論
植物生長受諸多環境因子的影響,逆境會造成植物的膜脂產生過氧化損傷。TBARS是膜脂過氧化的產物,可以作為膜脂過氧化程度的指標,本試驗結果表明,藍光對膜脂的傷害最大,綠光次之,與短波能量高相一致,也與胡陽的研究結果相一致(REF)[22]。當植物所受脅迫超過其自身調節能力時,植物體內活性氧(ROS)的代謝平衡遭到破壞,過量的活性氧會引發膜脂的過氧化從而使生物膜系統遭到破壞,造成細胞結構和功能受損甚至導致植物體死亡。測定組織中自由基的活躍狀態,可間接了解組織受損狀況以及抗性強弱。本試驗結果表明,藍光下魚腥草葉片O2-·產生速率最快,含量最多,與盧素萍[23]的研究結果一致,且各LED處理下植物組織中的過氧化氫含量都高于對照組。
抗氧化系統是植物重要的防御系統,包括抗氧化酶和一些分子如脯氨酸。在生物體內,脯氨酸不僅僅是理想的滲透調節物質,而且還可作為膜和酶的保護物質及自由基清除劑[24]。筆者研究發現,綠光和藍光處理組中脯氨酸含量最高,由于短波能量高對膜的氧化損傷加劇,所以植物通過積累更多的脯氨酸來降低對膜的損傷,這是植物的自我防御響應[25]。但王莉榮等[26]研究表明,紅光處理提高了葡萄試管苗中游離脯氨酸含量,可能與不同物種或處理強度不同有關。
張寒等[27]研究表明,單色LED紅光、藍光處理能夠提高魚腥草抗氧化酶POD、SOD和CAT的活性,而綠光則有抑制作用,本試驗結果表明,不同氧化酶對不同光質的響應不同,其中POD的響應更為敏感,綠光、藍光和紅光誘導了新的基因位點的表達并提高了酶活,不同光質不能誘導SOD和CAT新的基因位點的表達,但可以提高其活性,均為綠光下活性最高,與郝俊江等[28]的研究結果一致。
黃酮類化合物廣泛存在于自然界某些植物和漿果中,是一種很強的抗氧劑,可有效清除體內氧自由基,其阻止氧化的能力是維生素E的10倍以上,這種抗氧化作用可以延緩細胞衰老和退化,并抑制癌癥的發生[29]。同時,黃酮類物質可以改善血液循環,降低膽固醇含量,促進傷口愈合,對膠原蛋白起穩定作用。筆者發現,通過藍、黃LED光照處理可以增加葉片中黃酮的積累,說明適宜的高能量光可以促進魚腥草抗氧化物質的積累,與徐琳煜[30]的研究結果一致。因此,設施栽培中可以根據不同需求設置不同光照條件,以提高天然生物活性物質的含量,從而利于中藥材品質控制及可持續利用。
參考文獻
[1] 李下平.魚腥草研究進展[J].基層中藥雜志,2001(3):45-46.
[2] 吳佩穎,徐蓮英,陶建生.魚腥草的研究進展[J].上海中醫藥雜志,2006(3):62-64.
[3] 辛國鳳.甜椒幼苗光合作用對不同光質的響應及其機制[D].山東泰安:山東農業大學,2019.
[4] 樸春紅,寶音巴特,郭占全,等.抗蒸騰劑對玉米主要葉片光合特性及生理特性的影響[J].分子植物育種,2017,15(10):4289-4293.
[5] MARCUVITZ S,TURKINGTON R.Differential effects of light quality,provided by different grass neighbours,on the growth and morphology of Trifolium repens L.(white clover)[J].Oecologia,2000,125(2):293-300.
[6] 王發南.光質對櫻桃蘿卜生長發育及營養品質的調控機制[D].杭州:浙江大學,2017.
[7] KITAZAKI K,FUKUSHIMA A,NAKABAYASHI R,et al.Metabolic reprogramming in leaf lettuce grown under different light quality and intensity conditions using narrow-band LEDs[J]. Scientific Reports,2018,8(1):7914.
[8] STRYDOM S,MCMAHON K,KENDRICK G,et al.Seagrass Halophila ovalis is affected by light quality across different life history stages[J].Marine Ecology Progress,2017,572:103-116.
[9] 王婷婷,俞少娟,李鑫磊,等.LED光源對植物生理生化及品質影響研究進展[J].北方園藝,2016(2):189-193.
[10] 虞偉.LED光質對香菇生長、抗氧化酶系及有效成分影響研究[D].合肥:安徽農業大學,2018.
[11] 孫一榮,朱教君.水分處理對沙地樟子松幼苗膜脂過氧化作用及保護酶活性影響[J].生態學雜志,2008(5):729-734.
[12] 王嵐,姬可平,胡鋒.希夫試劑顯示DNA染色方法的改進[J].實驗室研究與探索,2004(5):49-50.
[13] COPE K R,SNOWDEN M C,BUGBEE B .Photobiological interactions of blue light and photosynthetic photon flux: effects of monochromatic and broad-spectrum light sources[J].Photochemistry and Photobiology,2014,90(3):574-584.
[14] 肖雯,賈恢先,蒲陸梅.幾種鹽生植物抗鹽生理指標的研究[J].西北植物學報,2000(5):818 -825.
[15] 謝苗苗,孫翊,殷麗青,等.不同LED光質對礬根組培苗生長和生理特性的影響[J].分子植物育種,2018,16(6):2001-2008.
[16] 宋超.水稻種子人工老化過程中抗氧化系統的變化[D].北京:中國農業科學院,2012.
[17] 溫銀元,郭平毅,尹美強,等.撲草凈對遠志幼苗根系活力及氧化脅迫的影響[J].生態學報,2012,32(8):2506-2514.
[18] 蔣海明,戴永強,劉小文,等.魚腥草全草中黃酮的提取和含量測定[J].湖北農業科學,2011,50(5):1032-1034.
[19] 王虹,喻景權.光質對黃瓜幼苗光合效率和白粉病抗性的調控機理[D].杭州:浙江大學,2009.
[20] GILL S S,TUTEJA N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiol Biochem,2010,48(12):909-930.
[21] 宋碧清,禹曉梅,鄭昀曄,等.煙草種子成熟過程抗氧化酶活性變化與種子活力的關系[J].分子植物育種,2018,16(10):3349-3354.
[22] 胡陽,江莎,李潔,等.光強和光質對植物生長發育的影響[J].內蒙古農業大學學報,2009,30(4):296-302.
[23] 盧素萍.不同光質對烤煙成熟衰老的生理生化影響研究[D].鄭州:河南農業大學,2016.
[24] SHAH K,NAHAKPAM S .Heat exposure alters the expression of SOD,POD,APX and CAT isozymes and mitigates low cadmium toxicity in seedlings of sensitive and tolerant rice cultivars[J].Plant Physiology and Biochemistry,2012,57:106-113.
[25] PER T S,KHAN N A,REDDY P S,et al.Approaches in modulating proline metabolism in plants for salt and drought stress tolerance: Phytohormones,mineral nutrients and transgenics[J].Plant Physiology and Biochemistry,2017,115:126-140.
[26] 王莉榮,毛娟,胡琳莉,等.光質對葡萄試管苗生長及生理特性的影響[J].甘肅農業科技,2011(11):15-19.
[27] 張寒,鐘軍,熊興耀.不同光質對魚腥草幼苗生長及生理特性的影響[J].湖南農業科學,2013(5):23-26.
[28] 郝俊江,陳向東,蘭進.光質對靈芝生長及抗氧化酶系統的影響[J].中草藥,2011,42(12): 2529-2534.
[29] 劉子金,楊小波,蘇凡,等.七種藤黃科植物樹皮抗氧化性及游離型總多酚、總黃酮含量的測定[J].分子植物育種,2016,14(12):3536-3543.
[30] 徐琳煜.光質對三葉青生長及黃酮類化合物合成的影響研究[D].杭州:浙江農林大學,2018.

