鎂鋁復合金屬氧化物負載釕納米顆粒催化HMF 選擇性氧化制FDCA
王凌晨, 諶春林, 張 敏
(1. 上海大學理學院,上海 200444;2.中國科學院寧波材料技術與工程研究所,浙江 寧波 315201)
化石資源的快速消耗及其所帶來的環境污染已經成為全球關注的熱點問題,尋找可持續發展的綠色資源是解決資源短缺與環境污染的有效途徑。生物質作為地球儲量最為豐富的可再生資源之一[1],有望成為化石資源的替代品來供應燃料和化學品[2-4],因而受到人們的廣泛關注。由果糖、葡萄糖和纖維素等糖類脫水得到的5-羥甲基糠醛(5-hydroxymethylfurfural,HMF)是重要的生物質基平臺化合物,經選擇性氧化可制備2,5-呋喃二甲醛(2,5-diformylfuran,DFF)、5-羥甲基-2-呋喃甲酸(5-hydroxymethyl-2-furancarboxylic acid,HMFCA)、5-甲酰基-2-呋喃甲酸(5-formyl-2-furancarboxylic acid,FFCA)、2,5-呋喃二甲酸(2,5-furandicarboxylic acid,FDCA)等呋喃類衍生物,這些衍生物可廣泛應用于精細化工、制藥和高分子材料等領域[5]。FDCA 的結構及性質與對苯二甲酸(pure terephthalic acid,PTA)相似,可以替代PTA 生產聚酯類化合物,從而減少對不可再生化石資源的依賴[6].因此,研究HMF 為原料制備FDCA 具有重要的應用價值。
早期研究HMF 氧化制備FDCA 是在堿性溶液體系中進行,均相強堿的大量使用不但腐蝕設備,而且在后期產物分離時需用酸中和過量的游離堿,進而導致潛在的環境污染。為了實現綠色可持續化學的發展目標,非均相固體堿體系的發展受到越來越多研究者的關注。水滑石(hydrotalcite,HT)是近年來被廣泛應用的一類固體堿,其結構為陰離子型層狀雙金屬氫氧化物。最常見的是鎂鋁水滑石,通過高溫焙燒所得的復合金屬氧化物相較于水滑石前驅體具有更多的堿性位點,因此可作為一種良好的固體堿載體[7]。
HMF 氧化制備FDCA,通常使用貴金屬Au、Pd 和Pt 作為催化活性組分[8-11],催化劑成本較高。Ru 是最便宜的鉑族貴金屬,但其在諸多催化反應中均表現出優越的催化性能。有關Ru 催化HMF 氧化制備FDCA 的報道多集中于比較不同載體(HT、MgO 和C 等)負載的Ru 納米顆粒催化劑的反應性能[12-14],而對載體結構與Ru 催化性能的構效關系研究甚少。本工作采用水熱-氫氣還原法制備鎂鋁復合金屬氧化物負載Ru 納米顆粒催化劑,通過多種表征手段對催化劑的結構、形貌和組成等進行分析,考察了催化劑結構(堿性與比表面積)與催化性能之間的關系,并分析了HMF 氧化制備FDCA 的反應路徑。
1 實驗部分
1.1 鎂鋁復合金屬氧化物負載Ru 催化劑
本工作采用水熱-氫氣還原法合成鎂鋁復合金屬氧化物負載Ru 催化劑。將六水合硝酸鎂(Mg(NO3)2·6H2O) 和九水合硝酸鋁(Al(NO3)3·9H2O)直接混合(n為鎂鋁物質的量的比值,1 ≤n≤6),加入100 mL 去離子水溶解,金屬離子總濃度為0.6 mol/L;攪拌加入50 mL 尿素(CO(NH2)2)溶液(濃度為3.96 mol/L),并將混合液轉移至250 mL 的水熱釜中,在100°C下晶化24 h;待降至室溫后,固體產品用去離子水過濾、洗滌,在110°C 下干燥12 h,即可制得固體堿水滑石。
將1 g 固體堿水滑石置于錐形瓶中,抽真空20 min 后加入2.3 mL 88.3 mmol/L RuCl3水溶液,靜置過夜,得到的固體記作RH-n,Ru 的理論負載量(質量分數)為2%;在350°C 管式爐中通入高純氫氣還原3 h 后制得鎂鋁復合金屬氧化物負載Ru 催化劑,并記為RO-n。本工作主要合成了鎂鋁物質的量之比不同的RO-1、RO-3、RO-5 和RO-6 催化劑。
1.2 催化劑表征
采用德國的Bruker D8 Advance 型粉末X 射線衍射儀對催化劑進行結晶程度測定,使用Cu 靶Kα 源,測試電壓40 kV,測試電流40 mA,2θ的測試范圍為10°~80°。催化劑形貌采用日本的HITACHI S-4800 型場發射掃描電子顯微鏡和JEOL-2100 透射電子顯微鏡進行觀察。催化劑織構性質采用氮氣物理吸附儀(Micromeritics ASAP 2020)在液氮溫度下進行分析,獲得的氮氣吸附等溫線通過BET(Brunauer-Emmett-Teller)、BJH(Barrett-Joyner-Halenda) 和t-plot 方法計算出樣品的比表面積、孔徑和孔容等織構參數。樣品中Ru、Mg 和Al 含量通過電感耦合等離子體光譜(ICP-OES, Perkin-Elmer,Optima 2100)獲取。載體堿性通過全自動化學吸附儀(Automatic 2920)進行CO2程序升溫脫附(temperature programmed desorption,TPD)分析測定。
1.3 HMF 催化氧化反應性能評價
稱取126 mg 5-羥甲基糠醛和80 mg 催化劑置入100 mL 高壓反應釜中,加入15 mL 去離子水,密封后用高純氧氣置換3 次,再向釜內充入2 MPa 的O2,20 min 加熱至120°C 后開始以600 轉/min 的速度攪拌;反應5 h 后取樣,再經去離子水稀釋后用高效液相色譜分析反應物和產物的濃度,進而計算HMF 的轉化率和FDCA 的產率。色譜條件為:色譜柱型號為Zorbax SB-C18,流動相(體積比)為5%的CF3COOH/CH3OH 溶液,紫外檢測器的檢測波長為278 nm,柱溫為30°C。
2 結果與討論
2.1 催化劑表征結果
采用X 射線衍射(X-ray diffraction,XRD)分析制備的催化劑及其前驅體的結構,結果如圖1 所示。圖1(a)顯示RH-n均具有HT 的特征峰,2θ=11.6°、23.4°、35.4°、39.3°、46.8°、60.6°、61.9°處的特征峰分別對應六方晶型水滑石結構的(003)、(006)、(009)、(015)、(018)、(110)、(113)晶面(PDF 卡片70-2151)[15]。當載體鎂鋁物質的量之比n(Mg):n(Al)=6:1 時,前驅體中出現明顯的Mg5(CO3)4(OH)2·4H2O 相,表明過量的Mg無法摻入水滑石骨架中。前驅體經過焙燒和氫氣還原后,水滑石特征結構不再存在,催化劑主要為方鎂石MgO 相,沒有Al2O3晶相(見圖1(b)),這說明Al2O3以非晶相或者無定型形式存在于載體結構中[16]。焙燒還原后也未出現金屬Ru 或其氧化物的特征峰,這說明負載的Ru 未發生燒結聚集。圖1 顯示,隨著鎂鋁物質的量之比增加,XRD 衍射峰強度增強,峰型更加尖銳,說明產物結晶度得到提升。
對RO-n催化劑進行ICP-OES 分析,結果見表1。可以發現:Ru 的實際負載量與理論值相符,質量分數為(1.97±0.17)%;4 個催化劑的鎂鋁物質的量的比值分別為0.57(RO-1)、1.54(RO-3)、2.76(RO-5)和1.64(RO-6)。RO-5 實際鎂鋁物質的量之比大于RO-6,這可能是由于少量Mg2+形成HT 和Mg5(CO3)4(OH)2·4H2O 雜相,而大量的Mg2+仍殘留在反應混合液中。氮氣物理吸附測試表明,催化劑的比表面積隨著鎂鋁比的增加呈現先增加后降低的趨勢,其中RO-3 具有最大的比表面積(127.6 m2·g-1),RO-5 次之(97.0 m2·g-1),而RO-6 的比表面積大幅降低(22.0 m2·g-1)。CO2-TPD 的測試結果表明,所有樣品均具有一定的堿性,堿性位可能是位于載體表面的OH-官能團和Mg—O 鍵[9]。RO-5 的堿含量達到142.81 mmol·g-1,遠高于其他樣品。
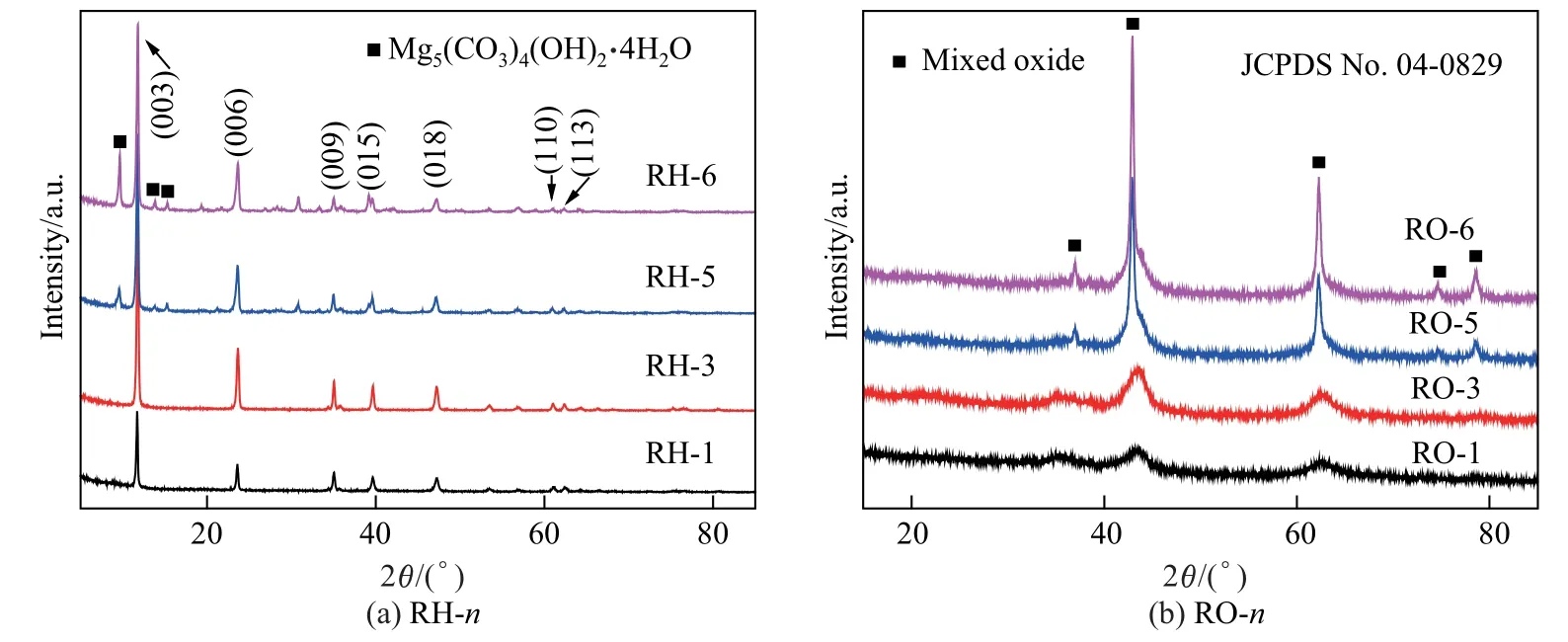
圖1 RH-n 和RO-n 催化劑的XRD 譜圖Fig.1 XRD patterns of RH-n and RO-n catalysts
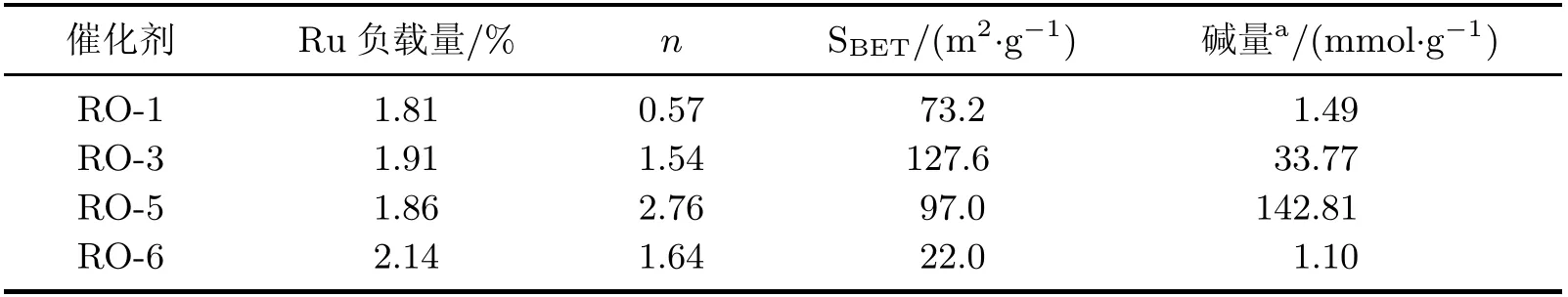
表1 催化劑RO-n 的物理化學性質Table 1 Physicochemical properties of RO-n catalysts
圖2 為RO-n催化劑的掃描電鏡(scanning electron microscope, SEM)圖. 可以看出:經過焙燒還原后,鎂鋁復合金屬氧化物負載Ru 催化劑仍然保持著較好的六方晶型結構;RO-3和RO-5 的結構完整性明顯優于RO-1 和RO-6,片層結構的直徑范圍為1.0~2.0 μm;RO-6 的片層結構表面出現大量的小顆粒,這可能是Mg5(CO3)4(OH)2·4H2O 雜相分解后產生的細小碎片[17]。
圖3 為RO-n催化劑的透射電鏡(transmission electron microscope, TEM)表征。可以看出:催化劑載體具有明顯的晶格條紋,表明其結晶度良好,尤其是RO-5 最為清晰;Ru 納米顆粒呈圓球形,且隨著鎂鋁物質的量之比的增大,Ru 顆粒逐漸增大,4 個催化劑的Ru 納米顆粒平均尺寸分別為1.3、1.7、2.0、2.8 nm(粒徑大小及分布見柱狀圖);Ru 顆粒在載體表面分布均勻,沒有明顯團聚現象,其中RO-6 中Ru 顆粒密度較大,個別顆粒的投影有重疊,這與催化劑比表面積較小有關。通過操作電子束聚焦不同高度,發現催化劑載體主要為暴露(200)和(111)晶面的MgO 相,沒有出現氧化鋁的晶格條紋,這與XRD 分析結果一致。此外,Ru納米顆粒主要暴露(101)晶面。

圖2 RO-n催化劑的SEM 圖Fig.2 SEM images of RO-n catalysts

圖3 RO-n 催化劑的TEM 和Ru 尺寸分布圖Fig.3 TEM images and Ru size distributions of RO-n catalysts
2.2 HMF 選擇性氧化反應
本工作將制備的Ru 催化劑用于無外加堿條件下的HMF 催化氧化制備FDCA 反應,系統地研究了載體鎂鋁物質的量之比、反應時間、氧氣壓力、反應溫度和Ru 負載量等因素對催化性能的影響,結果如圖4 所示。
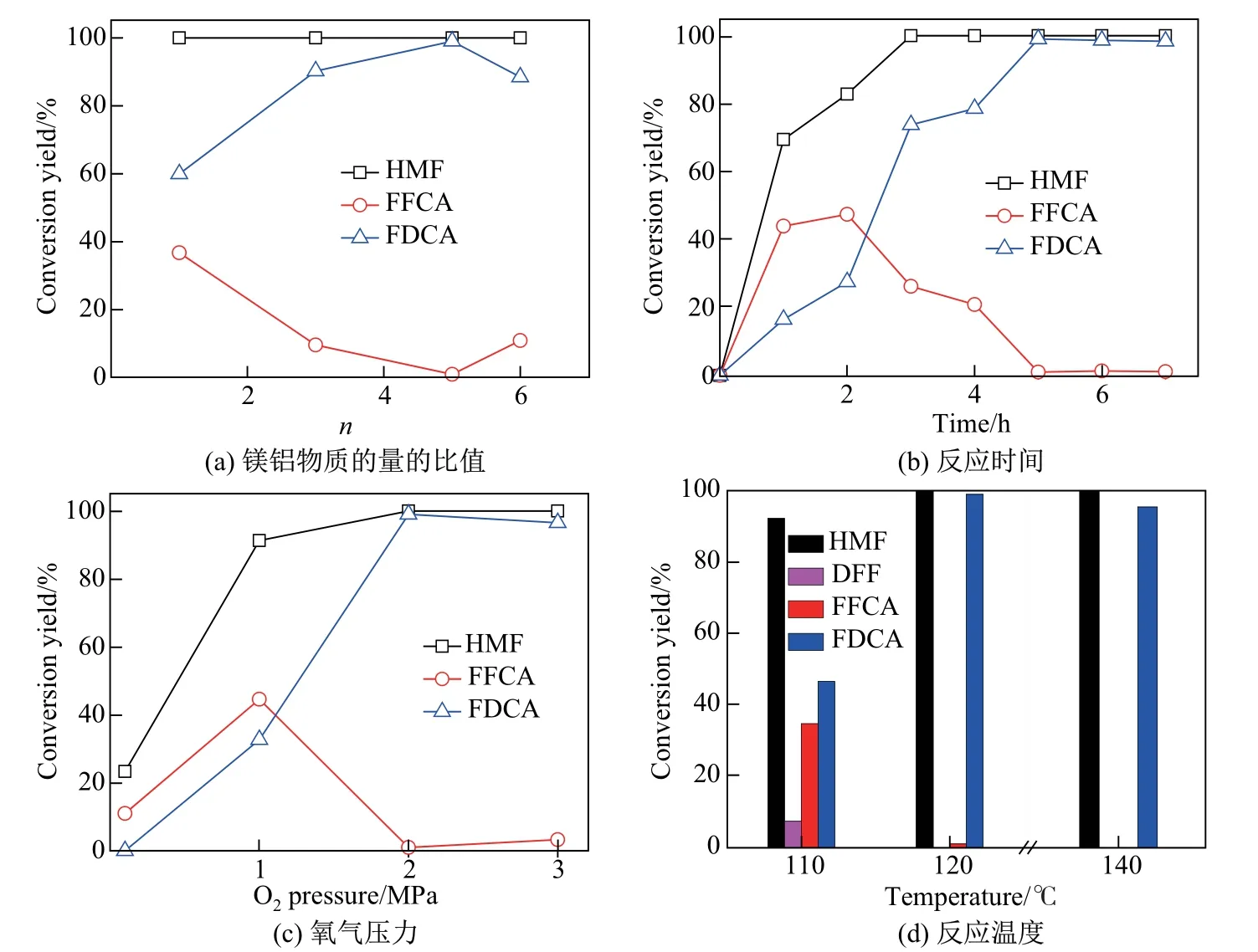
圖4 催化性能的影響因素Fig.4 Impact factors of the catalytic activity
首先,在120°C 下反應5 h,發現4 個催化劑上的HMF 均已完全轉化,目標產物FDCA的產率隨催化劑載體鎂鋁物質的量之比的增加先上升后下降,檢測到的副產物為FFCA,且其在產物中的比例隨催化劑載體鎂鋁物質的量之比的增加先下降后上升(見圖4(a))。當載體n(Mg):n(Al)=5:1 時,催化劑的活性最高,HMF 轉化率和FDCA 產率分別可以達到100.0%和99.0%。繼續增大載體鎂鋁物質的量之比到6 時,HMF 的轉化率為100.0%,但FDCA 的產率下降至88.5%,FFCA 的產率從1.0%上升至10.9%。由表1 可知,鎂鋁物質的量之比的改變會引起鎂鋁復合金屬氧化物比表面積和堿量的變化,較大的催化劑比表面積有助于提高催化反應的接觸面積與傳質速度。RO-3 催化劑的比表面積最大,催化反應性能卻不是最佳的,因此比表面積不是該系列催化劑性能差異的主要原因。RO-5 的堿性最強,表面的OH-有利于HMF 羥甲基的C—H 鍵活化而形成醛基中間體[18]。而RO-6 催化劑堿量偏低,因此FDCA產率有所下降。由此可以看出,催化劑的活性隨載體的堿性增強而增強。
催化反應的轉化率、產率隨時間的變化見圖4(b)。在120°C、2 MPa O2條件下,采用RO-5 催化劑時HMF 轉化率在1 h 達到69.5%,3 h 達到100.0%,但對應時間點上FDCA 的產率僅為16.5%和73.8%。反應體系生成了較多的FFCA,反應1 h 為44.0%,反應2 h達到峰值47.5%,此后逐步降低。反應5 h,FDCA 產率達到99.0%,而FFCA 產率僅為1.0%,這充分證明了FFCA 是HMF 催化氧化生成FDCA 過程中的中間產物。
為了研究氧氣壓力對催化氧化反應的影響,將反應釜體系O2壓力在0.1~3.0 MPa 范圍內進行調節,結果如圖4(c)所示。當氧氣壓力較低(0.1~2.0 MPa)時,HMF 氧化反應進行不完全,體系中存有大量FFCA,尤其是在1.0 MPa O2氛圍中反應5 h 后,FFCA 產率最高達到44.7%,并且HMF 轉化率和FDCA 產率隨氧氣壓力增大而增加。當氧氣壓力為2 MPa時,FDCA 產率最大,進一步加壓至3.0 MPa 后,FDCA 產率有略微下降,這可能是由于壓力過大而導致開環、聚合等副反應的發生。
通常情況下,反應溫度對催化反應具有非常明顯的調制作用。110、120 和140°C 條件下的催化反應活性(反應時間5 h)如圖4(d)所示。可以看出,在較低溫度(110°C)下,HMF未能完全轉化,產物中除了FDCA 還出現了DFF 和FFCA。因此,結合文獻報道的HMF催化氧化反應網絡,可以推斷出用Ru 納米顆粒催化HMF 氧化的反應路徑,即HMF 的羥基優先被氧化成醛基而生成DFF,然后DFF 的醛基氧化成羧基生成FFCA,FFCA 的醛基繼續氧化生成FDCA(見圖5)。當反應溫度達到120°C 時,反應5 h 后HMF 完全轉化,FDCA 的選擇性大于99.0%,此時反應體系中已檢測不到中間產物DFF,且FFCA 產率僅為1.0%。當溫度繼續升高至140°C,HMF 完全轉化,但FDCA 產率下降至95.5%,可能是HMF 在高溫下分解成小分子乙酰丙酸(levulinic acid, LA)和甲酸(formic acid, FA)[19]。
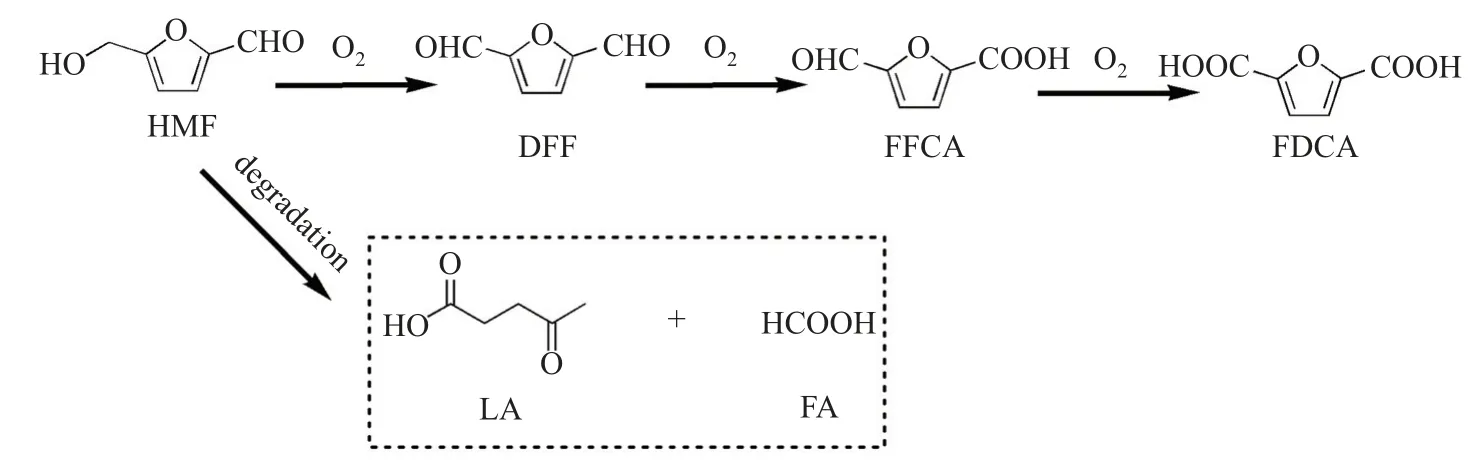
圖5 RO-n 催化劑上HMF 氧化制備FDCA 的反應路徑Fig.5 Reaction pathway for the oxidation of HMF to FDCA over RO-n catalysts
此外,考慮到降低貴金屬Ru 的用量以減少催化劑的成本,考察Ru 負載量(質量分數分別為0.5 %和1.0 %)不同的催化劑的反應性能,結果如表2 所示。這兩種催化劑在120°C、2 MPa O2條件下反應5 h后,HMF 轉化率僅為58.6%和67.0%,中間產物FFCA收率卻高達24.6%和14.1%,目標產物FDCA 的收率僅為20.6%和24.3%。如需反應進行完全,則需要較大幅度地延長反應時間。因此,如將Ru 負載型催化劑推向工業化應用,適當提高貴金屬的負載量能夠取得反應操作周期和反應成本的平衡,從而實現經濟利益最大化。

表2 Ru 負載量對催化性能的影響Table 2 Effect of Ru loading on the catalytic activity %
RO-5 催化劑的循環穩定性在120°C、2 MPa O2的條件下進行測試,反應5 h 后,將催化劑進行簡單的過濾、洗滌、干燥后直接投入第二次催化反應,結果如圖6 所示。由圖6 可以看出,循環使用2 次后,RO-5 催化劑活性明顯下降。由TEM(見圖7)和CO2-TPD 表征的結果可知,使用后的催化劑中部分Ru 納米顆粒發生團聚[20],且載體堿性顯著下降(堿量為99.68 mmol·g-1)[21]。因此,循環使用后催化劑的堿性Ru 的粒徑和發生變化,導致催化性能下降。

圖6 RO-5 催化劑循環穩定性測試Fig.6 Recycling test of RO-5 catalyst
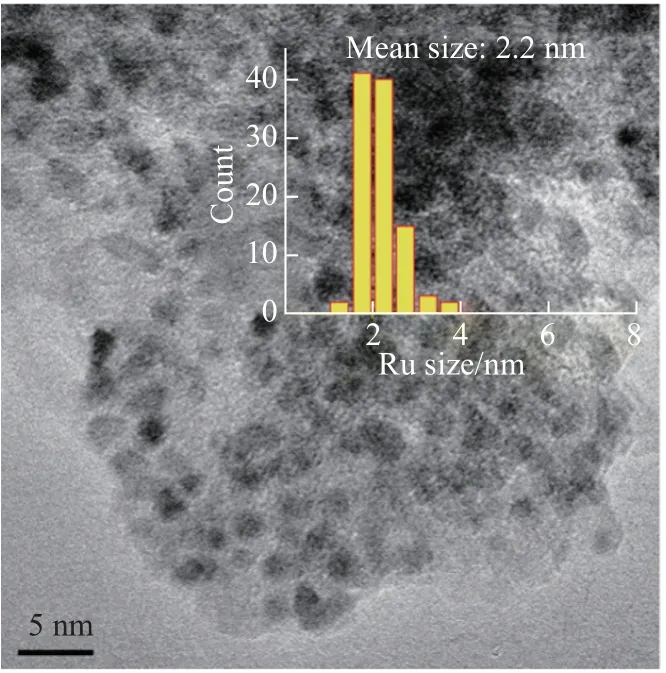
圖7 使用后的RO-5 的TEM 和Ru 尺寸分布Fig.7 TEM image and Ru size distribution of used RO-5 catalyst
3 結 論
(1)采用簡單的水熱-氫氣還原法制備了鎂鋁復合金屬氧化物負載Ru 納米顆粒催化劑,催化劑載體為方鎂石MgO 相和無定型Al2O3組成的六邊形片狀結構,Ru 實際負載量為(1.97±0.17)%。Ru 納米顆粒在載體表面分散均勻,平均粒徑隨載體鎂鋁物質的量之比增大而增大,主要暴露晶面為(101)晶面。
(2)在120°C、2 MPa O2、無外加堿的反應條件下,以水為溶劑,RO-5 催化劑在HMF氧化反應中的催化性能最佳,反應5 h 獲得100.0%的HMF 轉化率和99.0%以上的FDCA 產率,這是由于RO-5 催化劑具有最強的堿性和較大的比表面積,催化劑載體同時起到固體堿的作用。
(3)在RO-n催化劑上,HMF 氧化生成FDCA 的反應路徑如下:HMF 羥基氧化生成DFF,DFF 醛基氧化成羧基生成FFCA,最后得到二酸FDCA。

