雞白細胞介素2和白細胞介素18基因的原核及真核表達
張艷雯,張鶴曦,覃 靜,周晴云,唐子瓊
(1.南寧學院,廣西 南寧 530200;2.欽州市畜牧站,廣西 欽州 535099)
【研究意義】白細胞介素2(IL-2)是一種由激活T淋巴細胞產生的生長因子,也是CD4+和CD8+效應T細胞增殖和分化的關鍵因子[1-3],可通過誘導細胞毒性T細胞、淋巴因子激活的殺傷細胞及自然殺傷細胞促進T細胞產生的相關細胞因子表達,特異性增強細胞免疫反應[4]。白細胞介素18(IL-18)是由激活的單核細胞、樹突狀細胞和巨噬細胞產生的一種多功能細胞因子[5],具有誘導NK細胞或絲裂原激活T細胞產生IFN-γ的能力,同時提高NK細胞和T細胞殺傷活性[6-7],在提高機體抗感染能力和識別、清除異化自體組織等方面發揮重要作用[8]。IL-2或IL-18在人體及其他動物上具有廣泛的生物學活性和應用價值[9-11],通過原核和真核表達載體制備獲得的DNA疫苗可明顯增強疫苗的免疫原性[12-14]。雞白細胞介素2(ChIL-2)和雞白細胞介素18(ChIL-18)蛋白具有重要的生物學功能,但二者的表達量因試驗方法及條件的不同存在明顯差異。因此,加強ChIL-2和ChIL-18研究對其蛋白功能、生物學活性及聯合應用免疫佐劑的研發具有重要意義。【前人研究進展】Sundick等[15]用ConA刺激活化的雞脾臟細胞,通過轉染COS-7細胞,首次克隆獲得ChIL-2基因,并篩選出T細胞增殖活性。KaiserI等[16]采用RACE克隆獲得ChIL-2全序列,并對其進行基因組結構分析和染色體定位,結果發現其外顯子和內含子結構與哺乳動物極相似,且存在其他潛在的轉錄因子結合位點。張春杰等[17]從雞新城疫Ⅰ系疫苗誘導的雞胚脾淋巴細胞中擴增獲得ChIL-2全長cDNA序列,將ChIL-2基因克隆到原核表達載體上,獲得重組質粒,重組質粒在大腸桿菌中的誘導表達產物經SDS-PAGE電泳分析,結果表明所克隆的ChIL-2基因在大腸桿菌中得到良好表達。郭川等[18]從雞脾臟細胞中擴增出ChIL-2編碼基因,將該編碼基因克隆至原核表達載體并構建了ChIL-2基因的重組原核表達質粒,重組質粒轉化大腸桿菌JM109后經誘導表達,分別得到兩種表達產物,經過純化復性后,表達產物具有明顯促進雞脾淋巴細胞增殖的作用。Schneider等[19]首次從脂多糖(LPS)刺激的雞巨噬細胞系HD-11中擴增并克隆獲得ChIL-18基因。Kaiser等[20]報道顯示,火雞與雞的IL-18基因的編碼區高度保守,具有很高的同源性,系統進化樹分析表明二者的IL-18在生物學活性上有交叉反應。胡敬東等[21]從LPS刺激10 h活化的MDCC-MSB1細胞中克隆獲得ChIL-18成熟活性蛋白的完整基因片段,完成了原核和真核表達。李宏梅等[22]研究發現,利用原核表達的重組雞rChIL-18蛋白具有提高NK細胞和CTL殺傷活性作用。【本研究切入點】隨著分子生物學、免疫學理論和技術的發展,ChIL-2和ChIL-18基因與功能已成為研究的熱點,但針對ChIL-2和ChIL-18蛋白表達的研究鮮見報道。【擬解決的關鍵問題】根據GenBank中ChIL-2和ChIL-18基因序列設計并合成特異性引物,采用RT-PCR擴增ChIL-2和ChIL-18基因,并克隆到pET32a原核載體和pVAX1真核載體上,分別構建原核表達載體pET32a-ChIL-2和pET28a-ChIL-18及真核表達載體pVAX1-ChIL-2和pVAX1-ChIL-18,分別以Western blotting檢測確定該蛋白表達量及間接熒光檢測ChIL-2和ChIL-18蛋白在細胞中的表達量,為后續ChIL-2和ChIL-18蛋白功能、生物學活性及聯合應用免疫佐劑的研發提供參考依據。
1 材料與方法
1.1 試驗材料
1.1.1 菌種和克隆載體 大腸桿菌BL21感受態細胞、大腸桿菌DH10B感受態細胞、pET32a原核表達載體、pET28a原核表達載體、pVAX1真核表達載體和pMD19-T 載體購自大連寶生物工程TaKaRa公司。
1.1.2 主要儀器設備 小型臺式離心機、低溫高速離心機、移液槍、天平、pH計、電熱恒溫培養箱、磁力攪拌器、高壓滅菌鍋、脫色搖床、多用途旋轉搖床、制冰機、核酸電泳儀、電泳槽、蛋白電泳儀、PCR儀、水浴鍋、超聲波細胞破碎機和凝膠成像系統。
1.1.3 工具酶和試劑 OMEGA質粒小提試劑盒、OMEGA質粒大提試劑盒、DNA膠回收試劑盒、常規限制性內切酶(KpnⅠ、SalⅠ、BamHⅠ、EcoRⅠ、PstⅠ、MluⅠ和XbaⅠ)、PCR用DNA聚合酶(Taq酶)、蛋白Marker、dATP(R0141)、T4DNA連接酶、DNA Marker、dNTPs、酵母提取物、NaCl、胰蛋白胨、磷酸鹽緩沖液、甘氨酸、Tris堿、甲醇、刀豆蛋白A和四甲基偶氮唑鹽。
1.2 試驗方法
1.2.1 引物合成 根據GenBank已公布的ChIL-2(GU119890.1)和ChIL-18(NM_204608.1)基因序列,應用Primer 7.0設計擴增ChIL-2和ChIL-18基因的特異性引物(表1),引物委托生工生物工程(上海)有限公司合成。
1.2.2 無特定病原(SPF)雞脾淋巴細胞分離培養及總RNA提取 30日齡SPF雛雞購自九江博美萊生物制品有限公司。在無菌條件下,取雞脾臟后制成單細胞懸液,400 r/min離心15 min,將離心沉淀的細胞懸浮于含10 %胎牛血清的RPMI1640培養液中,取一支新的離心管,先加入4 mL淋巴細胞分離液,再加入等體積的淋巴細胞懸液,用密度梯度離心法,400 r/min離心15 min,分離淋巴細胞;再用RPMI1640培養液在350 r/min離心條件下離心洗滌淋巴細胞2次后,用臺盼藍染色法進行活細胞計數,將細胞濃度調整至1×107個/mL,并加至6孔細胞培養板中,每孔加2 mL,置于40 ℃、5 % CO2細胞培養箱中培養。分別于培養的第6和20 h收集培養細胞,于4 ℃下400 r/min條件下離心15 min,用1 mL RPMI1640培養液重新懸浮細胞,用TRIzol試劑提取淋巴細胞總RNA,用1 %瓊脂糖凝膠電泳檢測總RNA完整性。提取的淋巴細胞總RNA置于-80 ℃冰箱保存備用。

表1 擴增ChIL-2和ChIL-18基因的特異性引物
1.2.3 ChIL-2和ChIL-18基因克隆與鑒定 用AMV反轉錄酶和Oligo(dT)15引物將總RNA反轉錄合成cDNA,再以cDNA為模板,采用表1中引物分別進行PCR擴增,擴增程序:98 ℃預變性30 s;98 ℃ 10 s,55 ℃ 30 s,72 ℃ 30 s ,進行33個循環;72 ℃延伸10 min。反應結束后用1 %瓊脂糖凝膠電泳對PCR擴增產物進行檢測,參考DNA膠回收試劑盒說明回收PCR產物,分別獲得ChIL-2 和ChIL-18基因片段。將回收的ChIL-2和ChIL-18基因片段分別克隆到pMD19-T載體,并轉化DH10B感受態細胞。參考OMEGA質粒提取試劑盒說明分別小量提取重組質粒pMD19-T-ChIL-2和pMD19-T-ChIL-18后,選擇合適的酶切位點進行酶切鑒定和測序。
1.2.4 ChIL-2和ChIL-18基因原核表達 以重組質粒pMD19-T-ChIL-2和pMD19-T-ChIL-18為模板,用表2中引物分別進行PCR擴增,PCR產物進行膠回收,獲得純化的ChIL-2和ChIL-18基因片段。用BamH I和SalⅠ分別雙酶切pET32a和pET28a載體。在22 ℃水浴條件下,用T4 DNA連接酶將ChIL-2基因片段與載體pET32a、ChIL-18基因片段與載體pET28a進行連接反應4 h,并轉化DH10B感受態細胞。將感受態細胞涂布于含100 μg/mL氨芐青霉素的LB培養基上,置于37 ℃培養箱中過夜培養。挑選單個菌落,接種至2 mL LB液體培養液中,置于37 ℃氣浴搖床中振蕩培養。參考OMEGA質粒提取試劑盒說明對菌液進行質粒小量提取,得到陽性重組原核表達質粒pET32a-ChIL-2和pET28a-ChIL-18,分別用PCR和雙酶切鑒定并測序。將重組原核表達質粒pET32a-ChIL-2和pET28a-ChIL-18轉化至BL21中感受態細胞,涂板后37 ℃過夜。次日挑取單個菌落接種至LB液體培養基中,待菌液濃度A600=1.5時,加入IPTG至終濃度0.1 mmol/L,20 ℃誘導培養過夜。取部分菌液進行SDS-PAGE分析和Western blotting鑒定。
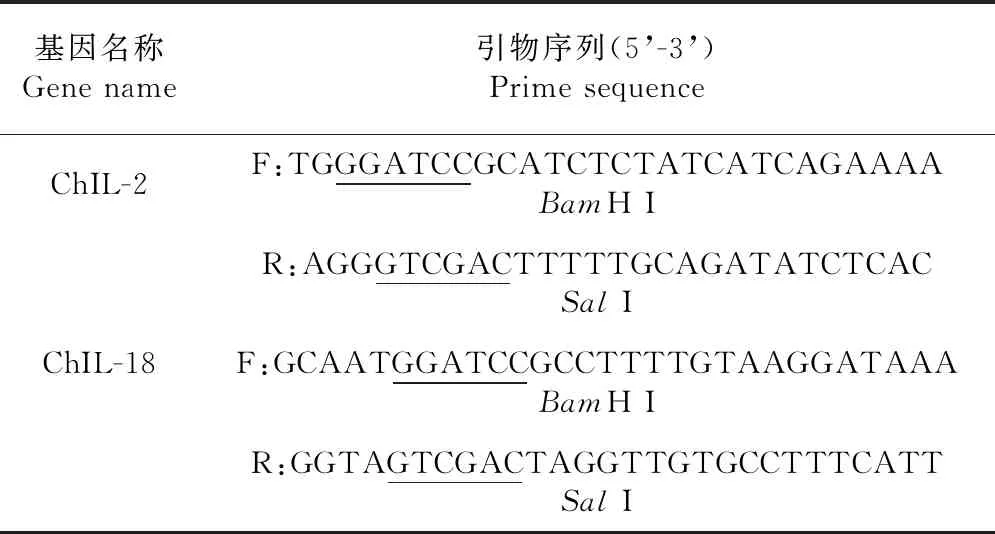
表2 構建重組原核表達質粒pET32a-ChIL-2和pET28a-ChIL-18的引物
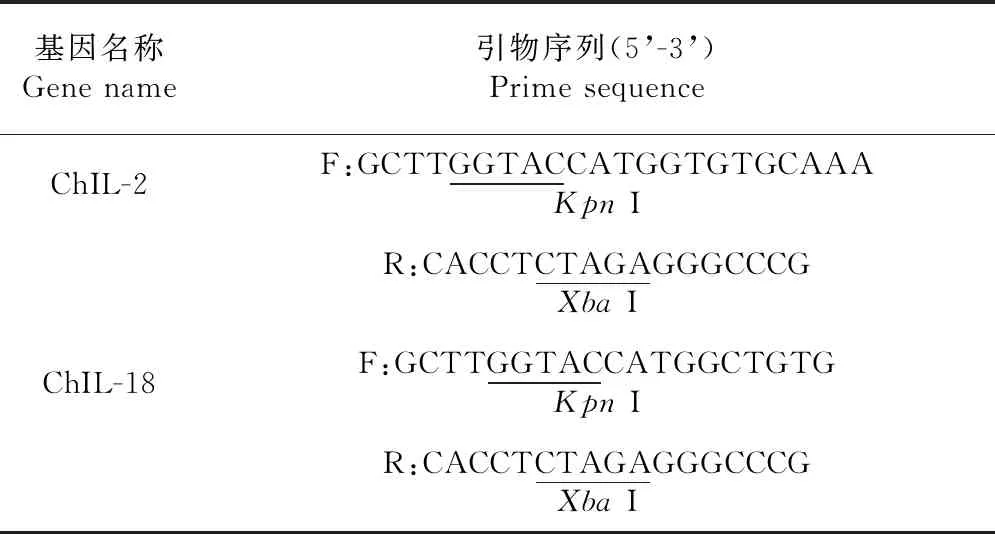
表3 構建重組真核表達質粒pVAX1-ChIL-2和pVAX1-ChIL-18的引物
1.2.5 ChIL-2和ChIL-18基因真核表達 以重組質粒pMD19-T-ChIL-2和pMD19-T-ChIL-18為模板,用表3中的引物進行PCR擴增,將PCR擴增產物進行膠回收,獲得純化的ChIL-2和ChIL-18基因片段。用KpnI和XbaI雙酶切pVAX1載體,在22 ℃水浴條件下,用T4DNA連接酶將ChIL-2和ChIL-18基因片段與pVAX1載體進行連接反應,并轉化DH10B感受態細胞,將感受態細胞涂板后37 ℃過夜培養。參照OMEGA質粒小提試劑盒說明少量提取質粒,分別獲得重組真核表達質粒pVAX1-ChIL-2和pVAX1-ChIL-18。將重組真核表達質粒分別進行PCR、酶切鑒定和測序。將重組真核表達質粒分別轉染非洲綠猴腎(Vero)細胞,24 h后用倒置熒光顯微鏡觀察其蛋白表達情況。
2 結果與分析
2.1 ChIL-2和ChIL-18基因克隆結果
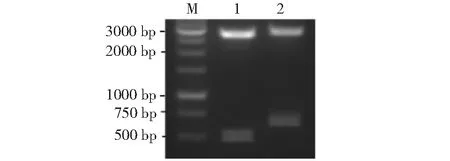
2.1.1 ChIL-2和ChIL-18基因PCR擴增結果 從圖1的1和2泳道可見1條清晰特異性條帶,其中,1泳道的條帶約在400 bp處,2泳道的條帶約在600bp處,與預測的目的基因片段大小相符。

M:DNA Marker;1:ChIL-2;2:ChIL-18
2.1.2 重組質粒pMD19-T-ChIL-2和pMD19-T-ChIL-18酶切鑒定結果 對構建的重組質粒pMD19-T-ChIL-2和pMD19-T-ChIL-18經BamH I和SalI雙酶切,結果顯示,1和2泳道的目的條帶大小與預測結果相符(圖2)。
2.1.3 ChIL-2和ChIL-18基因的測序 測序結果顯示,ChIL-2和ChIL-18基因片段全長分別為429和593 bp,采用DNASTAR對其核苷酸序列及推導氨基酸序列進行比對分析,結果發現ChIL-2基因片段編碼143個氨基酸,ChIL-18基因片段編碼218個氨基酸殘基。與NCBI數據庫中公布的雞IL-2(Sequence ID:AAC96064.1)和IL-18(Sequence ID:NP_989939.1)序列進行比對,其相似性分別為99.7 %和100.0 %(圖3~4)。
M:DNA Marker;1:重組質粒pMD19-T-ChIL-2;2:重組質粒pMD19-T-ChIL-18
2.2 ChIL-2和ChIL-18蛋白的原核表達情況
2.2.1 重組原核表達質粒pET32a-ChIL-2和pET28a-ChIL-18鑒定結果 選擇PstI對構建的重組原核表達質粒pET32a-ChIL-2進行酶切,選擇MluI和SalI對構建的重組原核表達質粒pET28a-ChIL-18進行酶切。從圖5可看出,酶切獲得的目的條帶大小與預期結果相符;測序結果也表明,構建的重組原核表達質粒正確,無基因突變,即已成功構建獲得重組原核表達質粒pET32a-ChIL-2和pET28a-ChIL-18。

1:ChIL-2基因編碼區核苷酸序列;2:ChIL-2基因編碼區核苷酸推導氨基酸序列;3:NCBI數據庫中雞IL-2基因推導氨基酸序列

1:ChIL-18基因編碼區核苷酸序列;2:ChIL-18基因編碼區核苷酸推導氨基酸序列;3:NCBI數據庫中雞IL-18基因推導氨基酸序列
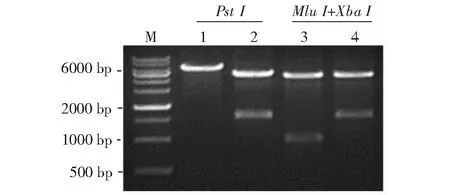
M:DNA Marker;1:pET32a載體;2:重組原核表達質粒pET32a-ChIL-2;3:重組原核表達質粒pET28a;4:重組原核表達質粒pET28a-ChIL-18
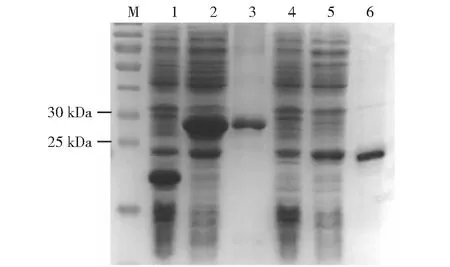
M:蛋白質分子量標準;1:pET32a載體;2:未純化的重組原核表達質粒pET32a-ChIL-2;3:純化的重組原核表達質粒pET32a-ChIL-2;4:pET28a載體;5:未純化的重組原核表達質粒pET28a-ChIL-18;6:純化的重組原核表達質粒pET28a-ChIL-18
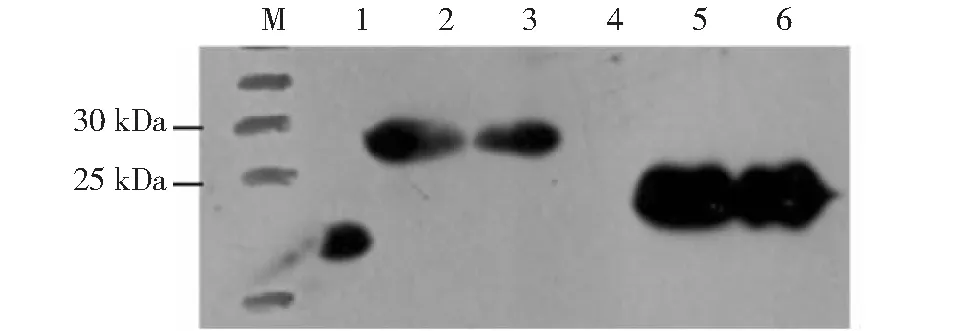
M:蛋白質分子量標準;1:pET32a載體;2:未純化的重組原核表達質粒pET32a-ChIL-2;3:純化的重組原核表達質粒pET32a-ChIL-2;4:pET28a載體;5:未純化的重組原核表達質粒pET28a-ChIL-18;6:純化的重組原核表達質粒pET28a-ChIL-18
2.2.2 融合蛋白ChIL-2和ChIL-18的誘導表達情況 SDS-PAGE分析結果顯示,經IPTG誘導、菌體培養和純化后的重組原核表達質粒pET32a-ChIL-2和pET28a-ChIL-18菌體蛋白在27 kD(3泳道)和23 kD(6泳道)處可見1條特異性條帶,而空載質粒(1和4泳道)經誘導后未表達任何蛋白,說明誘導的原核菌體成功表達了融合蛋白ChIL-2和ChIL-18(圖6)。Western blotting檢測結果也顯示,在27 kD(3泳道)和23 kD(6泳道)處可見特異性條帶,說明原核表達產物即為預期的ChIL-2和ChIL-18(圖7)。
2.3 ChIL-2和ChIL-18基因的真核表達情況
2.3.1 重組真核表達質粒 pVAX1-ChIL-2和pVAX1-ChIL-18鑒定結果 對構建的重組真核表達質粒pVAX1-ChIL-2和pVAX1-ChIL-18采用KpnI和XbaI進行雙酶切,結果目的條帶大小與預期結果相符(圖8),對應的測序結果序列也正確。說明已成功構建獲得重組真核表達質粒pVAX1-ChIL-2和pVAX1-ChIL-18。
2.3.2 融合蛋白ChIL-2和pVAX1-ChIL-18在Vero細胞內的表達情況 將所構建的重組真核表達質粒pVAX1-cCHIL-2與pVAX1-cCHIL-18分別轉染至Vero細胞中,24 h后取其中3皿(加空白對照)用倒置熒光顯微鏡檢測,結果(圖9)顯示,與空白對照(圖7-C)比較,圖7-A和圖7-B中均可見熒光,說明融合蛋白ChIL-2和ChIL-18在Vero細胞中均有表達。

M:DNA Marker;1:pVAX1載體;2:重組真核表達質粒pVAX1- ChIL-2;3:重組真核表達質粒pVAX1-ChIL-18
3 討 論
本研究從雞脾淋巴細胞中擴增的ChIL-2和ChIL-18基因片段全長分別為429和593 bp,其中,ChIL-2基因片段編碼143個氨基酸殘基,ChIL-18基因片段編碼218個氨基酸殘基;氨基酸序列比對分析結果表明,擴增的ChIL-2基因序列與Sundick公布的雞IL-2基因序列相似性達98.83 %[15],ChIL-18基因序列與GenBank中公布的雞IL-18基因序列(GenBank:GEU334505.1)相似性為99.83 %,與五彩金剛鸚鵡(Aramacao)(GenBank:GU140075.1)的相似性為99.66 %。可見,本研究已成功擴增到ChIL-2和ChIL-18基因序列。
本研究將構建的重組原核表達質粒pET32a-ChIL-2和pET28a-ChIL-18分別轉化大腸桿菌BL21感受態細胞,通過IPTG低溫過夜誘導,融合蛋白ChIL-2和ChIL-18的表達量明顯增高,表明采用pET32a和pET28a表達系統可高效表達ChIL-2和ChIL-18蛋白。Stepaniak等[23]采用pET32a表達系統高效表達了雞IL-2蛋白量,高于采用大腸桿菌Pgex-2系統的表達量,且以可溶性蛋白的形式為主,易回收和純化。Zhou等[24]研究發現,鴨白細胞介素2(DuIL-2)和ChIL-2會與其單克隆抗體起免疫交叉反應,且DuIL-2能促進雞和鴨兩類脾臟淋巴細胞增殖。原核表達蛋白需要提純,其生物活性也受影響,但已有研究表明,在大腸桿菌中表達的雞IL-2具有刺激T淋巴細胞增殖的生物學活性;重組的雞IL-2蛋白可在24 h內引起外周血CD4+和CD8+細胞比例增加[25]。
本研究還成功構建了重組真核表達質粒pVAX1-ChIL-2和pVAX1-ChIL-18,將二者轉染Vero細胞,24 h后熒光檢測發現融合蛋白ChIL-2和ChIL-18均獲得表達,不僅可為后續將重組真核表達質粒直接用于體內獲得表達,還可與疫苗共注射以提高疫苗的免疫原性。由振強等[26]構建了雞IL-2真核表達質粒pCI-ChIL-2-EGFP,并與H5亞型禽流感油乳劑滅活苗(AIV)共同注射雞體內,結果發現,pCI-ChIL-2-EGFP可明顯提高AIV的免疫原性。邵攀峰等[27]將ChIL-18基因克隆至真核表達載體pcDNA3.1(+)中,構建重組真核表達質粒pcDNA3.1/ChIL-18(pIL-18),并用pIL-18和ILTV弱毒疫苗及其二者聯合分別免疫21日齡SPF雛雞,結果發現pIL-18與ILTV弱毒疫苗聯合免疫組的淋巴細胞亞群CD3+、CD3+CD4+和CD3+CD8+明顯高于ILTV弱毒疫苗免疫組,ILTV強毒攻毒后發病雞數量少,且發病癥狀較輕。

A:融合蛋白ChIL-2;B:融合蛋白ChIL-18;3:空白對照
4 結 論
成功構建的ChIL-2和ChIL-18基因重組原核表達質粒pET32a-ChIL-2和pET32a-ChIL-18及重組真核表達質粒pVAX1-ChIL-2和pVAX1-ChIL-18,分別在大腸桿菌和Vero細胞中獲得高表達,即克隆獲得的IL-2和IL-18基因可在原核和真核細胞中高效表達,為后續研究IL-2和IL-18蛋白的融合表達、生物學活性及疫苗的免疫作用打下了基礎。

