骨髓間充質干細胞培養液促進STAT3磷酸化誘導Raw264.7細胞向M2型極化
李志偉,周號悅,劉湘粵,何 漪,丁小鳳,胡靈玉
(1.湖南師范大學蛋白質化學與發育生物學教育部重點實驗室, 長沙 410081;2.湖南省南華生物醫藥研究所, 長沙 410015; 3.中南大學湘雅三醫院, 長沙 410013)
炎癥是免疫細胞對病原微生物發生的免疫反應,也是人體對外源性入侵的微生物的一種防御反應。炎癥是機體產生免疫反應的一種表現,但炎癥對機體的健康會造成傷害。巨噬細胞在炎癥發生的過程中,扮演著重要的作用,它是免疫的第二道防線,能夠吞噬、殺傷和清除外源性病原微生物。據報道巨噬細胞具有消退炎癥、修復組織等功能[1]。巨噬細胞功能的發揮與周圍微環境相關,微環境中的細胞因子、微生物等可以導致巨噬細胞向不同的方向極化,從而發揮不同的功能[2]。巨噬細胞的M1型和M2型表型已被公認,M1型和M2型兩亞型功能相反,M1型能夠產生多種促炎因子,比如腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、誘導型一氧化氮合酶(inducible nitric oxide synthase,INOS),而M2型巨噬細胞則產生多種抑炎因子來緩解炎癥[3]。巨噬細胞存在一系列連續的功能狀態,M1型和M2型是連續狀態的兩個極端,在不同條件下,這兩種極端可以相互轉化[4]。Nahrendor等[5]發現在急性心肌梗死過程中巨噬細胞的M1/M2表型會轉化。
骨髓間充質干細胞(bone marrow-derived mesenchymal stem cell,BMSC)是從骨髓中提取的一類間充質干細胞(mesenchymal stem cell,MSC)。間充質干細胞是一種具有分化能力的多能干細胞,能夠分化為骨、軟骨、脂肪、肌肉等多種組織細胞,同時具有促進傷口愈合與再生的能力[6]。它主要來源于臍帶、脂肪、骨髓等[7]。間充質干細胞具有低免疫原性,對機體中的免疫細胞具有重要的免疫調控作用[8,9]。有研究證實,MSCs主要通過影響參與炎癥反應的免疫細胞增殖、分化和炎性因子分泌來進行免疫調控[10,11],但是其免疫調控機制復雜,尚未完全明確。因此探究間充質干細胞對巨噬細胞的影響,是否能促進巨噬細胞向分泌抑炎因子的M2型極化具有重要的研究意義。本研究利用培養小鼠骨髓間充質干細胞培養液(bone marrow-derived mesenchymal stem cell culture medium,BMSC-CM)處理M1型巨噬細胞Raw264.7,探究BMSC-CM對巨噬細胞Raw264.7表型極化的影響以及其分子機制。
1 材料與方法
1.1 材料
3周齡C57BL/6小鼠購自湖南斯萊克景達公司。DMEM(dulbecco’s modified eagle medium)培養基、DMEM/F12[dulbecco’s modified eagle medium nutrient mixture F-12(Ham)]培養基、胎牛血清(fetal bovine serum,FBS)、胰酶、青霉素和鏈霉素雙抗均來自Gibco公司(Gibco,USA)。脂多糖(lipopolysaccharide,LPS)來自Sigma-Aldrich公司(Sigma-Aldrich,USA)。RNA提取試劑Trizol(Takara,Japan),反轉錄試劑盒GoScriptTMReverse Transcription System(Promega,USA),氯仿(瀘試試劑,上海),異丙醇和乙醇來自恒興試劑公司(恒興試劑,天津),1.1×T3 Super PCR Mix試劑、瓊脂糖和引物均購自擎科生物公司(擎科生物,北京)。細胞裂解液RIPA試劑(碧云天,上海),磷酸緩沖鹽溶液(phosphate buffer saline,PBS)和蛋白質定量BCA試劑盒來自生工生物公司(生工生物,上海)。蛋白免疫印跡所用的抗體包括:anti-STAT3 兔單克隆抗體(生工試劑,上海);anti-tubulin兔單克隆抗體(Sigma-Aldrich,USA);anti-p-STAT3兔單克隆抗體(Cell Signaling Technology,USA);辣根過氧化物酶標記的羊抗兔二抗(Abmart,UAS);化學發光ECL試劑(Advansta,USA)。
1.2 骨髓間充質干細胞的提取及培養
骨髓間充質干細胞提取參考Zhu等[12]的方法,稍有改進。選取雌雄不限的3周齡C57BL/6小鼠,頸 椎脫臼法處死;用75%酒精浸泡處死的小鼠1 min,取小鼠股骨和脛骨放置在盛有預冷的PBS的培養皿中,用PBS清洗股骨與脛骨2次,洗去附著在上面的小塊的肌肉組織;將股骨與脛骨的兩側骨端剪去,用1 mL的注射器吸入含有10%FBS的DMEM/F12培養液,從股骨或脛骨的一側打出至培養皿中,重復沖洗直至股骨或脛骨發白;收集沖洗的培養液,3 048 r/min離心5 min,棄掉上清液,用含10%FBS的DMEM/F12培養液重懸,放置在37 ℃、5%CO2的培養箱中培養。此后每間隔8 h,更換培養液,此步驟重復3次,此步驟是將造血干細胞、紅細胞等懸浮的細胞去除得到純的骨髓間充質干細胞。常規培養至細胞達到80%~90%融合時進行傳代。
1.3 骨髓間充質干細胞培養液(BMSC-CM)的制備
骨髓間充質干細胞傳代至第2、3代,當細胞達到80%~90%融合時,使用DMEM培養液培養,24 h后吸取培養液,16 697 r/min離心10 min,取上清液,保存于-20 ℃,細胞常規傳代。
1.4 Raw264.7細胞的培養及處理
Raw264.7細胞為本實驗室凍存,使用含10%胎牛血清的DMEM培養液常規傳代培養。試驗分為DMEM培養組(DMEM組)、BMSC-CM培養組(BMSC-CM組)、LPS刺激DMEM培養組(LPS+DMEM組)、LPS刺激BMSC-CM培養組(LPS+BMSC-CM組)。當Raw264.7細胞融合至50%時,DMEM組和BMSC-CM組常規換液,LPS+DMEM組和LPS+BMSC-CM組更換添加1 μg/mL LPS的DMEM培養液培養;12 h后,DMEM組和LPS+DMEM組更換DMEM培養液培養,BMSC-CM組和LPS+BMSC-CM組更換含50%BMSC-CM的DMEM培養液培養。培養48 h,提取總RNA進行半定量PCR,提取總蛋白進行Western 蛋白質印跡試驗。
1.5 RNA提取以及半定量PCR
按1.4的步驟處理的Raw264.7細胞,采用Trizol試劑提取各組的RNA。首先將各組細胞用PBS清洗1遍,再加入1 mL Trizol裂解細胞,加入250 μL氯仿后充分震蕩并靜置5 min;4 ℃、11 807 r/min離心10 min,收集上清液加入350 μL異丙醇,室溫靜置10 min后,在4 ℃下11 807 r/min離心10 min,棄上清并用1 mL預冷的75%乙醇充分洗滌沉淀,離心去掉乙醇;待乙醇揮發后,用RNase free水溶解RNA,測定在260和280 nm的吸光值(A),以A260/A280確定RNA濃度,比值在1.8~2.0內。按照GoScriptTMReverse Transcription System試劑盒操作說明書進行逆轉錄,合成cDNA鏈,以2 μg的RNA為模板,逆轉錄反應體系為:20 μL,擴增程序為25 ℃,5 min;42 ℃,1 h;70 ℃,15 min。得到的cDNA用滅菌水稀釋5倍作為半定量PCR的模板。使用1.1×T3 Super PCR Mix試劑進行半定量PCR,半定量PCR擴增程序為:預變性98 ℃ 5 min;PCR反應98 ℃ 30 s,60 ℃ 30 s,72 ℃ 10 s,共28個循環。最后取20 μL PCR產物用2%瓊脂糖凝膠電泳,以小鼠GAPDH(glyceraldehyde-3-phosphate dehydrogenase,甘油醛-3-磷酸脫氫酶)mRNA作為內參,計算樣品的mRNA相對表達量。PCR引物序列見表1。

表1 PCR引物序列Tab.1 Primer sequence for PCR
1.6 蛋白提取及Western蛋白質印跡檢測
按1.4的步驟處理的Raw264.7細胞,去掉細胞培養液,收集用胰蛋白酶消化后的細胞,用PBS清洗3次,加入RIPA試劑提取總蛋白,BCA試劑盒測定蛋白濃度。加入蛋白上樣緩沖液后105 ℃變性10 min,制備12%聚丙烯酰胺膠,取40 μg蛋白上樣電泳。濕法電轉移80 min,5%脫脂牛奶TBST封閉后,孵育稀釋的一抗:anti-tubulin兔單克隆抗體(1∶5 000)、anti-STAT3 兔單克隆抗體(1∶500)、anti-p-STAT3兔單克隆抗體(1∶1 000),4 ℃輕微搖晃過夜,TBST洗膜3次,每次10 min,室溫孵育辣根過氧化物酶標記的羊抗兔二抗(1∶5 000)1 h,TBST洗膜3次,每次10 min,加入ECL試劑顯影。
1.7 統計學方法
試驗數據采用SPSS 25統計軟件進行統計分析。數據分析采用Student’st-test檢測。誤差線表示3個獨立的平均值的標準差,*P<0.05;**P<0.01;***P<0.001;****P<0.000 1。
2 結果與分析
2.1 骨髓間充質干細胞原代細胞形態學觀察
重懸細胞培養24 h對細胞進行換液后,如圖1所示,在顯微鏡下觀察可見細胞貼壁生長,多數細胞呈圓形,部分呈不規則形狀;培養至第4 d時,顯微鏡視野下細胞之間間隙較寬,細胞攤開伸出偽足向梭形形狀生長;培養至第7 d時,細胞大多數呈梭形,且細胞開始聚集;培養至第10 d時,細胞呈梭形且形態均一,細胞聚集呈漩渦狀。第一代細胞細長呈長梭形,胞體小,并且偽足較少;第五代和第十代的細胞形態、細胞大小、偽足數量和第一代比較無明顯變化,細胞均呈梭形,匯合時呈漩渦狀,細胞活力高,增殖速度較快。
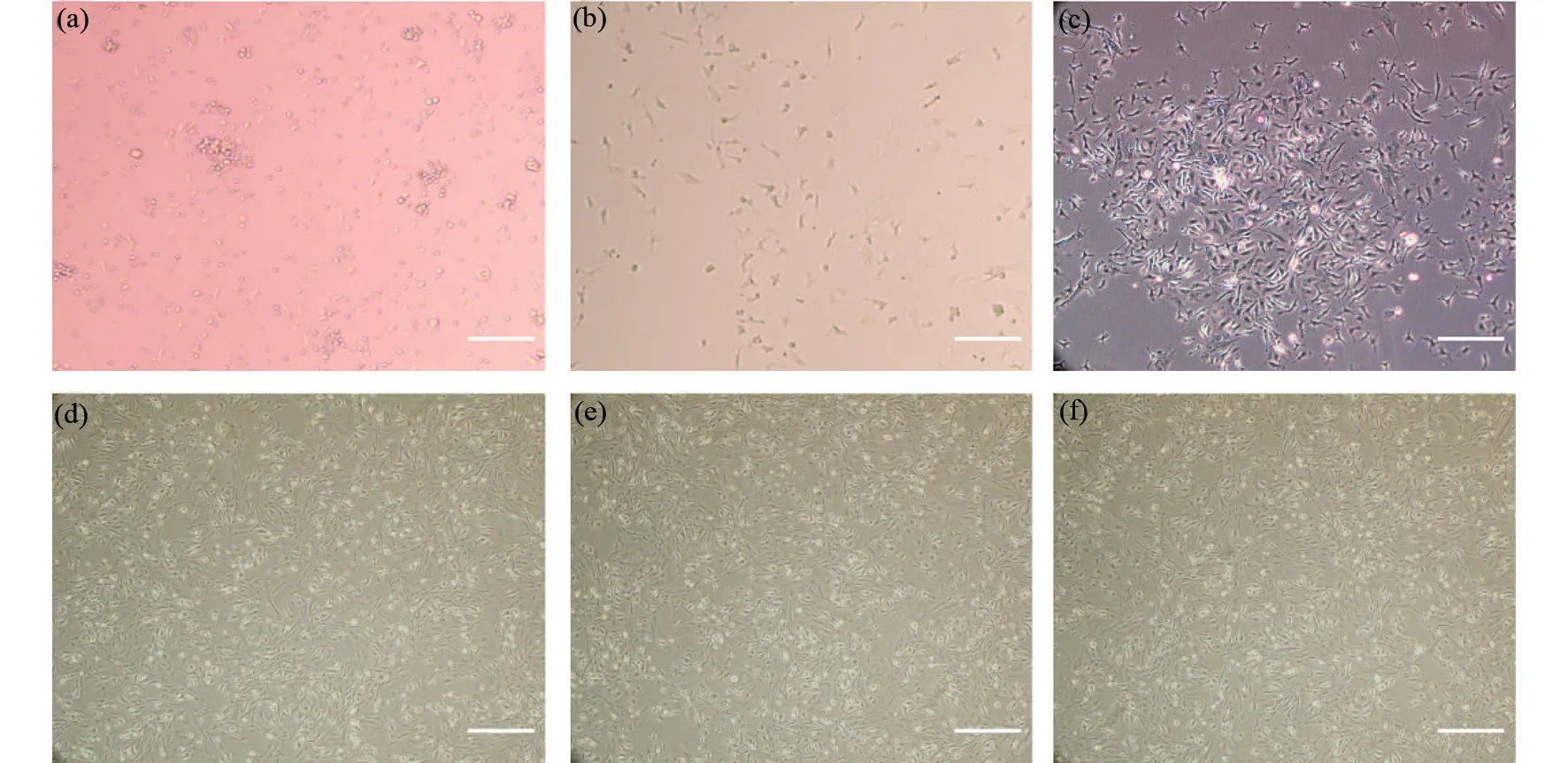
圖1 骨髓間充質干細胞各時期細胞形態(比例尺1∶400 μm,×10)Fig.1 Cell morphology of bone marrow mesenchymal stem cells at various stages (scale 1∶400 μm,×10)(a)24 h;(b)第4天;(c)第7天;(d)第一代;(e)第五代;(f)第十代(a)24 h;(b)4 d;(c)7 d;(d)The first generation;(e)The fifth generation;(f)The tenth generation
2.2 MSC-CM對LPS誘導的Raw264.7細胞分型相關標記分子mRNA相對表達量的影響
根據文獻報道,巨噬細胞M1型和M2型的分型可以通過檢測相關標志因子的表達來區分,M1型的促炎因子TNF-α和INOS表達較高,而M2型的抑炎因子精氨酸1(arginase 1,ARG-1)和轉化生長因子β1(transforming growth factor beta 1,TGF-β1)表達較高[13]。如圖2所示,MSC-CM組和LPS+MSC-CM組M1型的相關標記分子TNF-α和INOSmRNA表達比DMEM組和LPS+DMEM組明顯下降,而且這兩組M2型的相關標記分子ARG-1和TGF-β1mRNA表達比DMEM組和LPS+DMEM組明顯上升。從檢測標志基因mRNA水平上可以說明,LPS組巨噬細胞處于M1型狀態,而MSC-CM處理的Raw264.7細胞由M1型向M2型狀態極化。
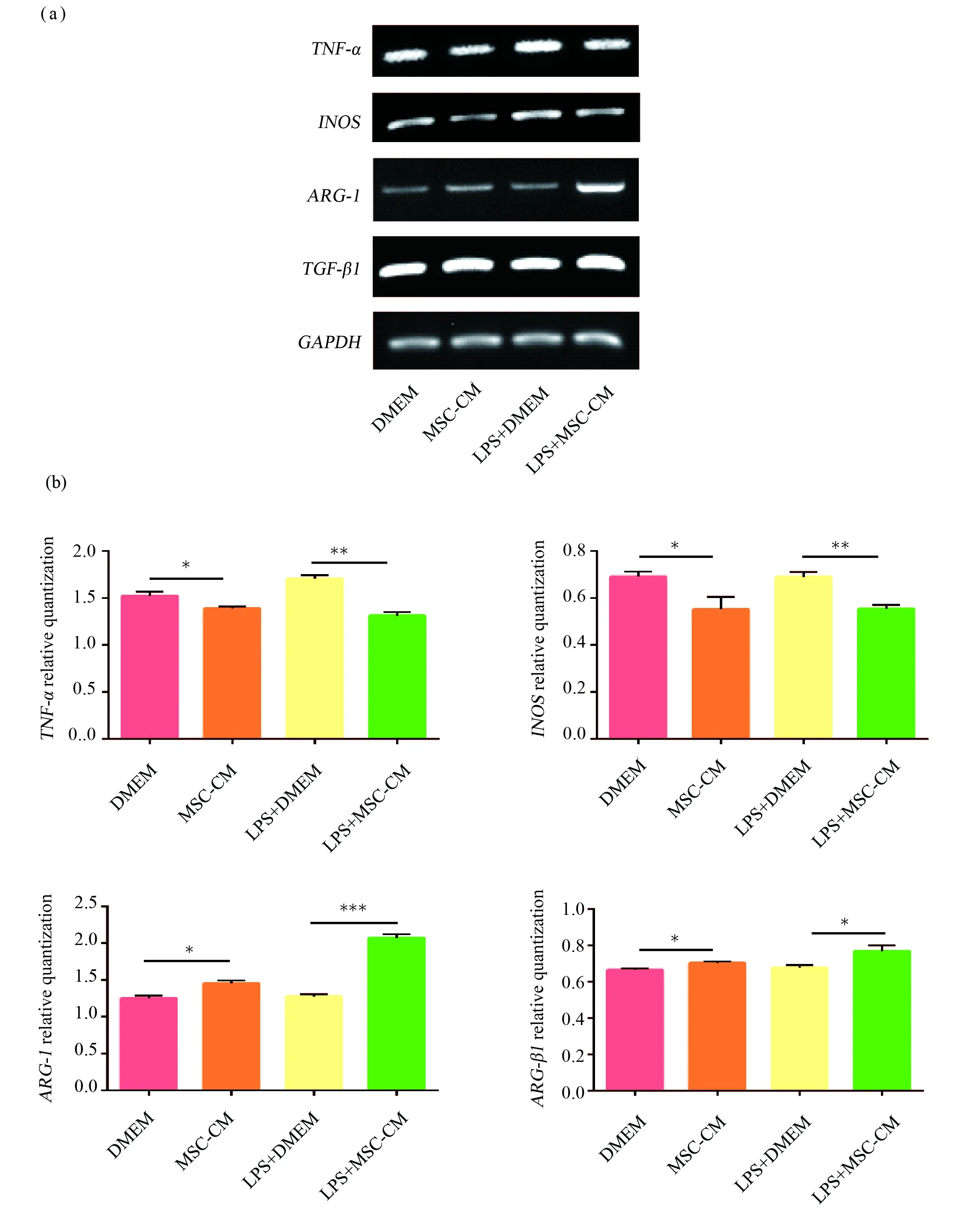
圖2 M1型和M2型相關標志因子mRNA表達水平Fig.2 M1 and M2 related marker factor mRNA expression levels(a)半定量PCR檢測TNF-α, INOS, ARG-1和TGF-β1 mRNA表達水平;(b)對a圖的數據統計分析。星號示差異有統計學意義(*P<0.05,** P<0.01,*** P<0.001)(a)Detection of TNF-α, INOS, ARG-1 and TGF-β1 mRNA expression levels by semi-quantitative PCR;(b)Statistical analysis of the data of the Fig.a. The asterisks indicate a statistically significant difference (*P<0.05,** P<0.01,*** P<0.001)
2.3 MSC-CM對LPS誘導的Raw264.7細胞IL-10 mRNA水平以及STAT3和p-STAT3蛋白表達的影響
由2.2的結果可以發現MSC-CM可以誘導Raw264.7向M2型極化的現象,進一步探究這一現象的具體分子機制。查閱文獻得知M2型巨噬細胞可高分泌IL-4和IL-10等細胞因子[14,15],因此推測可能與IL-10/STAT3信號通路有關。半定量PCR檢測IL-10mRNA水平和Western blot檢測p-STAT3和STAT3蛋白水平,結果如圖3所示,兩組MSC-CM處理的Raw264.7的IL-10mRNA水平相對比其他兩組表達明顯上升。而p-STAT3蛋白水平的趨勢與IL-10mRNA水平趨勢一致,使用MSC-CM培養處理的細胞p-STAT3蛋白表達比LPS/DMEM組明顯上調,各組的STAT3蛋白無明顯變化。試驗結果說明,MSC-CM誘導Raw264.7向M2型極化的分子機制是通過促進STAT3磷酸化來激活IL-10/STAT3信號通路的進行。
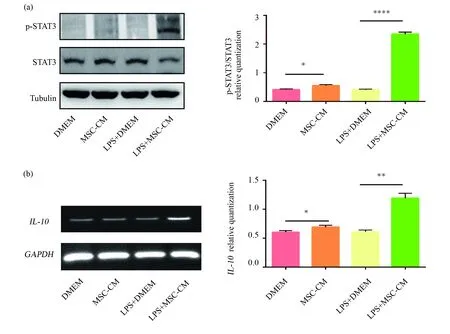
圖3 檢測STAT3和p-STAT3蛋白表達水平和 IL-10 mRNA表達水平Fig.3 Detection of STAT3 and p-STAT3 protein expression levels and IL-10 mRNA expression levels(a)蛋白免疫印跡檢測STAT3和p-STAT3蛋白水平。星號示差異有統計學意義(*P<0.05,** P<0.01,**** P<0.000 1);(b)半定量PCR檢測IL-10 mRNA水平。星號示差異有統計學意義(*P<0.05,** P<0.01)(a)Western blotting detects STAT3 and p-STAT3 protein levels. The asterisks indicate a statistically significant difference (*P<0.05, ** P<0.01,**** P<0.000 1);(b)Semi-quantitative PCR detects IL-10 mRNA levels. The asterisks indicate a statistically significant difference (*P<0.05, ** P<0.01)
3 討論
間充質干細胞是一種具有自我更新和分化能力的多能干細胞,它易獲取,增殖能力強,具有免疫抑制作用[16]。因此MSC是細胞治療中一種非常有吸引力的載體[10]。MSC可以從多種組織中分離出來,比如臍帶、脂肪和骨髓,但與其他組織來源獲取MSC相比,從骨髓中分離操作相對簡單,且易獲取大量MSC[6]。小鼠作為模式生物之一,它與人類具有高度的同源性,因此從小鼠骨髓中獲取MSC是研究BMSC功能性有效的細胞模型。MSC細胞治療的難度在于如何在體外培養維持MSC活性和干細胞功能性[17]。MSC在出現衰老時,其代謝特征將會改變[18,19]。BMSC衰老過程中的遺傳損傷會隨之積累,這將減弱干細胞的可用性和功能[20]。因此,BMSC的活性維持和擴增后干細胞功能性保持是研究BMSC的基礎。目前文獻報道小鼠BMSC大多數是來源4~8周齡小鼠,隨著小鼠的生長發育,體內的干細胞分化能力和活力將會隨之發生改變。隨著鼠齡增大,其來源的BMSC活力和分化能力將會下降。本研究采用3周齡C57BL/6鼠為試驗對象,3周齡的C57BL/6鼠處于剛斷奶狀態,其發育不齊全,且體型偏小,利用這些特點很容易提取活力強的BMSC。在之后的研究中發現,正常培養BMSC能夠擴增至十代,且細胞形態、大小不發生改變,其促進STAT3磷酸化誘導Raw264.7細胞向M2型極化的生物功能也不會發生改變。由此可知,通過本研究中提取BMSC的方法能夠有效維持BMSC活性以及干細胞功能。
巨噬細胞在淋巴組織和非淋巴組織中都存在,被認為其通過清除凋亡細胞和分泌生長因子維持穩態[21]。巨噬細胞具有病原體識別受體,能夠有效吞噬病原體并能誘導產生炎性因子參與免疫反應[1,22]。有關研究表明,巨噬細胞存在一系列連續的功能狀態,M1型和M2型是連續狀態的兩個極端[3]。通常認為M1型巨噬細胞分泌促炎性細胞因子和趨化因子,在免疫反應中提呈抗原和吞噬病原體,從而引發炎癥;M2型巨噬細胞通過分泌抑制性細胞因子TGF-β和IL-10等下調免疫應答,起到抑制炎癥的作用[23]。M1型巨噬細胞表達TNF-α和INOS比M2型明顯升高,而M2型巨噬細胞ARG-1的表達水平比M1型顯著提高[14,15],因此檢測巨噬細胞相關標記可以鑒定巨噬細胞的狀態。本研究中利用LPS誘導巨噬細胞Raw264.7,檢測巨噬細胞TNF-α和INOS標志因子,結果顯示TNF-α和INOSmRNA表達上升,表明巨噬細胞處于能夠導致炎癥發生的M1型,再用BMSC-CM處理巨噬細胞,研究BMSC-CM是否能夠抑制炎癥,結果表明,使用BMSC-CM處理的巨噬細胞的ARG-1和TGF-β表達上升,表明巨噬細胞處于M2型。
有關文獻報道STAT3是調節抗炎因子IL-10的轉錄因子,在抑制炎癥反應過程中發揮很重要的調控作用[24,25]。STAT3屬于STAT家族中一員[26],而JAK-STAT信號通路是由細胞因子調控激活的信號轉導通路,參與細胞的增殖、分化、免疫以及凋亡等生物學過程[27,28]。研究表明,一類細胞因子可以調控多種JAK激酶,但是細胞因子對STAT家族蛋白的激活具有特異性,例如IL-1選擇性激活STAT-1,IL-4特異性激活STAT-6,IL-10特異性激活STAT-3[29]。我們查閱大量文獻,最終推測BMSC-CM對Raw264.7向M2型極化可能是通過IL-10/STAT-3通路誘導的。我們半定量PCR檢測對照組和試驗組的IL-10mRNA水平,結果顯示BMSC-CM處理的Raw264.7的IL-10表達上升;根據這一結果,我們檢測了各組的p-STAT3蛋白水平,結果顯示BMSC-CM可以上調p-STAT3,對STAT3的影響沒有明顯的調控作用。這與之前檢測M1型和M2型巨噬細胞的標志因子結果相對應,因此可以說明BMSC-CM主要是通過激活STAT3磷酸化參與IL-10/STAT3通路誘導巨噬細胞Raw264.7細胞向M2型極化,從而發揮抑制炎癥的功能。
綜上所述,從3周齡C57BL/6鼠的骨髓中分離的BMSC活性較好,而且能夠持續十代維持其干細胞功能,提取培養BMSC的上清液處理由LPS誘導的M1型Raw264.7細胞,試驗證明,BMSC-CM能夠有效緩解炎癥的發生,主要是促進STAT3磷酸化通過IL-10/STAT3信號通路來誘導M1型巨噬細胞向M2型極化,從而達到抑制炎癥的效果。但進一步思考可發現BMSC能夠分泌許多類型的細胞因子,具體哪種細胞因子促進STAT3磷酸化暫時還沒有得到結論,因此從BMSC分泌的細胞因子中篩選出有效抑制炎癥的細胞因子,再體外培養能夠大量分泌該種細胞因子的BMSC,這將是一個更有意義、更有趣的研究。

