不同手術方式對子宮內膜息肉不孕患者性生活質量及妊娠結局的影響
劉晶晶,張曉光,袁鳳云
(安徽省亳州市人民醫院生殖醫學科, 安徽 亳州 236800)
子宮內膜息肉(Endom etrialpolyps,EP)是誘發不孕癥的主要病因之一,發病率高達25.0%,并隨年齡增長呈上升態勢,可影響受精卵著床,降低子宮內膜容受性,導致子宮異常出血,影響患者生育需求[1]。數據顯示,EP雖多為良性病變,但其癌變風險高達0.5%~4.8%[2]。目前臨床治療EP主要原則在于徹底清除息肉,抑制疾病復發。近年來,隨臨床研究進一步發展,宮腔鏡手術因無需開腹、術后創傷小等特點逐漸應用于臨床實際,能對刮診、活檢準確定位,降低盲目刮宮發生率,減少漏刮發生。宮腔鏡下息肉鉗夾術機械性清除、宮腔鏡子宮內膜息肉電切除術均為臨床常用手術術式,但關于選取何種術式尚存在一定爭議。另外,相關研究表明,細胞因子水平在EP發生、發展中起著重要作用,可引發子宮內膜周期性改變[3]。鑒于此,本研究分別予以宮腔鏡下息肉鉗夾術機械性清除、宮腔鏡子宮內膜息肉電切除術,探討其對EP不孕患者宮腔液細胞因子及性生活質量的影響。具體分析如下。
1 資料與方法
1.1 一般資料:回顧性分析2017年5月至2018年8月我院106例EP不孕患者,依據手術方案分組,每組各53例。兩組基本資料(年齡、體質量指數、病程、病灶直徑、不孕時間、血紅蛋白、息肉數目、息肉類型、不孕類型)均衡可比(P>0.05),見表1。本研究經我院醫學倫理委員會批準。
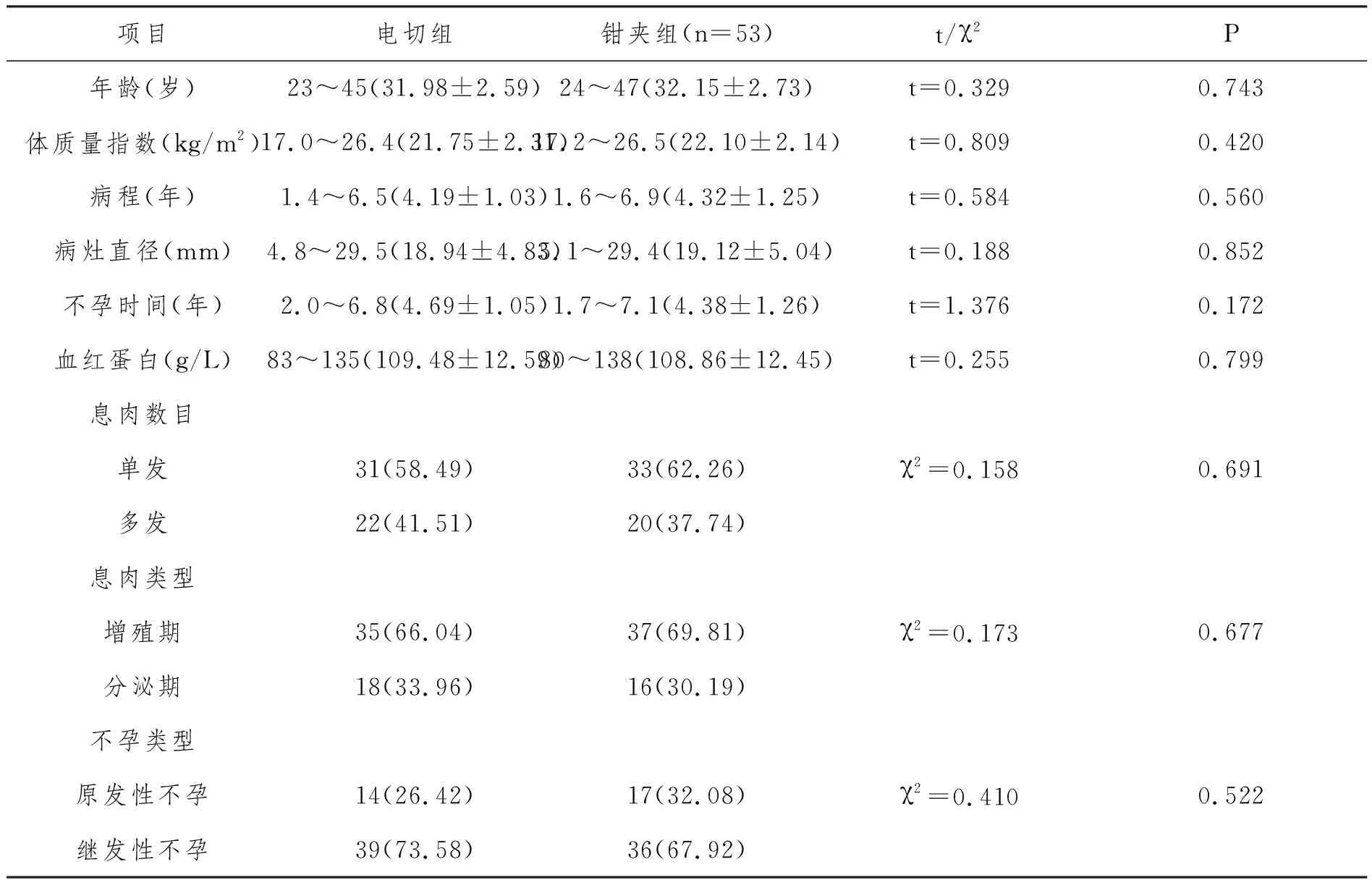
表1 兩組一般資料比較
1.2 選取標準:納入標準①伴有月經量增多或存在不規則出血、子宮宮體稍有增大、形態規則、宮頸口息肉等臨床表現;②經超聲檢查顯示宮內異常回聲,子宮內膜表面可見突起、光滑良性結節;③卵巢功能及男方精液無異常。排除標準①乳腺癌、子宮縱隔、子宮畸形、子宮腫瘤或宮頸惡性病變者;②盆腔粘連或多次腹腔手術史者;③合并子宮肌瘤、多囊卵巢綜合征、單側或雙側卵巢占位性病變、急性盆腔炎、輸卵管積水及子內膜炎等其他不孕原因者;④手術禁忌證者;⑤合并凝血機制紊亂或活動性出血者;⑥術前12周接受激素、非甾體抗炎藥等治療者;⑦精神行為異常者。
1.3 方 法
1.3.1 手術方法:兩組均于月經后3~7d內實施手術,選用0.9%氯化鈉溶液為膨宮液,壓力控制為90~100mmHg,麻醉方式為靜脈復合麻醉,行膀胱截石位;對陰道、外陰、宮頸進行常規消毒,并對宮頸前唇實施鉗夾處理,結合陰道超聲探查宮頸深度,擴張宮頸管至8號,置入宮腔鏡,實施膨宮,注意流量控制在150mL/min。宮腔鏡下全面檢查宮頸,明確息肉體積、根蒂部位、數目等。①鉗夾組實施宮腔鏡下息肉鉗夾術機械性清除。應用卵圓鉗(小號)鉗夾扭除息肉,送檢,息肉基底部實施滾珠電極電凝止血,同時予以吸管負壓(8號,300~400mmHg)吸宮處理宮腔內膜2次,后實施陰道超聲復查,徹底刮除息肉后,取出宮腔鏡。術后月經后半周期口服地屈孕酮片,10mg/次,2次/d,連用3個月。②電切組實施宮腔鏡子宮內膜息肉電切除術。環狀電極切除息肉基底部,功率為80~100W,電凝40~60W,搔刮宮腔,刮除彌漫型小息肉,送檢。采用球囊壓迫止血,將導尿管頭端送至子宮底端,同時向球囊注入20~25mL生理鹽水,導尿管另一端與引流袋連接,觀察術后引流情況,無血液流出后,取出球囊。術后第1次月經結束后4~7d于宮腔放置左炔諾孕酮宮內緩釋系統(LNG-IUS)。
1.3.2 檢測方法:應用擴陰器擴展陰道,注入5mL無菌生理鹽水,反復沖洗3次,收集15mL灌洗液于離心管中,采用酶聯免疫吸附試驗檢測灌洗液中干擾素γ(IFN-γ)、胰島素樣生長因子-1(IGF-1)、白細胞介素1β(IL-1β)水平,試劑盒購自上海潤達醫療科技股份有限公司,上述均嚴格按照試劑盒說明書操作。
1.4 觀察指標:①對比兩組術前、術后3個月子宮內膜厚度、月經量,其中子宮內膜厚度以彩色多普勒超聲診斷儀(購自綿陽先鋒醫療器械有限公司)檢測;月經量以月經失血圖(PBAC)評分進行評估,PBAC評分≥100分為月經過多。②對比兩組術前、術后3個月宮腔液細胞因子(IL-1β、IFN-γ、IGF-1)水平。③對比兩組術后6個月性生活質量(每周性生活頻率、性喚起時間、獲得高潮時間及性生活滿意度),每項評分0~10分,得分越高,性生活質量越高。④對比兩組術后6、9、12個月復發率。⑤術后隨訪12個月,對比兩組妊娠結局,包括異位妊娠率、宮內妊娠率。
2 結 果
2.1 子宮內膜厚度、PBAC評分:兩組術前子宮內膜厚度、PBAC評分比較無顯著差異(P>0.05);電切組術后3個月子宮內膜厚度小于鉗夾組,PBAC評分低于鉗夾組(P<0.05),見表2。
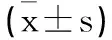
表2 兩組子宮內膜厚度 PBAC評分比較
2.2 宮腔液細胞因子水平:兩組術前宮腔液IL-1β、IFN-γ、IGF-1水平比較無顯著差異(P>0.05);電切組術后3個月宮腔液IL-1β、IFN-γ、IGF-1水平低于鉗夾組(P<0.05),見表3。
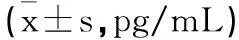
表3 兩組宮腔液IL-1β IFN-γ IGF-1水平比較
2.3 術后6個月性生活質量:電切組術后6個月性生活滿意度、每周性生活頻率高于鉗夾組,性喚起時間短于鉗夾組,獲得高潮時間長于鉗夾組(P<0.05),見表4。
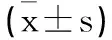
表4 兩組術后6個月性生活質量比較
2.4 復發率:兩組術后6個月復發率比較,無顯著差異(P>0.05);電切組術后9、12個月復發率低于鉗夾組(P<0.05),見表5。
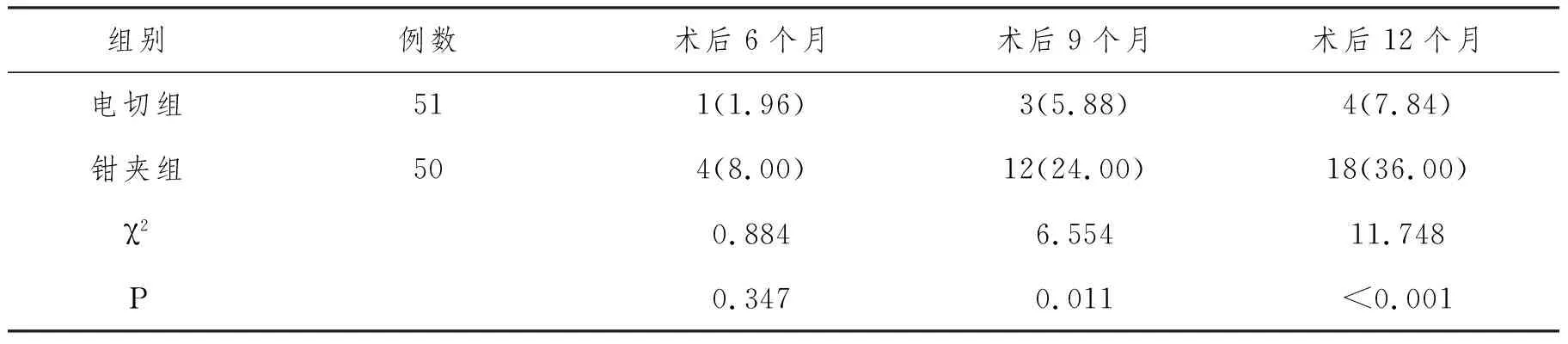
表5 兩組復發率比較n(%)
注:電切組失訪2例,鉗夾組失訪3例
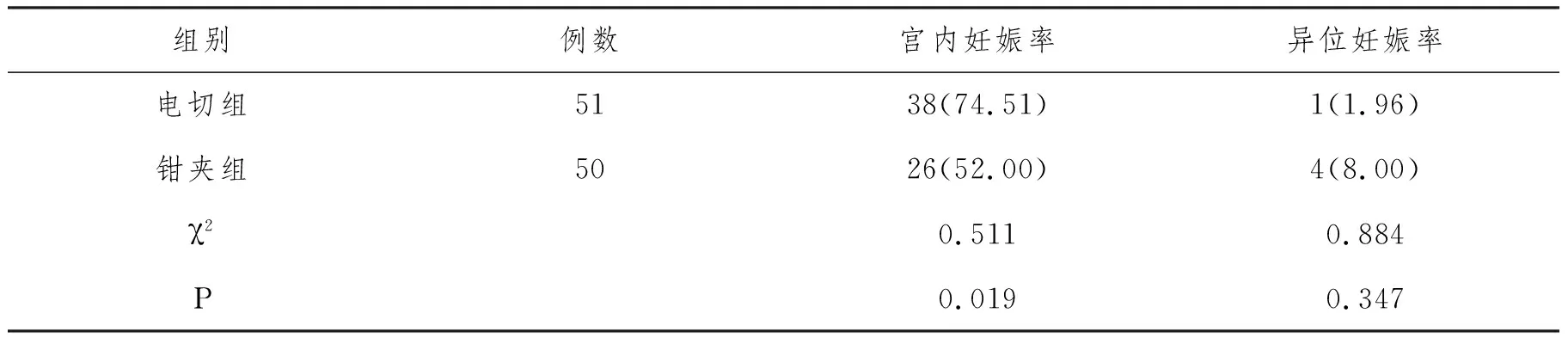
表6 妊娠結局n(%)
注:電切組失訪2例,鉗夾組失訪3例
2.5 妊娠結局:術后隨訪12個月,兩組異位妊娠率比較,無顯著差異(P>0.05);電切組宮內妊娠率74.51%高于鉗夾組52.00%(P<0.05),見表6。
3 討 論
目前臨床尚未完全明確EP不孕發病機制,考慮其可能為:①EP堵塞輸卵管開口,干擾精子移行及精卵間結合;②EP直徑過大或多發,導致宮腔形態改變,宮腔體積縮小,影響子宮局部內膜供血,干擾受精卵發育,抑制精子運輸、胚胎著床[4,5]。診刮術作為既往臨床常用手段,屬于盲視操作,難以完全根除子宮內基底層息肉根蒂,易殘留部分息肉,導致病情反復發作,且刮宮過程中,易損傷子宮內膜組織,影響患者生育功能。
臨床實踐發現,宮腔鏡手術利用宮腔鏡能提高手術清晰度,清楚顯現宮腔環境,有利于徹底根除息肉,減少息肉復發。鄧翠平等[6]研究發現,EP不孕患者采用宮腔鏡下電切除術治療,能有效切除兩宮角、隱匿性微小息肉,避免息肉切除遺漏,且不傷及子宮內膜,有助于縮短手術時間,降低術中出血量。在此基礎上,本研究結果顯示,電切組術后3個月子宮內膜厚度小于鉗夾組,PBAC評分低于鉗夾組,術后9、12個月復發率低于鉗夾組(P<0.05)。盡管宮腔鏡下息肉鉗夾術機械性清除具有一定療效,但術中應用鉗夾處理,難以完全切除子宮底、宮角部的息肉組織,且其手術風險較高,嚴重者需中途轉子宮切除術,而宮腔鏡子宮內膜息肉電切除術采用電切方式,能避免息肉根蒂殘留,降低息肉復發風險,且術后加用LNG-IUS,能使內膜厚度變薄,加強子宮肌層收縮,短期內可降低子宮內膜與雌激素間敏感性,抑制內膜增生,促使子宮內膜蛻膜樣變化,降低子宮內膜厚度,減少月經量,維持正常月經周期[7],進一步佐證了宮腔鏡子宮內膜息肉電切除術在改善子宮內膜厚度、降低月經量、減少復發方面明顯優于宮腔鏡下息肉鉗夾術機械性清除。
另外,細胞因子可通過自分泌或旁分泌機制作用于子宮內膜,介導、調節雌孕激素,一定程度可促進子宮內膜生長、分化,參與子宮內膜增生性疾病發生、發展。秦娟等[8]通過RT-PCR技術檢測發現,IGF-1在子宮內膜癌、EP病變組織中呈異常高表達,可為臨床鑒別診斷EP、子宮內膜癌提供新思路。何紅梅[9]觀點認為,IL-1β水平過高可導致組織損傷、慢性炎癥,刺激成纖維細胞增殖,沉積膠原,誘發EP,同時其還能誘導或促進細胞毒性作用,干擾正常受精過程及胚胎發育。同時,IFN-γ水平異常升高,可誘發Th1/Th2細胞因子病理偏移,引起子宮內膜異常增生,形成息肉。本研究數據表明,電切組術后3個月宮腔液IL-1β、IFN-γ、IGF-1水平低于鉗夾組(P<0.05)。充分證實相較于宮腔鏡下息肉鉗夾術機械性清除,宮腔鏡子宮內膜息肉電切除術術后應用LNG-IUS,能顯著調節EP不孕患者IL-1β、IFN-γ、IGF-1水平,糾正機體內分泌紊亂,維持雌孕激素正常水平,改善子宮內膜微環境。此外,宮腔鏡下息肉鉗夾術機械性清除多采用電極電凝止血,易引發血管壁腫脹、管腔狹窄,而宮腔鏡子宮內膜息肉電切除術采用球囊壓迫止血,通過向球囊內部注入生理鹽水,均勻壓迫創面,不僅保證出血點均能受壓,達到止血的目的,還能保護患者生育功能,改善妊娠結局[10]。進一步對兩組妊娠結局研究發現,術后隨訪12個月,實施宮腔鏡子宮內膜息肉電切除術的EP不孕患者性生活質量、宮內妊娠率明顯高于宮腔鏡下息肉鉗夾術機械性清除。注意宮腔鏡子宮內膜息肉電切除術術后需接受相關孕激素治療,以促使周期性撤退剝脫,達到抑制EP復發的最終目的。
綜上可知,與宮腔鏡下息肉鉗夾術機械性清除相比,宮腔鏡子宮內膜息肉電切除術能顯著改善EP不孕患者子宮內膜厚度,降低月經量,提高性生活質量和宮內妊娠率,且安全性較高。

