亞麻木酚素促進絕經期婦女種植體骨結合機制
張云濤 馬向瑞 王松松 劉菲
(濱州醫學院附屬醫院口腔科,山東 濱州 256600)
種植修復已成為當今的主流修復方式,其中骨質疏松的問題給種植手術及預后帶來了極大的挑戰。絕經后的女性由于雌激素的降低,骨質疏松的發生率較高〔1〕,從而影響種植修復中的骨結合。研究表明,亞麻木酚素(SDG)能提高患者體內血清鈣含量并增加甲狀腺旁腺激素與骨的敏感性〔2〕,促進體內新骨的形成,減少骨質的流失〔3〕。因此,通過本實驗觀察SDG對成骨細胞的增殖分化及護骨素(OPG) mRNA表達的影響。
1 材料和方法
1.1主要器材和材料 激光掃描共聚焦顯微鏡(TCS SPE,Leica,德國);紫外-可見光分光光度計( Eppendorf,德國);CO2細胞培養箱(Thermo Fisher Scientific,美國);酶標儀(Thermo lab systems multiskan mk3,美國);熒光實時定量-聚合酶鏈反應(PCR)儀(Rotor-Gene 3000,Corbett,澳大利亞);α-MEM 培養液(Hyclone);噻唑藍(Sigma,美國 );SDG(美侖生物meilunbio?);堿性磷酸酶(ALP)檢測試劑盒(碧云天);反轉錄試劑盒(PrimeScriptTM RT reagent Kit with gDNA Eraser);總RNA 提取試劑(RNAiso Plus);PCR試劑盒(Takara,日本);Rhodamine Phalloidin(Cytoskeleton,美國)。
1.2MC3T3-E1細胞培養 由華西口腔醫學院贈送。用含 10%胚牛血清(FBS),青霉素 100 U/ml,鏈霉素100 μg/ml的α-MEM培養液,置于37℃、5% CO2的環境中培養,取3 次傳代后處于對數生長期的細胞進行實驗。
1.3不同濃度梯度SDG培養液的配制 配制含SDG培養液:0、10-9、10-8、10-7、10-6、10-5mol/L,共6個濃度組。
1.4噻唑藍(MTT)法檢測成骨細胞增殖 將MC3T3-E1細胞接種于96孔板,密度為5×104個/ml,每孔加200 μl細胞懸液,設3個復孔;細胞培養箱中培養24 h后,更換為含SDG濃度為0、10-9、10-8、10-7、10-6、10-5mol/L的培養液;培養1 d、2 d、3 d時,每孔加入濃度為5 mg/ml MTT 20 μl及無血清培養基100 μl,要求在避光環境下進行。5%CO2、37℃培養箱中孵育4 h,吸去孔內培養液,每孔加入150 μl二甲基亞砜(DMSO),置搖床上低速振蕩10 min,取下96孔板在酶標儀490 nm波長處測量各孔的吸光值(A值),同時設置調零孔。
1.5ALP活性檢測 以 3×104個細胞/ml的密度接種于6孔板,毎孔1 ml細胞懸液,每組設3復孔,培養箱中培養24 h,更換為含SDG濃度為0、10-9、10-8、10-7、10-6、10-5mol/L的培養液,培養3、7、14 d,每孔加入細胞裂解液200 μl,裂解后離心機離心取上清液,參照ALP試劑盒說明書操作剩余步驟,設定酶標儀405 nm波長處測定其A值。
1.6RT-qPCR 檢測細胞OPG mRNA 的表達 將對數生長期的MC3T3細胞計數為3×104/ml的混懸液接種在6孔板,每孔添加2 ml,設置3個復孔,24 h細胞充分貼壁后,更換為含SDG濃度為0、10-9、10-8、10-7、10-6、10-5mol/L的培養基,細胞培養3 d后提取,分光光度計檢測總RNA純度,結果顯示各組 A260/A280值均在1.7~2.1之間,參照說明書合成 cDNA。內參GADPH及OPG 引物的合成見表1,RT-qPCR 反應采用熒光染料法(參照寶生物染料法熒光定量試劑盒SYBR Premix Ex Taq 說明),反應條件為95℃預變性30 s,1個循環;95℃變性5 s,60℃退火30 s,45個循環。選擇20 μl體系:SYBRⅡ 10 μl,上游引物下游引物各0.8 μl,RT反應液1.6 μl,焦碳酸二乙酯(DEPC)水,6.8 μl。收集熒光信號進行分析,使用熒光閾值表示RT-qPCR 結果,定義對照組基因表達量為1,根據公式(2-ΔΔCt)計算目的基因表達量,獲得每組基因的相對表達量。

表1 RT-qPCR 引物序列
1.7細胞骨架染色 24孔板中接種處于對數生長期的細胞,并制作細胞爬片,每孔置密度為5×104個/ml的細胞懸液1 ml,細胞貼壁后,更換為含SDG濃度為0、10-9、10-8、10-7、10-6、10-5mol/L的培養液,設置3復孔,孵育24 h后,去除原培養液后磷酸鹽緩沖液(PBS)清洗3次,4%多聚甲醛固定10 min,再次清洗3次,每次10 min。200 μl濃度為100 nmol/L的Rhodamine Phalloidin覆蓋爬片,避光環境下室溫孵育30 min后充分沖洗3次,每次5 min,抗熒光淬滅封片,置于激光共聚焦顯微鏡下進行觀察爬片。
1.8統計學分析 采用SPSS21.0 軟件進行單因素方差分析、t檢驗。
2 結 果
2.1MTT法檢測成骨細胞增殖情況 與空白組比較,10-5mol/L組細胞在1、2 d時增殖受到抑制,差異有統計學意義(P<0.05),3 d時差異無統計學意義(P>0.05);10-6mol/L與10-9mol/L組均無統計學意義(P>0.05);10-7mol/L組、10-8mol/L組顯著增加(P<0.05),見表2。
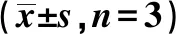
表2 不同濃度SDG對MC3T3增殖的影響
與空白組對比:1)P<0.05;下表同
2.2ALP活性測定 與空白組比較,10-7、10-8mol/L組ALP活性顯著增高(P<0.05),其中10-7mol/L組ALP最高;10-5mol/L組ALP活性顯著降低(P<0.05),10-6、10-9mol/L兩組ALP活性無明顯變化(P>0.05),見表3。
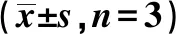
表3 不同濃度SDG對ALP的影響
2.3OPG mRNA表達情況 與空白組(1.00±0.04)比較:10-5mol/L組OPG表達水平(0.75±0.04)顯著下調(P>0.05),10-6、10-7mol/L組OPG mRNA表達水平(1.50±0.10,2.25±0.12)顯著上升(P<0.05),10-8、10-9mol/L組DPG mRNA表達水平(1.25±0.18、1.22±0.03)差異無統計學意義(P>0.05)。
2.4細胞骨架形態的染色 10-5mol/L組細胞伸展面積較小,內部結構層疊不清晰,肌動蛋白纖維不甚清晰,10-9~10-6mol/L組,隨著濃度的升高,細胞伸展面積增大,細胞骨架的內部結構更為清晰。其中10-7、10-6mol/L兩組中可清晰看見纖維走行及細胞內部結構。見圖1。

圖1 不同濃度SDG作用24 h對MC3T3-E1細胞骨架形態的影響(激光掃描共聚焦顯微鏡,× 400)
3 討 論
有資料表明,60 歲以上中老年絕經后女性成為骨質疏松的高危人群,其發病率約為67.80%,而老年女性則高達82.30%〔4〕,由于此類群體處于絕經期,體內雌性激素分泌降低,最終導致骨的流失。目前臨床上常用雌激素類藥物治療及預防骨質疏松,然而此類藥物存在明顯的副作用,而且長期使用會增加子宮內膜癌和乳腺癌的發生風險〔5〕。植物雌激素是一類來源于植物的化合物,常以糖苷的形式存在植物中,在結構和功能上與甾體類激素相似,具有弱雌激素活性作用〔6,7〕。SDG與雌激素結構十分相似,相關研究認為其對雌激素依賴性疾病骨質疏松有預治作用〔8,9〕。因此用毒副作用小的天然植物替代雌激素藥物,對于治療骨質疏松成為新的療法。
本實驗結果說明SDG低濃度時能增進成骨細胞的活性,在高濃度時抑制其活性,與李高舜等〔10〕通過實驗所得結論基本一致。
新的骨質形成及鈣化的發生需要ALP的存在〔11〕。ALP活性代表了細胞分化的能力,ALP活性越高成骨細胞的分化能力越強。本研究中SDG培養液可以促進成骨細胞ALP的表達活性,說明低濃度時能增進成骨細胞的活性,與李高舜等〔10〕的實驗結果基本一致。
研究表明,OPG起到了防止骨質吸收發生的作用〔12〕。成骨細胞中存在著大量OPG,隨著成熟細胞分化成熟而相應的增加。因此OPG的表達可以反映成骨能力。本研究表明,中低濃度SDG能夠促進護骨素基因水平的表達,對成骨細胞的增殖有促進作用,高濃度時抑制其基因水平的表達〔13〕。
高濃度SDG可明顯地抑制成骨細胞增殖、成骨相關基因的表達及細胞伸展黏附,SDG濃度為10-7、10-6mol/L可促進細胞增殖、成骨相關基因的表達及細胞伸展黏附,提示合適濃度的SDG可能促進種植體的骨結合,提高種植成功率。

