基于麻味成分的頂壇花椒HPLC指紋圖譜研究
敖厚豫,李欣,余天華*,楊慶雄
(1.貴州師范大學 生命科學學院,貴陽 550001;2.貴州師范大學 喀斯特研究院 國家喀斯特石漠化防治 工程技術研究中心,貴陽 550001;3.貴州師范大學 化學與材料科學學院,貴陽 550001)
貴州頂壇花椒(Zanthoxylumplanispinumvar.dingtanensis)系蕓香科花椒屬植物竹葉花椒的一個變種[1],由于適宜生長在喀斯特干熱河谷地區,被選為貴州石漠化治理地區生態治理的重要經濟植物,特別是在以黔西南地區貞豐縣為中心的石漠化地區,種植面積超過5萬畝,產量穩定,已經成為當地重要的土特農產品,并通過了國家質檢總局地理標志產品保護的論證(DB52/T 542-2016)。頂壇花椒是一個區域性特有品種,它區別于花椒(Z.bungeanum)、青花椒(Z.schinifolium)、竹葉花椒(Z.armatum)等花椒市場上常見和分布地域廣的幾個主要品種,并由于具有“麻味重”、“香味濃”的特點,形成了較為獨特的特色產品,是在貴州省石漠化地區多年推廣后逐漸培育成的一個具備較大產量規模并形成地區特色產業的重要特色農產品。貴州省的石漠化地區目前正在進一步大規模推廣,已經成為“黔貨出山”的重要品種。
目前,按照林業行業標準(LY/T 1652-2005)、國標GB/T 30391-2019等,對花椒質量等級的分級,主要包括感官評價和理化指標評價,其中感官指標包括色澤、氣味、味道和果形特征等,理化指標包含揮發油含量、水分和固體雜質等,并無對花椒中最具特征的麻味物質的定性定量測定評價,對花椒的質量評價還缺乏整體性,難以反映其內在品質。關于不同花椒的麻味成分已有較多的報道[2-5],特別是通過對比不同植物來源花椒麻味成分組成分析發現,構成麻味成分的不飽和脂肪酸酰胺類組分可作為花椒來源的判斷依據和花椒品質評價的重要指標[6-9],紅花椒、青花椒、竹葉花椒等不同的花椒品種,具有不同的麻味成分構成指紋圖譜。基于花椒的麻味物質基礎,在一些花椒主產地,已經開始制訂定量測定麻味成分的地方標準[10],作為花椒產品質量的重要指標。
頂壇花椒中富含不飽和長鏈脂肪酸酰胺和黃酮等多種成分[11,12]。頂壇花椒的質量標準目前僅限于外形的判斷和產地的來源等初步方法,未能構建其合理有效的質量控制體系,作為名優特產產品的貴州頂壇花椒,亟需建立一種可以從特色風味物質基礎進行質量控制,并能特征性區別于其他花椒產品的有效方法,作為其地理標志產品的鑒別以及品牌的塑造的技術支撐。指紋圖譜是一種從整體上研究復雜物質體系的技術,在花椒品種識別中也有報道[13,14]。但頂壇花椒的識別模式和麻味組分的特征未見報道。本文通過收集地理標志產品保護范圍內和周邊地區的頂壇花椒產品,研究其基于麻味成分的HPLC指紋圖譜,同時對其中主要麻味成分的含量進行了測定,為貴州頂壇花椒質量評價提供了科學依據,支撐特色名優農產品的特征性標識和品牌保護。
1 材料
1.1 儀器與試劑
LC-MS 2020高效液相色譜-質譜儀(帶PDA檢測器) 日本島津公司;Sartorius BP211D電子天平 德國賽多利斯公司;KQ-300DE型數控超聲儀 昆山市超聲儀器有限公司;N-1000旋轉蒸發儀 上海埃朗公司;WND-500A型高速中藥粉碎機 浙江省蘭溪市偉能達電器有限公司;超純水機 美國Millipore公司;LGJ-20F冷凍干燥機 北京松源華興生物技術有限公司。
羥基-α-山椒素、羥基-β-山椒素、羥基-γ-山椒素、羥基-ε-山椒素、羥基-γ-異山椒素、γ-山椒素對照品(純度>98%):均購自成都麥德生中藥對照品有限公司;甲醇(色譜純):購自默克股份公司;其他試劑:均為分析純。
1.2 植物樣品
頂壇花椒樣品采集自以貴州省貞豐縣北盤江鎮、平街鄉、者相鎮、白層鎮4個鄉鎮現轄行政區域為中心的頂壇花椒地理標志產品保護地區范圍及其周邊地區擴大種植的鄉鎮,樣品標本統一收藏于貴州師范大學喀斯特研究院標本室,頂壇花椒植物樣品均由貴州師范大學楊慶雄教授統一鑒定。其他品種花椒購自國內其他花椒主產區。其中樣品S1~S15為當地采集后進行曬干處理得到,S16~S32為頂壇花椒采集后1 d內帶回實驗室冷凍干燥得到。不同批次花椒樣品信息見表1。

表1 不同批次花椒樣品信息Table 1 Information of different batches of Zanthoxylum bungeanum samples
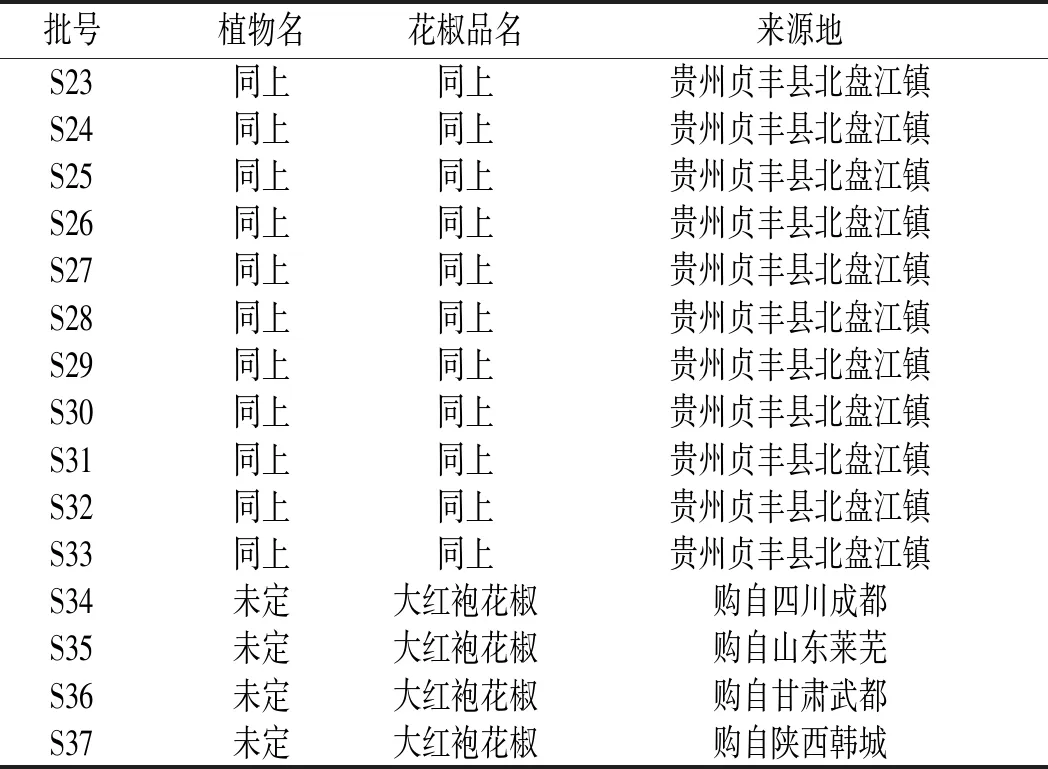
續 表
2 方法與結果
2.1 色譜條件
Phenomenex C18色譜柱(150 mm×4.6 mm,5 μm),流動相甲醇(A)-水(B),梯度洗脫(0~30 min,65%~80% A;30~40 min,80% A),流速0.7 mL/min,柱溫30 ℃,檢測波長270 nm,進樣體積5 μL。
共有峰的質譜數據由LC-MS 2020的單四極桿質譜儀采集得到,ESI離子源,正負離子模式同時采集,掃描分子量范圍200~800 m/z;質譜條件:甲醇-水為流動相梯度洗脫(A:水、B:甲醇,0~30 min:67%~80% B,30~45 min:80% B),洗脫流速0.5 mL/min,檢測波長270 nm,柱溫30 ℃;干燥N2流量15 L/min;接口溫度350 ℃,DL溫度250 ℃;加熱塊溫度400 ℃;接口電壓4.5 kV。
2.2 溶液制備
2.2.1 標準品溶液配制
分別精密稱取羥基-α-山椒素、羥基-β-山椒素、羥基-γ-山椒素、羥基-ε-山椒素、羥基-γ-異山椒素、γ-山椒素對照品適量,置于容量瓶中,加入色譜甲醇溶解并定容,得到濃度分別為6.733,7.333,7.133,6.853,8.000,6.667 μg/mL的混合對照品儲備液,于4 ℃保存備用。根據實驗需要,分別稱取不同體積的各標準品儲備液,稀釋得到不同濃度的混合標準品溶液。
2.2.2 供試品溶液的制備
稱取花椒粉末(過40目篩)約0.025 g,精密稱定,置于25 mL容量瓶中,加入甲醇至刻度,超聲30 min,冷卻至室溫后再定容,經0.22 μm的微孔濾膜過濾,即得。
2.3 指紋圖譜方法學考察
2.3.1 精密度考察
稱取花椒粉末(S1)約0.025 g,精密稱定,按2.2.2項下方法制備供試品溶液,按2.1項下色譜條件連續進樣6次,以羥基-α-山椒素為參照峰,計算各共有峰的相對保留時間和相對峰面積,各共有峰的相對保留時間的RSD<1.5%,相對峰面積的RSD<2.5%,表明儀器精密度良好。
2.3.2 重復性考察
稱取同一供試品溶液(S1)花椒粉末(S1)6份,每份約0.025 g,精密稱定,按2.2.2項下方法制備供試品溶液,按2.1項下色譜條件進行測定分析,以羥基-α-山椒素為參照峰,計算各共有峰的相對保留時間和相對峰面積,結果所有共有峰的相對保留時間的RSD<1.5%,相對峰面積的RSD均<3.0%,表明此方法重復性良好。
2.3.3 穩定性考察
稱取花椒粉末(S1)約0.025 g,精密稱定,按2.2.2項下方法制備供試品溶液,按2.1項下色譜條件分別于0,0.5,1.0,2.0,4.0,8.0 h測定峰面積,以羥基-α-山椒素為參照峰,計算各共有峰的相對保留時間和相對峰面積,結果所有共有峰的相對保留時間的RSD均<1.0%,相對峰面積的RSD均<3.0%,表明花椒供試品溶液在8 h內穩定。
2.4 含量測定
2.4.1 精密度試驗
精密吸取羥基-α-山椒素、羥基-β-山椒素、羥基-γ-山椒素、羥基-ε-山椒素、羥基-γ-異山椒素、γ-山椒素混合對照品溶液5 μL,連續進樣6次,測定峰面積,每個標準對照品峰面積的RSD均<1.5%,表明本方法精密度良好。
2.4.2 重復性試驗
分別稱取供試品(S1)6份,按2.2.2項下方法制備供試品溶液,按2.1項下色譜條件進行測定分析。供試品溶液中羥基-α-山椒素、羥基-β-山椒素、羥基-γ-山椒素、羥基-ε-山椒素、羥基-γ-異山椒素、γ-山椒素的峰面積RSD均<2.0%,表明該方法重復性良好。
2.4.3 穩定性試驗
稱取同一供試品溶液(S1),分別于0,0.5,1.0,2.0,4.0,8.0 h進行檢測,記錄指紋圖譜,供試品溶液中羥基-α-山椒素、羥基-β-山椒素、羥基-γ-山椒素、羥基-ε-山椒素、羥基-γ-異山椒素、γ-山椒素的峰面積RSD均<2.5%,表明供試品溶液在8 h內穩定性良好。
2.4.4 線性關系考察
分別精密吸取混合對照品儲備液0.5,1.25,2.5,4,5 mL于5 mL量瓶中,搖勻,即得系列混合對照品溶液。精密吸取系列對照品溶液5 μL,注入液相色譜儀,按2.1項下色譜條件依次進樣,記錄色譜峰面積。分別以峰面積為縱坐標(Y),對照品質量(對照品質量濃度×進樣體積)為橫坐標(X),繪制標準曲線。得到6種麻味素的工作曲線:羥基-α-山椒素為Y=16272000X+4234.5(R2=0.99993),線性范圍為0.673~134.6 μg/mL;羥基-β-山椒素為Y=12007600X+13597.5(R2=0.9993),線性范圍為0.733~146.6 μg/mL;羥基-γ-山椒素為Y=16972300X+5682.4(R2=0.99993),線性范圍為0.713~142.6 μg/mL;羥基-ε-山椒素為Y=6946540X-568.1(R2=0.99988),線性范圍為0.6853~137.06 μg/mL;羥基-γ-異山椒素為Y=17699900X+16504.3(R2=0.9996),線性范圍為0.8~160 μg/mL;γ-山椒素為Y=3646520X+658.9(R2=0.99991),線性范圍為0.67~134 μg/mL。結果表明,6種麻味成分在一定質量濃度范圍內呈良好的線性關系。
2.4.5 加樣回收試驗
精密稱取已測定含量的花椒樣品(S1)共6份,每份約0.1 g,精密稱定后,分別加入混合對照品溶液0.8,1,1.2 mL(其中羥基-α-山椒素、羥基-β-山椒素、羥基-γ-山椒素、羥基-ε-山椒素、羥基-γ-異山椒素、γ-山椒素的質量濃度分別685.3,673.3,733.3,713.3,800,666.7 μg/mL),每種加入量平行測定2份。按2.2.2項下方法制備供試品溶液,按2.1項下色譜條件進行測定,計算各組分的加樣回收率和RSD。羥基-ε-山椒素、羥基-α-山椒素、羥基-β-山椒素、羥基-γ-山椒素、羥基-γ-異山椒素、γ-山椒素的平均回收率分別為98.7%、110.7%、107.9%、111.62%、109.3%、99.82%。RSD均<3.0%,表明該方法準確度較好。
2.4.6 含量測定結果
對采集自貴州頂壇花椒地理標志產品保護范圍區域內的15批次(S1~S15)自然晾干的頂壇花椒樣品、17批次(S16~S32)冷凍干燥的頂壇花椒、新鮮頂壇花椒(S33)及購買自其他地方的花椒(S34~S37),粉碎過40目篩,精密稱定0.025 g,按2.2.2項下方法制備供試品溶液,按2.1項下色譜條件進行測定分析,采用外標法測定樣品中6種麻味成分的含量,測定結果見表2。
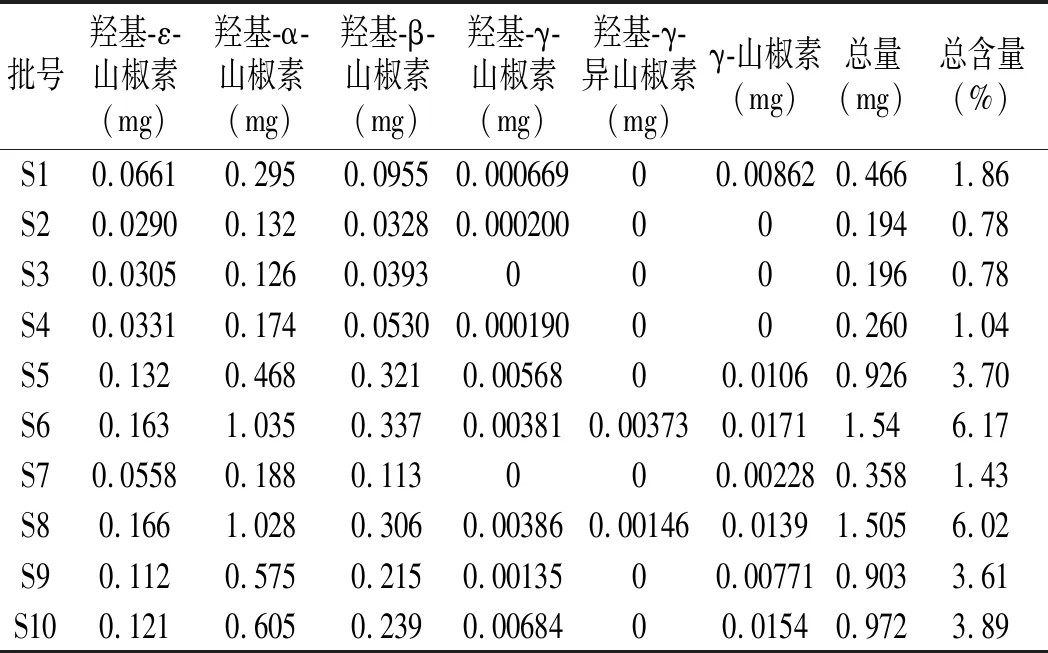
表2 不同批次花椒樣品(0.025 g)中 6種麻味素含量測定結果Table 2 The detection results of content of 6 kinds of numb-taste components in different batches of Zanthoxylum bungeanum samples (0.025 g)

續 表
由表2可知,頂壇花椒麻味組分的總含量各批次之間有波動,組成麻味的各個組分出現較強的規律。其中麻味強度大的γ-山椒素含量普遍偏低,含量最高的單組分為羥基-α-山椒素,其次為羥基-β-山椒素。通過冷凍干燥的方法得到頂壇花椒(S16~S32),其中γ-山椒素和羥基-α-山椒素的含量顯著高于曬干頂壇花椒(S1~S15),而羥基-β-山椒素的含量低于曬干產品。
2.5 聚類分析
2.5.1 基于HPLC圖譜共有峰的聚類分析
稱取花椒粉末(S1~S37)各約0.025 g,精密稱定,按2.2.2項下方法制備供試品溶液,按2.1項下色譜條件進樣,記錄各樣品色譜圖,見圖1。
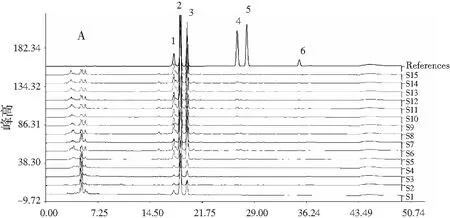

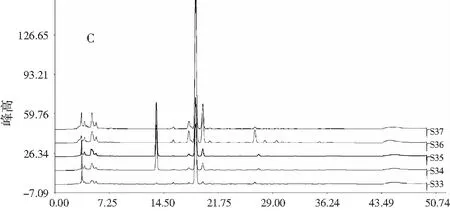
圖1 不同批次(A)曬干、(B)冷凍干燥頂壇花椒 和(C)其他花椒樣品的色譜圖對比Fig.1 The comparison of chromatograms of different batches of (A)sun-dried,(B)freeze-dried Z. planispinum var. dingtanensis and (C)the other Zanthoxylum bungeanum samples
注:references為混合麻味素對照品;1為羥基-ε-山椒素;2為羥基-α-山椒素;3為羥基-β-山椒素;4為羥基-γ-山椒素;5為羥基-γ-異山椒素;6為γ-山椒素。
由圖1可知,與花椒中常見的麻味混合對照品HPLC圖對比,并結合HPLC圖譜中主要色譜峰的UV光譜圖和質譜圖分子離子峰,花椒樣品的HPLC色譜圖中,保留時間在8 min以前的色譜峰均不是麻味素類成分,可能為花椒中的黃酮等酚類成分。出峰時間比γ-山椒素(tR=35 min)還長的位置已經未能明顯檢出麻味素組分。將不同批次的頂壇花椒樣品HPLC色譜圖導入“中藥色譜指紋圖譜相似度評價系統”(2004A版),并根據麻味組分的出峰時間進行溶劑峰(8 min)和尾峰(40 min)切除。以S1為參照圖譜,采用中位數法,時間寬度設定為0.10 min,多點校正后自動匹配,計算色譜峰匹配結果,選取37個樣品中匹配數大于30的色譜峰,以含量最高的羥基-α-山椒素(tR=18.7 min)做參照峰,計算其余色譜峰的相對峰面積。另外,考慮到S34、S35兩個樣品的色譜峰中出現了tR=13.5 min的典型色譜峰,與其他大部分樣品的色譜圖具有顯著性差異,故將該色譜峰也作為指標進行聚類分析。以這些匹配峰的相對峰面積作為變量,采用組間聯接法,以歐式距離的平方為測度,運用SPSS 20.0統計軟件進行聚類分析,見圖2。

圖2 37批花椒基于HPLC共有峰的聚類分析Fig.2 Cluster analysis of 37 batches of Zanthoxylum bungeanum based on the common peaks of HPLC spectra
由圖2可知,當類間距離為25時,37批花椒可以分為兩類:(S34、S35)為一類,其余為另一類;當類間距離為5時,則分為三大類:(S1~S15、S36、S37)、(S16~S33)和(S34、S35);當類間距離小于2時,(S1~S15、S36、S37)這個集合中的幾個樣本(5,7,11,15)又被單獨聚為一小類,區別于集合中其他樣本。
37個花椒樣品中,S34、S35兩者分別是購自四川和山東的紅花椒,S1~S15為自然曬干的頂壇花椒,S16~S32為冷凍干燥的頂壇花椒,S33為新鮮的頂壇花椒,S36、S37為分別購自甘肅和陜西的紅花椒。對比聚類分析后得到的各類典型HPLC色譜圖發現,(S34、S35)組的色譜圖與文獻中紅花椒的典型指紋圖譜基本相同,與其他所有樣品具有顯著性的差異,而S36、S37同樣作為紅花椒,卻在不同的分類層次中,曬干的頂壇花椒處于同一組。這個結果與S34、S35色譜圖中的tR=13.5 min特征峰有關,同時,由于購自市場上的紅花椒的植物來源無法明確鑒定,因而同為紅花椒的S36、S37與文獻中的竹葉花椒的指紋圖譜較為相似,甘肅和陜西為竹葉花椒的主產區之一,購自陜西和甘肅的S36、S37可能的植物來源與此有關。33批頂壇花椒樣品采集自相同的地理標志產品保護的區域,范圍相對比較集中,來源明確,所以色譜圖的差異較小。但從聚類結果看,干燥方法的差異將同樣來源于頂壇花椒的樣品分成了兩大類,其中冷凍干燥的頂壇花椒(S16~S32)的羥基-α-山椒素組分,在其色譜圖中表現為麻味成分的最主要組成,其他麻味素色譜峰占比很小。相較于曬干的頂壇花椒(S1~S15)比重更大,而后者中羥基-β-山椒素的比重顯著上升。在曬干組中,又進一步地分為兩個小組,有可能是由于曬干條件的差異導致了小的變化。
聚類分析結果提示,不同干燥方法對頂壇花椒的品質和風味特征具有顯著的影響。冷凍干燥花椒麻味組分的色譜圖與新鮮花椒(S33)的色譜圖更為接近。
2.5.2 基于麻味組分含量的聚類分析
根據2.4.6中得到的6種麻味素含量測定結果,以含量最高的羥基-α-山椒素作為參照,分別計算37批花椒樣品中的6種麻味素的相對含量。以6種麻味素的相對含量作為變量,采用組間聯接法,以歐式距離的平方為測度,運用SPSS 20.0統計軟件進行聚類分析,見圖3。

圖3 37批花椒基于麻味成分相對含量的聚類分析Fig.3 Cluster analysis of 37 batches of Zanthoxylum bungeanum based on the relative content of numb-taste components
由圖3可知,與以上的聚類分析結果類似,當類間距離為25時,37批花椒同樣被分成了兩類,但與2.5.1中的結果不同,S34、S35由于在測定過程中未考慮特征色譜峰(tR=13.5 min)對麻味成分的貢獻(為定量測定),使得兩者被并入了曬干頂壇花椒(S1~S15、S36、S37)這一大組中,說明這兩種花椒的不同麻味組分間的相對含量,在不包括特征峰的貢獻時,與曬干頂壇花椒樣品類似。改變類間距離后,曬干組頂壇花椒最后可以聚類為3個小組,與之前的聚類結果有一定的差距,可能是外標法含量測定結果計算的不同使組分間的相對含量與相對峰面積的數值有一定的差別。但冷凍干燥組和新鮮花椒(S16~S33)穩定地被聚為一大類,也提示溫和的冷凍干燥方法對頂壇花椒產品的品質控制有利。
兩種基于不同變量的聚類分析結果說明,頂壇花椒由于采集后干燥方法的差異,導致其中麻味成分的組成特征發生了較為顯著的變化。
2.6 頂壇花椒HPLC指紋圖譜的建立
2.6.1 頂壇花椒指紋圖譜測定
根據聚類分析結果,頂壇花椒樣品根據干燥方法的不同顯著地分成了兩組。這兩組間的特征,可以反映頂壇花椒產品的麻味組分的差異。從頂壇花椒最終產品的質量控制角度考慮,分別對這兩種類型的頂壇花椒產品建立指紋圖譜。
根據2.5.1中得到的HPLC色譜圖,將兩個批次頂壇花椒樣品分別導入“中藥色譜指紋圖譜相似度評價系統”(2004A版),并根據麻味組分的出峰時間進行溶劑峰起初和尾峰切除。以S1作為S1~S15、S16為S16~S32的參照圖譜,采用中位數法,時間寬度設定為0.10 min,多點校正,自動匹配生成指紋圖譜,見圖4。
曬干頂壇花椒(S1~S15)的共有模式對照指紋圖譜中,標定了7個麻味成分的共有峰(見圖4中A和表2),通過對比對照品的保留時間和質譜圖,分別鑒定出已知的麻味素羥基-ε-山椒素(峰2)、羥基-α-山椒素(峰4)、羥基-β-山椒素(峰5),共有峰3具有與羥基-ε-山椒素、羥基-α-山椒素和羥基-β-山椒素相同的分子量,則可以認為是這3個麻味素的另一個同分異構體。麻味強度最強的γ-山椒素在15批次曬干頂壇花椒樣品中含量低而且不穩定(見表1)[15]。冷凍干燥頂壇花椒(S16~S32)的共有模式對照指紋圖譜中,標定了6個麻味共有峰(見圖4中B和表2),鑒定出了羥基-ε-山椒素(峰1)、羥基-α-山椒素(峰2)、羥基-β-山椒素(峰3)、羥基-γ-山椒素(峰4)和γ-山椒素(峰6)5個已知麻味素。其中麻味最強的γ-山椒素作為共有峰出現,含量顯著大于曬干頂壇花椒(見表1)。羥基-α-山椒素在兩類頂壇花椒中都是含量最高的麻味素,但冷凍干燥的頂壇花椒中相對含量更大,而麻味強度較小的羥基-β-山椒素在曬干品中則變大。

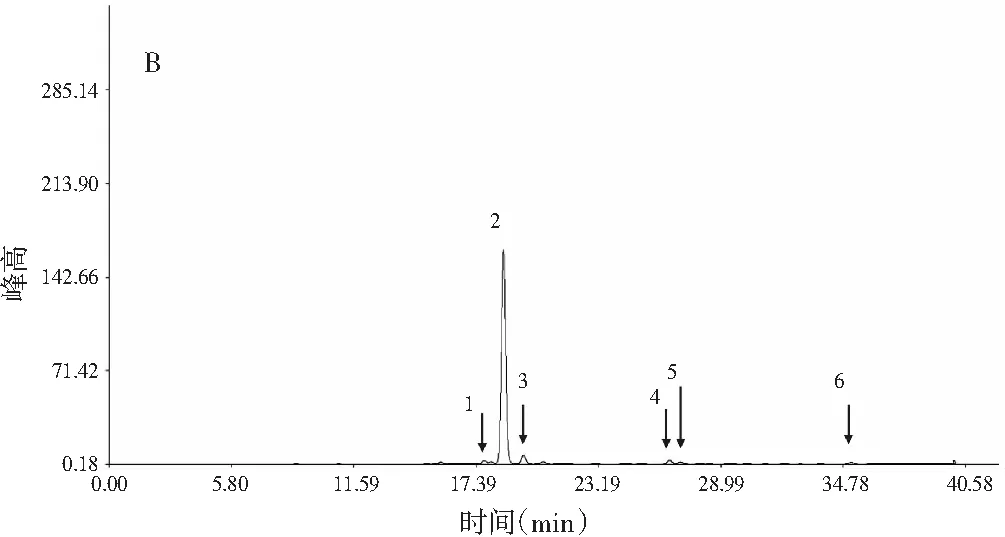
圖4 曬干(A)和冷凍干燥(B)頂壇花椒的HPLC共有峰模式Fig.4 HPLC common peak pattern of (A) sun-dried and (B) freeze-dried Z.planispinum var. dingtanensis
結果顯示:兩種干燥方法處理的頂壇花椒指紋圖譜,可以較為方便地表現出兩類頂壇花椒產品的不同麻味素相對組成特征。
2.6.2 相似度測定

表3 15批曬干頂壇花椒及17批凍干頂壇花椒的 共有峰的相對保留時間和相對峰面積Table 3 The relative retention time and relative peak areas of the common peaks of 15 batches of sun-dried Z. planispinum var. dingtanensis and 17 batches of freeze-dried Z. planispinum var. dingtanensis
由表3可知,曬干頂壇花椒供試品之間的相似度及其與對照指紋圖譜之間的相似度均大于0.98,而冷凍干燥花椒供試品之間的相似度及其與對照指紋圖譜之間的相似度均大于0.99(見表4和表5),說明根據相同干燥方法得到的頂壇花椒產品可以保持較高的穩定性。
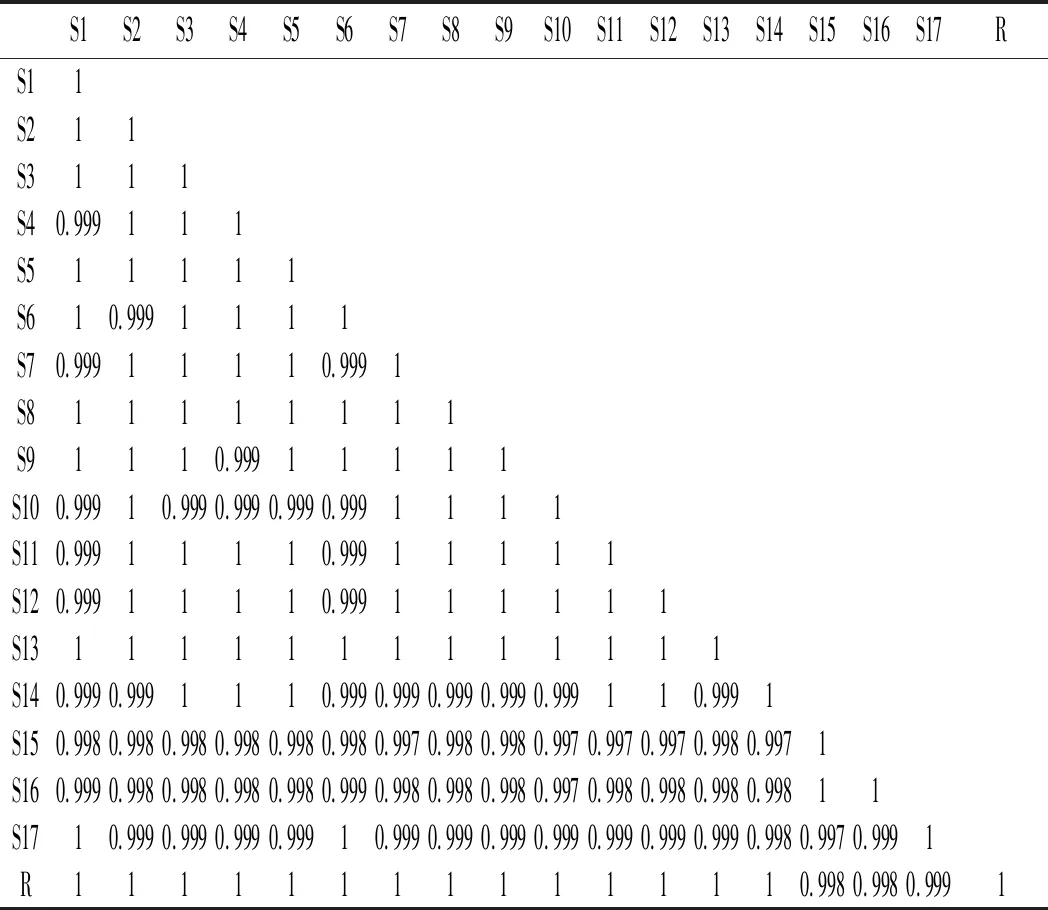
表5 17批次凍干頂壇花椒相似度計算結果Table 5 Simlilarity calculation results of 17 batches of freeze-dried Z.planispinum var. dingtanensis
3 討論
本研究首先確立了花椒中主要麻味素組分HPLC分離方法,色譜條件下,花椒中主要麻味成分的色譜峰分離度、基線和峰形都較好,色譜峰信息豐富,并通過紫外吸收和質譜結果進行了溶劑峰和尾峰切除,集中對比更能反映花椒風味特征的麻味組分。
基于共有峰(配對大部分的樣品)相對峰面積和6種麻味素相對含量作為變量的聚類分析,可以明確指出,頂壇花椒具有與其他來源花椒不同的麻味素組成特征,但與近緣種之間可能具有一定的相似性。更為重要的是,對花椒采集后以不同方法進行干燥,得到的花椒產品的麻味素組分表現出不一樣的特點,并可以據此區分出不同的產品類別。因而,本文在此基礎上完成了對不同處理方法得到的頂壇花椒指紋圖譜的研究。
37個批次花椒樣品的6個麻味素質量分數波動較大。與其他來源的花椒對比,頂壇花椒樣品的總麻味素含量總體呈現較高的水平。因為其他來源花椒的樣品數量太少,難以進行更全面對比,但也從側面說明頂壇花椒確實具備了麻味重的特色。
對兩種頂壇花椒產品指紋圖譜共有峰的結構確認結果指出,構成兩種產品的麻味組成成分大部分相同,但不同成分的相對含量有差別。由對照指紋譜圖可以看出,冷凍干燥的頂壇花椒與新鮮花椒的麻味組成基本一致,其中羥基-α-山椒素的含量明顯高于自然曬干花椒中的含量。33個批次的頂壇花椒麻味素含量測定結果也顯示,羥基-α-山椒素是大多數花椒的主要麻味成分,含量最高。冷凍干燥頂壇花椒不同批次樣品中,羥基-α-山椒素的相對含量測定也高于曬干頂壇花椒,但羥基-β-山椒素的相對含量明顯低于曬干品。頂壇花椒曬干或烘干過程中的光照(或加熱)導致的不飽和脂肪酸酰胺中順勢構型雙鍵轉變為熱力學更穩定的全反式結構,使得曬干頂壇花椒中羥基-α-山椒素比重下降,羥基-β-山椒素增加。花椒中極性較小的γ-山椒素的麻味強度最大,山椒素氧化后得到的極性較大的羥基-山椒素,麻味強度減弱,并且不同羥基-山椒素的麻味強度差異也較大,如羥基-α-山椒素的麻味強度閾值比羥基-β-山椒素低1倍以上。溫和的冷凍干燥處理方法,使得凍干頂壇花椒產品中麻味強度最大的γ-山椒素得以保留,并成為其指紋圖譜中的重要指標,這可能也是新鮮花椒或凍干花椒比曬干品麻味大的原理。
本研究提示了花椒生產中采用不同的干燥方法,可以影響其麻味素的組成特征。因而在花椒產品開發和生產中,需要關注麻味成分結構轉化和含量變化,如作為調味品的花椒產品,保持麻味更強的羥基-α-山椒素和γ-山椒素的含量,這將有利于保持頂壇花椒產品“麻味重、香味濃”的品質特征,則需要對新鮮花椒采摘后的干燥方法和過程進行合理控制。冷凍干燥方法可以得到與新鮮花椒產品類似的風味特征,但成本較高,曬干或烘干會導致高強度麻味組分含量的降低,但生產成本更低。同時,HPLC指紋圖譜不僅可以有效地區分不同干燥方法得到的頂壇花椒產品,作為產品質量控制的重要手段,同時基于頂壇花椒與其他植物來源花椒HPLC指紋圖譜共有峰特征的差異,還可以作為頂壇花椒地理標志產品的判別。

