薰衣草及其次生代謝產物的分子生物學研究概述
董世晨 侯一航 孫悅 任杏 苑澤寧
【摘 ? 要】 深入了解薰衣草分子生物學特性及其次生代謝產物分子生物學作用機理,有助于為培育薰衣草新品種和發揮薰衣草的功效提供理論參考。本文綜述了薰衣草功能基因、遺傳多樣性及遺傳轉化等研究進展,介紹了薰衣草次生代謝產物分子組成及其影響因素,次生代謝產物發揮主要功效的分子機制,為深入開展薰衣草理論和實踐研究提供參考和基礎。
【關鍵詞】 薰衣草;遺傳多樣性;遺傳轉化;次生代謝產物;分子生物學
中圖分類號:Q949.99 ? ? ? ? ? ? ?文獻識別碼:A ? ? ? ? ? ? ? 文章編號:2096-1073(2020)05-0056-60
[Abstract] ?An in-depth understanding of the molecular biological characteristics of lavender and the molecular biological mechanism of its secondary metabolites would be helpful to provide theoretical reference for the cultivation of new lavender species and the exertion of lavender's efficacy. This paper summarizes the research progress of the functional genes, genetic diversity and genetic transformation of lavender and introduces the molecular composition and influencing factors of secondary metabolites of lavender, and the molecular mechanism by which secondary metabolites exert their main effects. These results provide reference and basis for further theoretical and practical research of lavender.
[Key words] lavender; genetic diversity; genetic transformation; secondary metabolite; molecular biology
薰衣草享有芳香之王的美譽,為唇形科薰衣草屬(Lavandula)植物。自上世紀60年代引種以來,薰衣草在我國芳香產業發展中發揮著重要作用。但歷經幾十年的種植,薰衣草種群出現了品種混雜甚至退化的現象。薰衣草遺傳多樣性及遺傳轉化的研究有利于品種優化和培育,是薰衣草產業發展的重要基礎。同時,其次生代謝產物功效的研究是加深和拓寬應用的重要前提。本文對薰衣草分子遺傳學及其有效成分藥理機制等進行了概述,以期為薰衣草在理論和實踐上的深入研究提供參考。
1薰衣草分子遺傳學研究
1.1薰衣草功能基因的研究
1.1.1薰衣草細胞核細胞質功能基因的研究作為芳香植物,薰衣草細胞內與芳香物質合成相關的功能基因較受研究者的青睞,如趙鐘鑫等通過RT-PCR技術從闊葉薰衣草(Lavandula latifolia)葉片中克隆出芳樟醇合酶基因的cDNA序列,該序列全長為1809bp,編碼602個氨基酸。通過比較該基因與Lllis的蛋白質二級結構,發現二者在整體上基本一致,但Lllis多一個α螺旋,故將薰衣草的其命名為Lslis,其具有芳樟醇合成酶活性必需的DDXXD功能基因。通過分析芳樟醇合酶序列、預測蛋白質二級結構和構建植物表達載體,為轉基因表達的研究奠定了基礎[1]。張雪榮在狹葉薰衣草(L. officinalis)中也發現了芳樟醇合成酶基因家族的cDNA 序列,將其命名為 Llis,并構建了 Llis 的植物轉基因表達正義載體、植物轉基因表達反義載體、原核表達載體,有望通過轉基因技術,將克隆的香味植物關鍵酶基因轉入到其他植物里[2],為充分利用薰衣草特有的香味基因改良其它物種提供了新的思路。
采用重新構建葉綠體基因組技術,合成了狹葉薰衣草(L. angustifolia)葉綠體全基因組,其基因組共有132個基因,其中有88個蛋白編碼基因,8個核糖體RNA基因,37個轉運RNA基因。環狀葉綠體DNA大小為153,448bp,包含一對大小為25,632bp的反向重復序列(IR),一個較大的84,588bp大小的單拷貝序列(LSC)和一個較小的17,596bp大小的單拷貝序列(SSC)。根據葉綠體基因組成,經系統發育分析表明其與唇形科的Salvia miltiorrhiza具有較近的親緣關系。為深入研究L. angustifolia葉綠體基因組的進化奠定了基礎[3]。
1.1.2薰衣草DNA提取薰衣草DNA的獲得是進行基因結構研究的重要前提,任艷利等對CTAB法進行了改良,通過在提取液中分別適量添加β-巰基乙醇和聚乙烯基吡咯烷酮,獲得了L. pedunculata紫花薰衣草、藍花薰衣草和白花薰衣草3個品種的高質量DNA[4]。隨后,權俊萍等證明改良3×CTAB法是獲得少量的高質量薰衣草DNA的理想途徑[5]。郝俊蓉則采用RAPD技術提取薰衣草DNA,對其最佳反應體系進行分析,結合薰衣草DNA分子的多態性、植物學分類和化學成分分類,將薰衣草分為精油類和觀賞類。并采用RAPD技術分析了精油類和觀賞類薰衣草的遺傳差異性,總結出精油類薰衣草花期短、花序長,精油成分主要是芳樟醇、乙酸芳樟酯、1,8-桉葉油素。觀賞類花期長、花序短,精油成分以葑酮、樟腦、檸檬烯等為主,為薰衣草品種的選育、優化提供基礎和依據[6]。
1.2薰衣草遺傳多樣性及遺傳轉化
自二十世紀六十年代薰衣草引種到我國,在種植過程中,天然雜交、基因突變等導致新性狀的出現使薰衣草的遺傳背景復雜化。同時,種植區薰衣草品種(系)命名不規范,影響了薰衣草優良新品種的創制和選育。摸清薰衣草種質資源的遺傳多樣性,是有效開發利用薰衣草的重要基礎[7]。
1.2.1薰衣草遺傳多樣性RAPD和ISSR技術作為常用的DNA分子標記技術,可在DNA分子水平上反映出品種間的差異,能區分相近物種,檢測外型極為相似的不同變種、變型、品系、化學型乃至個體之間的細微差異,準確判斷品種間親緣關系。張艷玲利用RAPD分析孟士德薰衣草 (L. angustifolia‘Munstead)、英國薰衣草( L. angustifolia)等10個薰衣草品種DNA分子多態性,結果表明各品種間遺傳相似系數變化較大,多態性比率99.38%,說明薰衣草品種間具有較高的遺傳多樣性[8]。簡銘錦通過ISSR構建指紋圖譜,將薰衣草品種分為兩類群,一類群屬于齒葉薰衣草(Dentata)與狹葉薰衣草(Lavandula)組,另一類群屬于羽葉薰衣草(Pterostoechas)與法國薰衣草(Stoechas)組,這種分類方式與葉型分類相一致[9]。蘇秀娟等采用ISSR分析來自伊犁的19個品種(系)的薰衣草遺傳多樣性,結果表明新疆薰衣草種質資源具有較高的遺傳多樣性[10]。但是,郭麗丹等同樣采用ISSR分析來自新疆建設兵團第四師的45個薰衣草品種,發現遺傳多樣性較低,親緣關系較近[11]。上述結果表明,不同地區生長的薰衣草,遺傳基礎存在一定的差異,導致這種差異的因素有待深入研究。
此外,Garcia和Cervera 等報道薰衣草的遺傳多樣性還體現在染色體數目上,不同品種薰衣草的染色體數目變化較大,分別包含6、12、18、24、30、36、42、48、54條染色體[12,13]。狹葉薰衣草染色體數目的多態性表現為,細胞內的染色體可能包含36、48、50、54條[14]。對我國自主培育的新薰1號和新薰2號分析表明,新薰1號含有50條染色體,新薰2號則有48條,核型為4A型,進化程度較高[15]。黃珊珊對狹葉薰衣草(L. angustifolia)和羽葉薰衣草(L. pinnata)體細胞染色體分析表明,前者含有50條染色體,染色體組型為“2A”型,耐寒性較強,后者含有22條染色體,染色體組型為“2B”型,耐熱性較強,從染色體組型上分析羽葉薰衣草比狹葉薰衣草較為進化[16]。
1.2.2薰衣草遺傳轉化遺傳轉化是充分利用和改良種質資源的重要途徑。關于薰衣草遺傳轉化的研究,Dronne等在1999年用根癌農桿菌轉化薰衣草葉片,篩選出EHA105菌株轉化的植株達到最高轉化率9%,首次證明薰衣草遺傳轉化的可行性[17]。Nebauer等用含ntpII(新霉素磷酸轉移酶基因)和gusA基因的農桿菌菌株EHA105轉化寬葉薰衣草(L. latifolia)的子葉盤和下胚軸,獲得了抗β-葡萄糖醛酸酶活性和抗卡那霉素的抗性植株,證實gusA和nptII基因在轉化兩年后仍穩定表達[18]。國內外學者分別以薰衣草葉片和下胚軸為外植體,實現了較穩定的根癌農桿菌介導外源基因的薰衣草遺傳轉化[19,20]。
在獲得穩定高效的薰衣草遺傳轉化體系基礎上,我國學者為改良薰衣草性狀進行深入研究,以孟士德薰衣草(L. angustifolia, cv. Munstead)的下胚軸和葉片為外植體,將scp (雪蓮冷誘導蛋白)基因整合到薰衣草基因組中,陽性率分別為40%和35.3%,這為培育有抗寒基因的薰衣草品種,使薰衣草具有較強的耐寒性成為可能[21,22]。為提高薰衣草耐澇性,蘇秀娟等利用根癌農桿菌介導的薰衣草(L. angustifolia)葉盤轉化遺傳轉化,將vgb基因 (透明顫菌血紅蛋白)成功導入到薰衣草體內,這為利用轉基因技術改良薰衣草品種的實踐提供了范例[23]。
除采用遺傳轉化技術改良薰衣草外,太空誘變育種也是薰衣草種質資源創新的快捷有效途徑之一。如胡蓮花等在2004年播種了搭載太空船進行太空育種的法國真薰衣草品系的種子,自2007~2013年,經反復扦插、擴繁、選育,發現19 種變異體,表明薰衣草的基因型對太空環境誘變比較敏感,并發現薰衣草誘變體之間精油化學組分差異明顯,對精油主要化學組分進行了優化,使這種變異能夠穩定遺傳[24]。
2薰衣草次生代謝產物研究
2.1薰衣草次生代謝產物主要成分
2.1.1薰衣草次生代謝產物主要分子組成薰衣草次生代謝產物成分種類差異較大,通過GC-MS(氣相色譜—質譜聯用)分析云南薰衣草(Lavender)揮發油含有芳樟醇、乙酸芳樟酯、乙酸薰衣草酯、樟腦等近40種化合物,其典型性在于揮發油中的氧化芳樟醇含量很高,約占66.83%,這是與其他薰衣草的主要區別[25]。陳行烈等用GC-MS法從新疆伊犁薰衣草油中檢測出了27 種化學成分,并用同樣的方法測定出維吾爾醫用印度薰衣草精油中檢測出了36種化學成分[26]。劉勇民在《維吾爾藥志》中明確列出了薰衣草油的21種化學成分[27]。
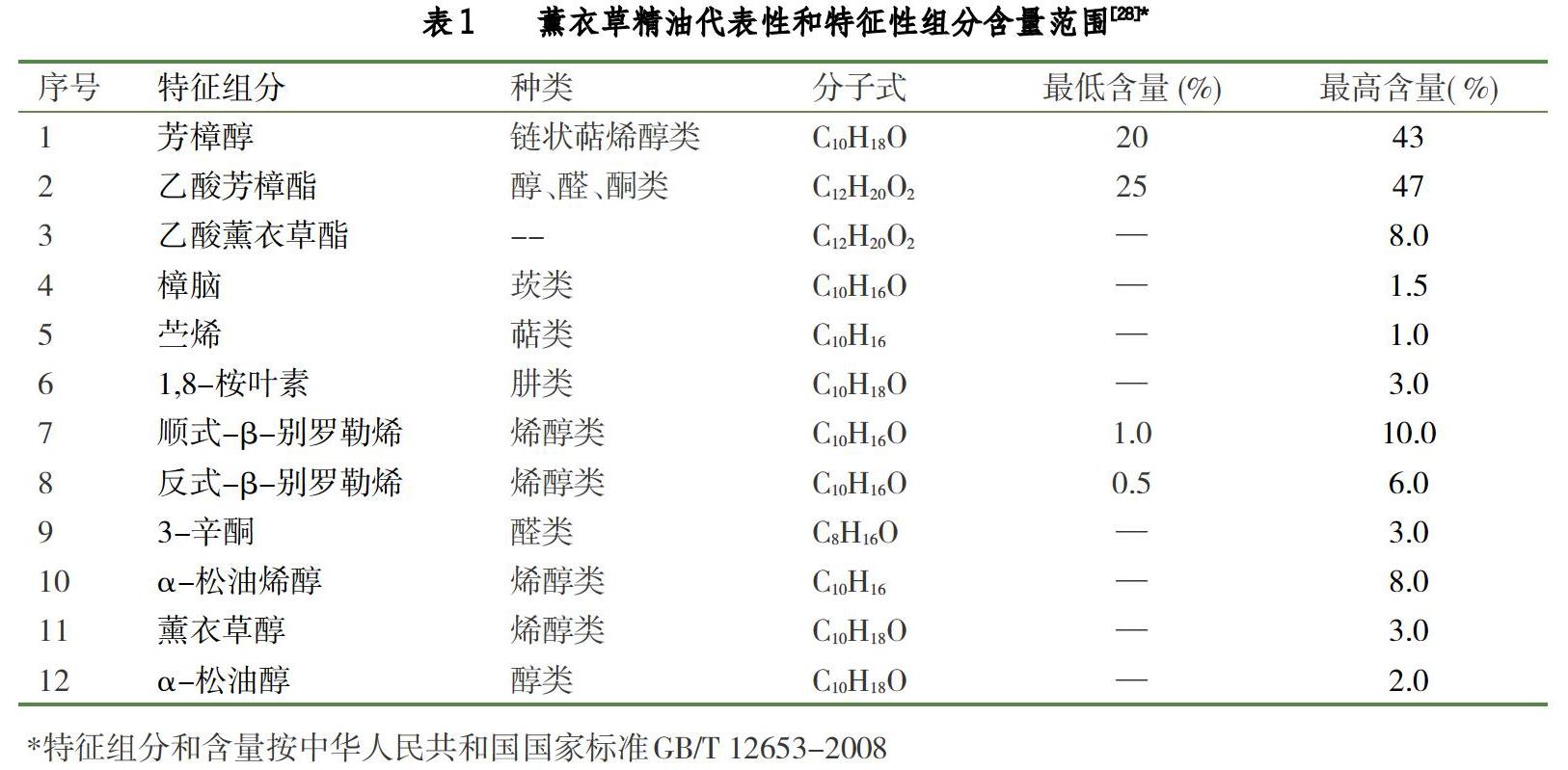
根據中國國家標準[28],從薰衣草(L. angustifolia Mill.)開花部分提取的精油,采用氣相色譜—歸一化法分析,代表性和特征性組分含量范圍如表1所示。
2.1.2影響薰衣草次生代謝產物的主要因素生長不同的地區同一品種薰衣草次生代謝產物成分存在很大差異,如佳木斯地區薰衣草(L. angustifolia Mill.)精油中乙酸薰衣草酯、薰衣草醇、香葉醇、橙花醇、龍腦、反式石竹烯、反式金合歡烯的含量高于伊犁薰衣草(L.ottleinalis Chax)精油含量,這可能與東北特有的肥沃黑土土質有關[29,30]。此外,薰衣草次生代謝產物成分還與外源施用氮肥和磷肥等有關,當氮的濃度介于150mg~250mg/L、磷的濃度介于30 mg~70 mg/L時,薰衣草(L. angustifolia Mill.)精油產量表現差異不顯著,但隨著氮和磷濃度的變化,精油化學成分的含量有所變化,如α-萜品醇、α-沒藥醇、β-蒎烯、1-8桉樹腦的含量隨著氮、磷濃度的升高而升高,樟腦的含量卻隨著氮、磷濃度的升高而降低[31,32]。
利用體外微型繁殖得到的薰衣草,精油主要成分為芳樟醇(22.1%)、乙酸薰衣草酯(15.3 % )和乙酸芳樟酯(14.7 %),這三種物質是薰衣草的主要有效成分(表1)。而田間生長的薰衣草精油主要成分是T - cadnol (16.9~9.3 % )、冰片( 8.7~4.0 % )和3 -蒈烯( 8.7-8.6 % )。產生這些差異的主要原因是田間生長的植物受到環境、氣候等因子的影響,同時也說明通過植物微繁技術可以大大提高薰衣草有效成分的收得率,為工業化開發提供了新思路和途徑[33]。此外,薰衣草花瓣的含水量對含油率產生很大影響,薰衣草新鮮花瓣含油率約0.8%左右,干燥花瓣含油率約1.5%[34]。薰衣草的品種與花期對精油品質的影響較大,采收時段對油品質影響較小,為確定不同薰衣草品種采收期和薰衣草選育新品種工作提供了科學依據[35]。
2.2薰衣草次生代謝產物功效
薰衣草次生代謝產物藥理作用主要體現在抗腫瘤、益智、抑菌驅蟲、抗氧化、安神、抗焦慮等方面。
2.2.1抗腫瘤作用研究表明薰衣草提取物對人的肝癌細胞、肺癌細胞和鼻咽癌細胞均有遏制作用。其中,對人的鼻咽癌細胞生長的抑制率最高可達到98%以上。對比環磷酰胺和薰衣草提取物對實體瘤生長的影響,發現薰衣草的最大抑瘤率可達42.6 %,無明顯副作用。薰衣草有效成分可誘導產生TNF-α、IL-6等細胞因子,進而誘導腫瘤細胞的壞死或凋亡,也可抑制或減少腫瘤組織新生血管的生成[36]。薰衣草可通過提高機體免疫功能而發揮其抗腫瘤作用[37],但薰衣草抑制腫瘤細胞生長的分子機制有待探究[38,39]。
2.2.2益智功效在薰衣草益智方面的作用,通過薰衣草活性成分對阿爾茨海默病認知障礙改善作用得以證實。薰衣草有效成分具有明顯的神經保護及益智作用,其中芳樟醇能明顯改善小鼠認知障礙,且精油中除芳樟醇外的其他益智活性成分也發揮作用。薰衣草中益智活性物質對神經保護作用與其抗氧化、抗細胞凋亡、增強神經可塑性、改善膽堿能神經系統活性相關。如芳樟醇通過激活PI3K/Akt-Nrf2-HO-l通路(磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)/核因子E2相關因子2(Nrf2)信號通路)來發揮抗氧化保護細胞的作用。進一步研究表明,薰衣草精油益智藥效濃度不會使小鼠產生劑量依賴性,表明用藥的安全性。基于薰衣草對改善阿爾茨海默病認知障礙表現出的潛力,有望將薰衣草開發為有效、安全的阿爾茨海默病防治藥物[40]。
2.2.3抑菌作用薰衣草葉精油成分體外抗血吸蟲作用和細胞毒性的研究表明,200 μg/ml薰衣草精油處理24h后,殺死全部供試成年曼氏血吸蟲,其中,LC50(半致死)的濃度和時間分別為117.7μg/ml處理24 h,103.9 μg/ml處理120h。對曼氏血吸蟲生殖產生影響的濃度和時間分別為濃度為25μg/ml處理120h,50 μg/ml 處理24h,可將成對的曼氏血吸蟲分離,進而影響其繁殖。50 μg/ml的精油濃度對蟲卵的發育產生抑制作用,使血吸蟲運動活性顯著降低。試驗表明,薰衣草精油對血吸蟲成蟲和蟲卵均具有一定的細胞毒性[41]。薰衣草的抑菌作用體現在芳樟醇類物質,芳樟醇具有抗大腸桿菌、葡萄球菌、黃曲霉菌、除臭等功效。薰衣草精油還可以抑制白念珠菌的活性,最佳抑制濃度有待深究,且其他抑菌實驗也有待研究[42]。薰衣草莖、葉提取物對植物病原真菌有明顯的抑制作用,其有效成分最小抑菌濃度低于百菌清和丁香酚的抑菌濃度。因此,薰衣草抗菌活性成分能高效抑制植物病原菌,為開發替代高毒、易殘留農藥的植物型抗菌劑奠定了科學基礎[43]。
2.2.4抗氧化作用經DPPH法和FRAP法測定,薰衣草的提取物具有高抗氧化活性,與提取物中多酚和黃酮含量高于其他香料植物密切相關[44]。薰衣草抗氧化活性可能會介導抗損傷作用,如薰衣草精油對缺血再灌注所致腦組織損傷具有保護作用[45-47]。薰衣草中的抗氧化物質還能增強人臍帶系膜干細胞再生能力,可用于治療脊髓損傷后的神經再生[48]。
2.2.5抗焦慮及降壓作用薰衣草氣味可降低牙科焦慮患者的焦慮情況,對非焦慮患者無影響[49]。薰衣草香氣味能夠改善急性胰腺炎患者焦慮、抑郁等負面情緒,提高護理滿意度,建議在臨床上推廣應用[50]。薰衣草氣味還可使原發性失眠患者的失眠情況得到改善[51]。
薰衣草精油可以使高血壓患者MAP(平均動脈壓)降低,其原理是通過嗅覺通路使血漿中 ALD、AngⅡ、PRA和NE的濃度下降,當薰衣草精油的濃度為1%時效果較明顯,對心率沒有影響,且作用時間久[52]。
3展望
作為名貴天然香料植物,薰衣草被引種到我國有近七十年的歷史,隨著薰衣草抗氧化、抗自由基理論的深入研究,天然、高效、低毒的薰衣草提取物的理化作用備受關注,開發芳香植物的特有價值成為研究的熱點[53]。但由于國內某些品種的薰衣草精油的特征性組分和有效成份含量存在的差異含量,與國家現行的標準有差異,限制了其種植推廣,這種差異決定了它們產品價值和市場競爭 力。因此制定新的薰衣草精油行業標準和進行薰衣草行業的規范是全面發展的基礎[54]。
薰衣草活性成分藥理作用的研究為醫藥行業深入開發利用薰衣草提供了科學依據,同時提取物及其單體化合物在抗腫瘤、神經保護等方面的作用機制還有待于突破。國內對于食品安全和健康的關注,使得薰衣草提取物走進人們的視野,未來有望在食品行業,康養領域的廣泛應用。
參考文獻:
[1] 趙鐘鑫,王健,李琴,等. 闊葉薰衣草芳樟醇合成酶基因的克隆與表達載體構建[J]. 植物研究,2013,33(3):308-316.
[2] 張雪榮. 薰衣草芳樟醇合成酶的基因克隆、功能鑒定及轉基因技術的研究[D]. 內蒙古農業大學, 2007.
[3] Lan Ma. The complete chloroplast genome sequence of the fra-grant plant Lavandula angustifolia (Lamiaceae) [J]. Mitochondrial?DNA Part B Resources, 2017,3(1): 135-136
[4] 任艷利,臘萍,張相峰,等. 改良CTAB法提取薰衣草基因組DNA研究[J].安徽農業科學,2011,39(22):13292-13293.
[5] 權俊萍, 賈曉鷹, 戴麗娜,等. 薰衣草高質量DNA提取及ISSR-PCR多重化體系的建立[J]. 生物技術通報,2012,5:151-157.
[6] 郝俊蓉. 精油類和觀賞類薰衣草的植物學性狀和精油成分對比研究[D].新疆農業大學,2006.
[7] 張曉燕. 金昌薰衣草的提取工藝研究2017,40(2):80-81
[8] 張艷玲,郝俊蓉,姚雷. 薰衣草親緣關系的RAPD分析[J].上海交通大學學報:農業科學版,2007,25(6):578-582.
[9] 簡銘錦. 利用ISSR及細胞質DNA標志探討薰衣草品種之遺傳歧異性[D]. 臺灣大學, 2004.
[10] 蘇秀娟,代培紅,湯秋香,等.新疆薰衣草種質資源遺傳多樣性的ISSR分析[J].分子植物育種,2015,13(05):1130-1134.
[11] 郭丹麗,李敏,王自健,等. 基于ISSR標記的新疆伊犁薰衣草品種資源的遺傳多樣性分析[J].新疆農業科學,2016,53(04):716-720.
[12] Garcia, J. Contribuyo para o estudo cário-siste, mático dogenero Lavandula L [J]. Bo.l Soc. Brot. 1942,13: 183-193.
[13] Suárez-Cervera, M. Aportación a la cariología del género?Lavandula L[J]. Anales del Jardín Botánico de Madrid, 1986,42(2):389-394.
[14] Uhrikova, A., Ferakova, V. and Schwhrzova, T. IOPB Chromo-some Number Reports LXXX [J]. Taxon,1983, 32:504-511.
[15] 蘇秀娟,湯秋香,邱娟,等. 新薰1號和新薰2號薰衣草核型分析[J].新疆農業大學學報,2015,38(03):212-215.
[16] 黃珊珊,廖景平. 狹葉薰衣草與羽葉薰衣草核型分析[J].園藝學報,2007,03:735-738.
[17] Dronne Sandrine, Moja Sandrine, Jullien Frédéric, et al.?Agrobacterium-mediated transformation of lavandin (Lavandu-lax intermedia Emeric ex Loiseleur) [J]. Transgenic Research,1999, 8(5):335-347.
[18] Sergio G. Nebauer, Isabel Arrillaga, Lucas del Castillo Agudo,?et al. Agrobacterium tumefaciens-mediated transformation of??the aromatic shrub Lavandula latifolia [J]. Molecular Breeding,2000, 6(6): 539-552.
[19] Jesus Mu?oz-Bertomeu, Isabel Arrillaga, Roc Ros, et al. Up--Regulation of 1-Deoxy-d-Xylulose-5-Phosphate SynthaseEnhances Production of Essential Oils in Transgenic Spike Lav-ender [J]. Plant Physiology, 2006, 142(3): 890-900.
[20] 邢文超,贠強,趙民安,等.薰衣草基因轉化直接分化受體系統的建立[J].干旱區研究,2007,01:23-27.
[21] 邢文超,贠強,趙民安,等. 根癌農桿菌介導的雪蓮冷誘導蛋白基因對薰衣草遺傳轉化的初步研究[J]. 植物生理學報,2006,42(5):862-866.
[22] 程娜. 農桿菌介導薰衣草轉化體系的建立與冷誘導基因的導入[D]. 安徽農業大學, 2007.
[23] 蘇秀娟,王莉萍,代培紅,等. 英國薰衣草葉盤遺傳轉化體系的創建[J].新疆農業科學,2015,52(03):517-522.
[24] 胡蓮花,李敏,劉兵,等. 太空誘變薰衣草精油成分分析鑒定[J].安徽農業科學,2014,42(14):4211-4212.
[25] 張春玲, 趙繼飚, 張朝英,等. 用GC/MS分析云南薰衣草(Lav-ender)揮發油的化學成分[J]. 河南科學,1999,4:388-391.
[26] 陳行烈,翟建軍. 新疆薰衣草精油化學成分的研究[J]. 新疆大學學報自然科學版,1991,4:81-84.
[27] 劉勇民. 維吾爾藥志 [M]. 新疆科技衛生出版社,1999.
[28] 中華人民共和國國家標準中國薰衣草(精)油,2008.
[29] 廖禎妮.不同地區薰衣草引種與耐濕熱研究 [D]. 湖南農業大學,2014.
[30] 王仲,高宇,高洪福,等.不同產地薰衣草花中精油化學成分分析[J].北方園藝,2017,06:140-143.

