注重概念建構融合科學史實的教學設計
顧曄


摘要:“氧化還原反應”是高中化學階段具有重要學科價值的基本概念之一,其概念的進階不僅是對學生原有知識的發展和完善,也體現了科學知識是變化的這一科學本質觀。本設計選擇國內外相關科學史實,引導學生從不同層次建構氧化還原反應概念,并在S7SE的情境下應用氧化還原反應的相關概念解決實際問題。
關鍵詞:氧化還原反應,概念模型,科學史,科學本質,STSE
文章編號:1008-0546(2020)05-0007-04 中圖分類號:G632.41 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2020.05.002
“氧化還原反應”是高中化學重要的基本概念之一,從不同角度對化學反應進行分類、進一步理解物質的轉化、應用化學基本概念解決實際問題等具有重要的學科價值。目前“氧化還原反應”的教學設計有以下模式:(1)將概念轉變成學習工具,運用氧化還原反應知識解決實際問題;(2)選擇合適的實驗情境,基于實驗探究的概念原理教學;(3)基于學習任務分析和學情的教學設計;(4)通過生活場景再現創設問題情境等。以上設計均考慮到情境設置的重要性,本設計嘗試選取科學史實和STSE素材進行情境創設,幫助學生從不同角度建構氧化還原反應概念,在此基礎上加深對概念的理解并進行合理的應用。
一、課程標準摘錄和分析
1.內容標準分析
在九年級《化學》從“得失氧”角度分析“氧化反應”和“還原反應”的基礎上,《普通高中化學課程標準》在教學內容上提出了三個新的要求:(1)認識有化合價變化的反應是氧化還原反應;(2)了解氧化還原反應的本質是電子的轉移;(3)知道常見的氧化劑和還原劑。這三個內容符合氧化還原反應概念發展的規律,體現了科學本質中科學知識有其持久性的同時還具有暫時性,所以在高中階段氧化還原反應的新授課中將新增概念與原有概念有機地融合是授課準備的核心,也是大多科學概念建構的常見模式。
2.教學提示分析
《普通高中化學課程標準》在“教學策略”部分強調了學生學完氧化還原反應后能解決怎樣的問題,即利用氧化還原反應指導元素化合物的學習;從氧化還原反應角度分析生產和生活實際中的真實問題。
這兩點對問題情境的選擇和設計提出了較高要求,一方面離學生現有知識水平不能太遠,另一方面要注意問題的真實性;“學習活動建議”中提到的“氧化還原反應本質的探究”本設計擬以鋅銅原電池的演示實驗為探究素材;“情境素材建議”提到的“氧化還原理論建立的史料”一方面要符合氧化還原反應的發展歷程,同時也要注意中西方科學發展史的結合(畢竟我國古代的冶金工藝在一定時間內也是處于領先地位的,而冶金工藝是離不開氧化還原反應的);“日常生活中的氧化還原反應”則可以借助合適的STSE素材,進行真實情境下問題解決的設計,本設計選取了“汽車發動機廢氣經過三元催化器前后的變化”和“含六價鉻廢水的處理”兩個素材。
3.學業要求分析
《普通高中化學課程標準》在本內容的“學業要求”部分首先要求“學生學完氧化還原反應后能從新的角度對常見的反應進行分類和分析說明”,從“得失氧”到“化合價升降”的概念進階可以順利解決類似問題;“能從元素價態的角度,依據氧化還原反應原理預測物質的化學性質和變化”是應用層面的要求,本設計中“如何將發動機廢氣中的氮氧化物(NOx)轉化為無污染的氮氣”與此要求是一致的;最后從電影《永不妥協》中提取的STSE素材則對應了“能有意識運用所學的知識或尋求相關證據參與社會性議題的討論(如酸雨和霧霾防治、水體保護、食品安全等)”的學業要求。
當然,以上學業要求的達成不是一蹴而就的,雖然本節課均有涉及,但從認知層次上還是要有所區分的,例如同樣是含鉻廢水的處理,第2問定量分析的要求可以視學生的基礎考慮是否采用,但從離子反應進行分析對大部分高一學生而言就顯得要求過高了。
二、學習者分析
“氧化還原反應”位于高一化學必修1模塊第二章第三節,在此之前學生完成了化學實驗、物質分類及離子反應等相關知識的學習(對于目前使用新課標舊教材的學生群體),另外學生在初中的已有基礎上已經能從得失氧角度對“氧化反應”和“還原反應”分別進行分析,較熟悉的反應有可燃物的燃燒、氧化銅在一定條件下被還原、水煤氣的產生等。考慮到學生已有認知水平和科學概念發展的規律,本節課學生概念的建構任務有以下3個:
(1)得氧和失氧是同時發生的,即氧化反應發生的同時還原反應也發生了;
(2)得失氧判斷氧化還原反應的方法在沒有氧元素參與時受到限制,即進階到從化合價角度分析氧化還原反應:
(3)化合價變化的內因何在呢?從得失電子角度分析氧化還原反應。
三、教學目標
1.通過化學史實的呈現和分析,了解氧化還原反應的宏觀特征和微觀本質;
2.通過典型氧化還原反應的類比分析,掌握氧化劑和還原劑在反應中的行為;
3.通過電化學演示實驗和對典型氧化還原反應的化合價升降分析,發現氧化還原反應中電子得失守恒關系。
四、教學過程
1.引入環節
我國古代有著先進的金屬冶煉的技術,以“濕法煉銅”為例:
史料1:濕法煉銅
西漢劉安所著《淮南萬畢術》中記載有“曾青得到鐵則化為銅”。
明代宋應星著《天工開物》記載了膽水浸銅法(圖1):膽水浸銅是指直接將天然膽水引入人工建造的溝槽中,浸泡鐵片。
2.建構概念模型:氧化還原反應的概念
[學習任務1]從得失氧角度和化合價升降認識氧化還原反應
a.分析反應(1)中反應物的得氧和失氧情況,概括反應前后相關物質“得失氧”的情況。
b.分析反應物(1)、(2)化合價變化,概括反應前后相關元素“化合價升降”的情況。
[設計意圖]選取學生熟悉的兩個反應,體會從“得失氧”角度和“化合價升降”角度認識氧化還原反應的兩種方法,比較二者的使用范圍。
史料2:電化學的發展和電子的發現
1836年,英國科學家丹尼爾對“伏打電池”進行了改良,制造了一個能穩定工作的銅鋅原電池,稱為丹尼爾電池。
1897年約瑟夫·約翰·湯姆遜根據放電管中的陰極射線在電磁場和磁場作用下的軌跡確定陰極射線中的粒子帶負電,并測出其荷質比,這在一定意義上是歷史上第一次發現電子。
演示實驗:演示鋅銅原電池(簡化的丹尼爾電池)工作時電流表指針的轉動。
[學習任務2]從電子轉移角度認識氧化還原反應
學生:觀察實驗,分析反應(1)和反應(2)中的電子轉移情況。
(1)概括反應前后相關物質“電子得失”的情況并填人表3。
(2)你如何看待同一個氧化還原反應中“得失氧”“化合價升降”和“電子的轉移”這三者直接的關系?如果撤去電流表,反應中還存在電子的轉移嗎?
[設計意圖]利用“丹尼爾電池”“湯姆遜發現電子”兩則科學史材料和簡單鋅銅原電池的演示實驗,幫助學生從宏觀現象逐漸深入到反應的微觀本質,逐步認識一個氧化還原反應化合價升降背后的“實質”——電子的轉移,這也與氧化還原反應概念的發展史是一致的。
史料3:氧化還原反應概念發展(表4)。
[設計意圖]從得失氧、化合價升降和電子轉移角度認識氧化還原反應的歷程也是科學發展的歷程,通過表1的總結一方面呈現讓學生認知與科學發展史的一致性,另一方面認識到每一種認知角度都是與當時的理論發展是一致的,而不是簡單的“對”或者“錯”。
[學習任務3]認識氧化劑和還原劑,體會它們在氧化還原反應中的作用。
學生:分析H2和單質鐵在反應(1)和反應(2)這兩個反應中的作用。
(1)歸納H2和單質鐵反應前后化合價變化情況。
(2)概括氧化劑、還原劑在反應中的變化特點,填入下表.
[設計意圖]氧化劑和還原劑的判斷本身不是目的,更不是為了迷惑學生而出現的概念,所以起始階段應該單一些簡單的、學生不易迷惑例子幫助學生歸納氧化劑和還原劑在反應前后的變化特征,為后面的應用打下基礎。
[學習任務4]電子得失守恒的驗證
已知:反應(3)、(4)可以用于鐵、鈦的制取:學生:判斷反應的氧化劑和還原劑,并從化合價升降和電子得失角度分析反應(3)、(4),歸納反應前后氧化劑得到的電子數與還原劑失去的電子數有何關系。
[設計意圖]由化合價升降數目相等過渡到電子得失守恒,為在真實情境中運用電子守恒解決實際問題做好準備。
3.應用概念:STSE情境下的問題解決
STSE素材1:三元催化器中的主要反應。
汽車尾氣排放前需經過“三元催化器”(圖2)。三元催化器是凈化汽車發動機排放氣體的重要裝置,其內部存在鉑、銠、鈀等貴金屬,它們可以促使發動機室排出的碳氫化合物(CxHy)、CO及氮氧化物(NOx)轉化為對環境幾乎不產生危害的氣體。
(1)氮氧化物(NOx)是造成硝酸型酸雨的源頭之一,包括NO、NOx等,結合素材1猜想氮氧化物經過三元催化器后的產物。
(2)要想獲得這種產物,氮元素化合價如何變化,與具有____性的物質反應比較合適?
(3)反應2CO+2NO向→N2+2CO2(反應條件略去)中的還原劑是___。
(4)完成反應方程式:CO+NO2→……(反應條件略去),和同伴交流你是如何分析反應產物、如何配平的。
STSE素材2:電影《永不妥協》——與六價鉻的斗爭
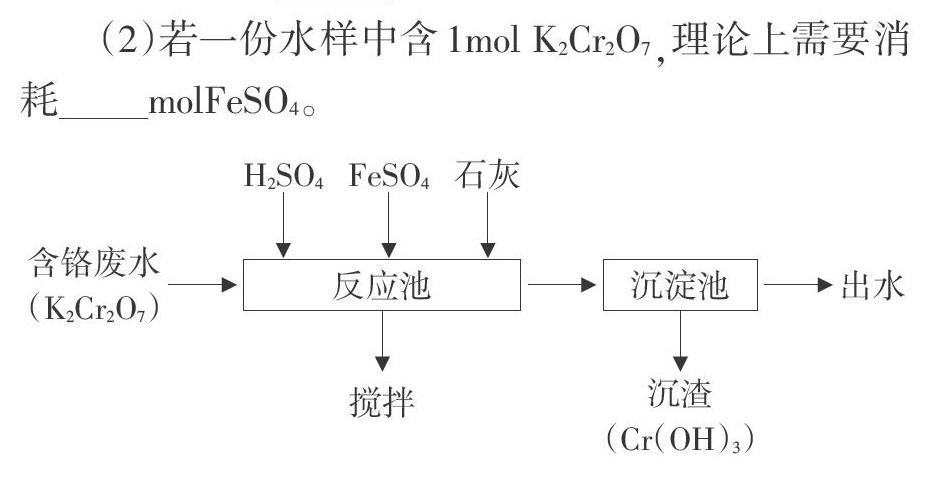
女主角埃琳(茱莉亞羅伯茨飾)在一堆有關資產和債務的文件中很偶然地發現了當地社區隱藏著的重大環境污染事件,一處非法排放的有毒污水(含六價鉻)正在損害居民的健康,是造成一種致命疾病的根源。
廢水在反應池中用硫酸調至酸性,投加FeSO4溶液,使六價鉻還原為三價鉻,然后投加石灰乳,其基本工藝流程如圖3,試分析:
(1)FeSO4使六價鉻還原為三價鉻的過程中做為還原劑,依據是____;
(2)若一份水樣中含lmol K2Cr2O7,理論上需要消耗____molFeSO4。
[設計意圖]關注與化學有關的社會熱點問題,應用氧化還原反應基本概念解決實際問題,在此過程中認識環境保護(大氣污染和水污染的綜合治理)的重要性,培養學生的“綠色化學”觀念和“可持續發展”意識。
五、教學反思
1.挑選怎樣的化學史實——為概念模型建構服務
科學史與兒童心理發展的相似性與連續性可以從科學教育的實證研究中尋找證據,有學者指出學生有很多概念與科學史是相平行的,科學史不僅幫助我們了解科學概念產生的情境,也可提供我們對于科學概念學習順序的判斷。從科學的本質理解氧化還原反應,不應該簡單地將之定義為某一個確定的概念,而應該結合科學史中的相關素材讓學生看到氧化還原反應的概念也是逐步發展的。
本設計首先選擇學生熟悉的氫氣還原氧化銅和濕法煉銅兩個反應為主要對象進行氧化還原反應概念的建構,從得失氧的同時發生到化合價的有升有降,實現了概念的第一次跨越;再利用丹尼爾電池和湯姆生發現電子兩則科學史素材,讓學生了解化合價升降表象下面的實質——電子的轉移,實現了概念的第二次跨越;至此利用“史料3”總結三種層次的定義與科學發展的一致性,從宏觀到微觀、從表象到本質,符合科學知識是變化的(Tenativeness)這一科學本質,可見氧化還原反應的概念進階本身就是“科學知識是變化的”真實體現。
2.挑選怎樣的STSE素材——為概念的遷移應用服務
為什么要建構氧化還原反應的概念?這是老師講授氧化還原反應前需要問自己的一個問題。工業生產、日常生活和社會發展中有太多的氧化還原反應以及與氧化還原反應息息相關的問題,本教學設計選擇了社會關注度較高的汽車尾氣排放和工業廢水污染兩則情境素材,包括汽車尾氣處理的三元催化的簡單原理和含六價鉻廢水的處理。鑒于高一新生的知識掌握的現有水平,本設計借助這兩則STSE素材讓學生進一步去理解氧化還原反應及氧化劑和還原劑的作用,在定性掌握氧化還原反應相關概念的基礎上,嘗試帶領學生根據得失電子守恒從定量視角分析素材1中第4問給定情境的氧化還原反應的配平和素材2中FeSO4用量的計算(該部分可以視學生基礎合理取舍),旨在引導學生建構氧化還原反應概念的基礎上應用該基本概念解決真實情境下的問題。

