PRSS35在雞卵泡膜細胞中的表達與卵泡液雌激素含量的關系
孟金柱,陸雨芳,趙成剛,張羽強,趙園園
(1.銅仁學院,貴州銅仁 554300;2.貴州梵凈山同心生態養殖有限公司,貴州銅仁 554300)
蛋雞的卵泡發育具有明顯的等級優先性,根據直徑大小及其功能,把卵泡劃分為等級卵泡和等級前卵泡兩大類[1]。等級卵泡,也稱為排卵前卵泡,從大到小排列為F1、F2、F3、F4、F5…,直徑最大能達到40mm[2]。等級前卵泡按照直徑分為:1~2mm的小白卵泡(SWF)、3~5mm的大白卵泡(LWF)、6~8mm的小黃卵泡(SYF)和9~12mm的大黃卵泡(LYF)[3]。研究發現,直徑為6~8mm的小黃卵泡是卵泡在選擇過程中能否優先進入等級的轉擇點,只有進入小黃卵泡庫的卵泡才有可能被選擇發育成為排卵前卵泡。然而,只有5% 的大白卵泡可以發育成為小黃卵泡[4]。
在蛋雞卵泡發育過程中,由下丘腦分泌的促性腺激素釋放激素(GnRH)通過促進垂體分泌促卵泡素(FSH)和促黃體素(LH)刺激卵巢分泌雌激素和孕激素,來調控卵母細胞的增殖,進而導致排卵[5]。卵泡中的顆粒細胞和包圍在顆粒細胞外層的卵泡內膜細胞都參與了激素的合成及分泌,其中顆粒細胞負責合成分泌孕激素(P4),而卵泡內膜細胞是合成及分泌雄激素和雌激素(E2)的主要部位[6]。在等級前卵泡中,E2對促進顆粒細胞增殖及卵泡發育成熟具有重要的作用[7];當卵泡接近成熟時,卵泡內膜細胞中的芳構化酶活性會降低, E2的分泌會逐漸減弱,相反,顆粒細胞分泌的P4會增加[8]。
絲氨酸蛋白酶(PRSS)是蛋白酶家族中的重要成員,Miyakoshi 等[9]發現,PRSS35在小鼠卵巢顆粒細胞、黃體以及早期妊娠子宮內表達,推測 PRSS35在雌性生殖過程中發揮重要作用,特別是在卵母細胞發育、排卵、著床和蛻膜化等過程[10]。進一步研究表明,PRSS35mRNA 只在發育卵泡的膜層、排卵前和排卵卵泡的顆粒細胞,以及正在形成及消退的黃體中有表達[11-12],可能與卵母細胞的受精潛力有關。且PRSS35的表達具有高度特異性,推測PRSS35可能參與小鼠卵泡發育及排卵過程并促進卵泡發育、誘導排卵[13-14]。而關于PRSS35在禽類卵泡中的功能研究及作用機制鮮見報道。因此,本研究通過免疫組織化學技術對PRSS35在蛋雞卵泡中的表達進行定位,利用實時熒光定量PCR(RT-PCR)和Western blot技術對PRSS35mRNA和蛋白在卵泡內膜細胞中的相對表達情況進行分析,同時采用ELISA技術對卵泡液中的E2進行測定,旨在探明PRSS35在蛋雞卵泡中的表達位置及其在不同大小卵泡中的表達與E2分泌的關系,為進一步研究PRSS35在卵泡發育中的功能及作用機制奠定基礎。
1 材料與方法
1.1 試驗動物及樣品采集
在貴州梵凈山同心生態養殖有限公司(貴州銅仁)選取5只150 日齡健康的土母雞宰殺后,分別剪下卵巢上的小白卵泡、大白卵泡、小黃卵泡和大黃卵泡,抽取卵泡液用于E2含量的測定,刮取卵泡內膜細胞用于總RNA和總蛋白提取。選取部分大白卵泡和小黃卵泡,放入體積分數為4% 的多聚甲醛溶液中固定24 h,用于PRSS35在大白卵泡和小黃卵泡組織中的表達定位。
1.2 試驗方法
1.2.1 PRSS35的組織定位 參照于雪靜[15]免疫組織化學研究的方法,將大白卵泡和小黃卵泡的石蠟切片經脫蠟、阻斷、抗原修復、封閉后,分別滴加兔抗PRSS35一抗(1∶100稀釋),以滴加正常兔血清作對照,4 ℃過夜孵育,然后復溫,二抗孵育(鼠抗兔IGg),DAB顯色,蘇木精復染,脫水,透明,封片;最后置于顯微鏡(Leica,德國)下采集照片并分析。
1.2.2 總RNA提取及RT-PCR分析 使用Trizol法分別提取小白卵泡、大白卵泡、小黃卵泡和大白卵泡膜細胞的總RNA,通過反轉錄試劑盒(北京全式金)反轉錄為cDNA,反應條件為: 42 ℃孵育15 min,85 ℃加熱5 s。使用GAPDH作為內參基因,通過NCBI在線設計引物(表1)并交由上海生工生物有限公司合成。
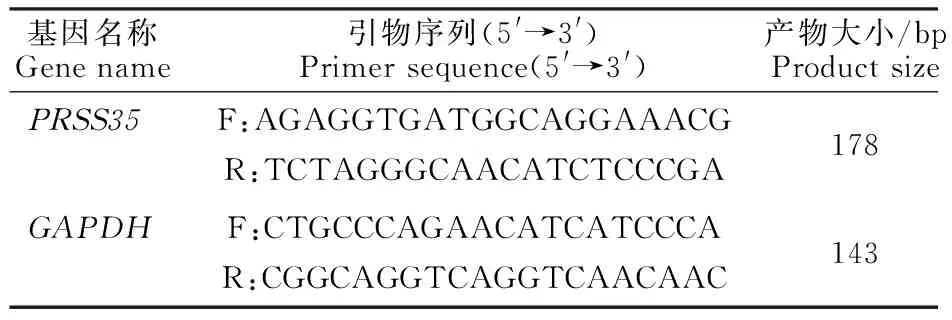
表1 供試引物序列Table 1 Tested primer sequence
RT-PCR按照北京全式金產品Transstart○RTip Green qPCR SuperMix使用說明書推薦的 20 μL反應體系進行,采用LightCycler 480平臺設置條件:94 ℃預變性1 min;94 ℃ 10 s,60 ℃ 30 s,72 ℃ 10 s,45個循環。結果使用2-△△CT法計算PRSS35的相對表達量。
1.2.3 總蛋白提取及Western blot分析 使用上海碧云天生物技術有限公司的RIPA裂解液(強)分別提取小白卵泡、大白卵泡、小黃卵泡和大白卵泡膜細胞的總蛋白,參照畢錫麟[16]的方法進行Western blot,所用一抗為兔抗PRSS35 (1∶1 000稀釋),以GAPDH為對照,4 ℃孵育14 h,TBST清洗3次,每次10 min;HRP-山羊抗兔為二抗(1∶2 000稀釋),TBET清洗3次,每次10 min;最后置于凝膠成像系統拍照并分析。
1.2.4 卵泡液中E2的含量測定 使用E2ELISA試劑盒(上海藍基)分別測定小白卵泡、大白卵泡、小黃卵泡、大黃卵泡卵泡液中E2的含量。采用5個樣本重復,每個樣本進行3個技術重復,分別向酶標板上的空白孔中依次加入 50 μL 0 ng/mL、0.25 ng/mL、0.5 ng/mL、 1 ng/mL、2.5 ng/mL和5 ng/mL的標準品,其余孔中依次加入待測樣品,按照試劑盒使用說明書將反應液配置好以后,置于酶標儀中讀取OD(Optical density)值,根據標準品的質量濃度所對應的OD值建立標準曲線,將所獲得的OD值轉換為質量濃度值。
2 結果與分析
2.1 PRSS35蛋白在蛋雞卵泡內的表達
通過免疫組織化學技術對PRSS35在蛋雞卵泡中的表達進行定位,顯微鏡下觀察發現(圖1),陰性對照組未發現有特異性著色,試驗組卵泡顆粒細胞層、膜細胞層和卵丘細胞均呈現棕黃色。表明PRSS35蛋白在蛋雞卵泡的顆粒細胞層、膜細胞層和卵丘細胞中均有表達。
2.2 PRSS35 mRNA在蛋雞不同大小卵泡膜細胞中的表達差異
采用QRT-PCR檢測PRSS35 mRNA在蛋雞不同大小卵泡膜細胞中的表達情況,結果表明(圖2),PRSS35 mRNA在小黃卵泡膜細胞中的含量顯著高于其他卵泡(P<0.05),而小白卵泡、大白卵泡和大黃卵泡膜細胞之間PRSS35 mRNA的含量差異不顯著(P>0.05)。
2.3 PRSS35蛋白在蛋雞不同大小卵泡膜細胞中的表達差異
采用QRT-PCR檢測PRSS35 蛋白在蛋雞不同大小卵泡膜細胞中的表達情況,結果表明(圖3),PRSS35蛋白在小黃卵泡膜細胞中的含量顯著高于其他卵泡(P<0.05),而小白卵泡、大白卵泡和大黃卵泡膜細胞之間差異不顯著(P> 0.05)。
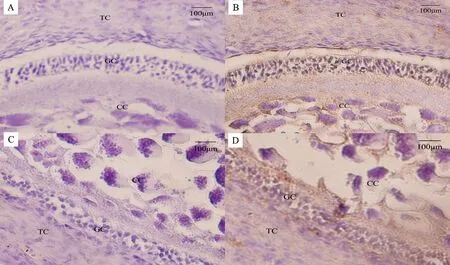
A.大白卵泡陰性對照; B.大白卵泡試驗組;C.小黃卵泡陰性對照;D.小黃卵泡試驗組;GC.顆粒細胞層;TC.膜細胞層;CC.卵丘 細胞
A.Negative control of large wihte follicles; B.Experiment group of large wihte follicles; C.Negative control of small yellow follicles; D.Experiment group of small yellow follicles; GC.Granulosa cells layer; TC.Theca cells layer; CC.Cumulus cells
圖1 PRSS35在蛋雞卵泡中的表達(×200)
Fig.1 Expression of PRSS35 in chicken ovary follicles (×200)
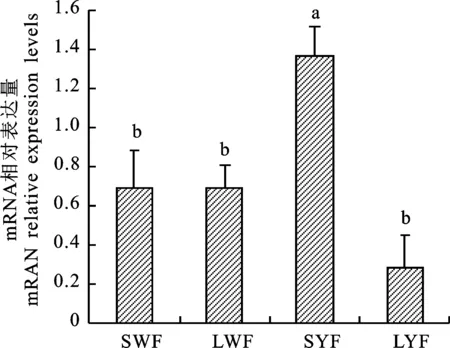
小寫字母表示差異顯著(P<0.05)。下同
Lowercase letters indicate significant difference (P<0.05).The same below
圖2 不同大小卵泡顆粒細胞內
PRSS35 mRNA的相對表達水平
Fig.2 Relative expression of PRSS35 mRNA
in follicle theca cells at different sizes
2.4 蛋雞不同大小卵泡卵泡液中E2的含量
E2測定結果表明(圖 4),E2在小黃卵泡卵泡液中的含量顯著地高于其他卵泡(P<0.05),小白卵泡和大白卵泡顯著高于大黃卵泡(P< 0.05)。
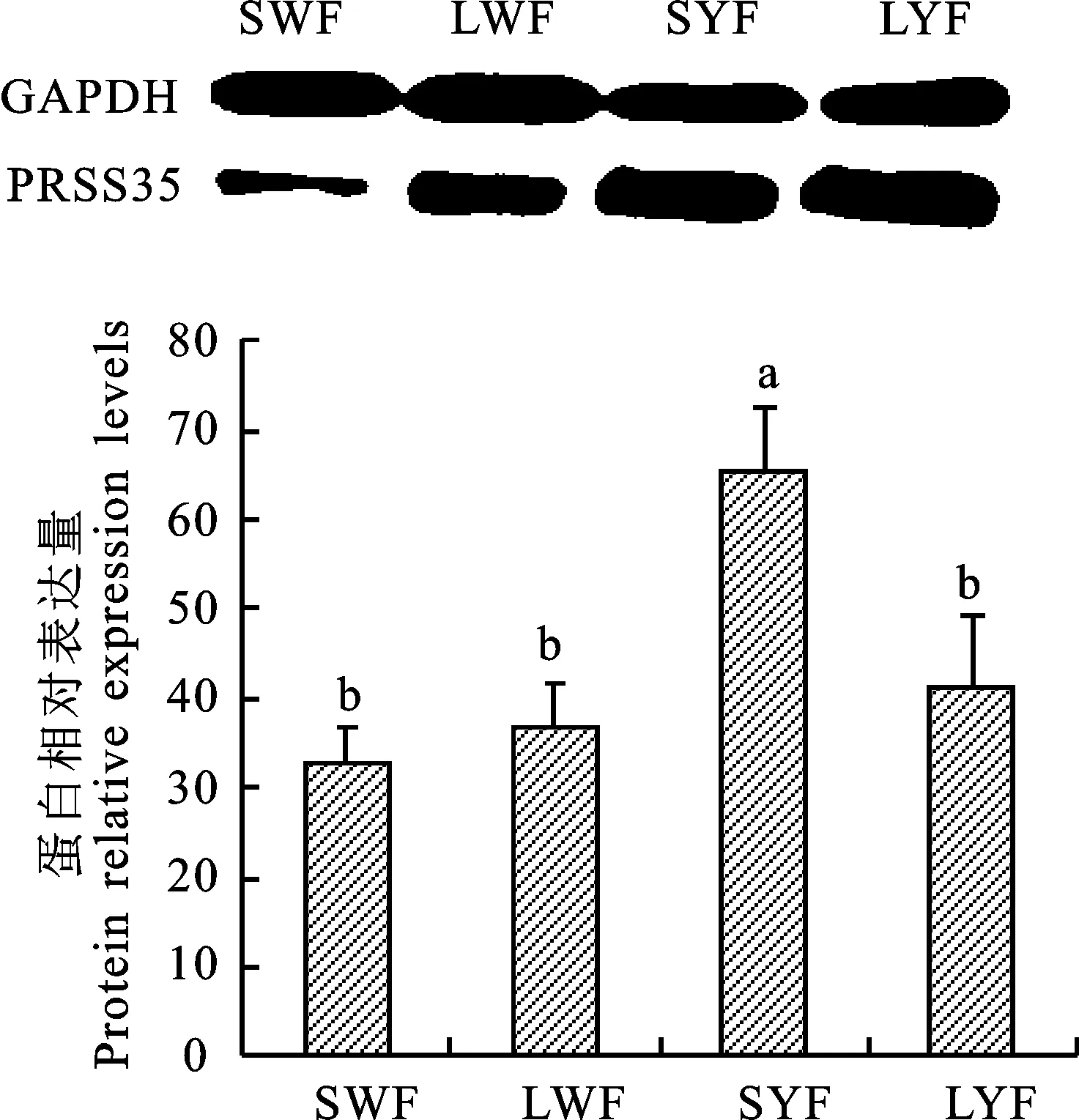
圖3 不同大小卵泡膜細胞內PRSS35蛋白的相對表達水平Fig.3 Relative expression of PRSS35 in follicle theca cells at different sizes

圖4 不同大小卵泡卵泡液中E2的含量Fig.4 E2 concentrations in follicle fluids at different sizes
3 討 論
蛋雞的卵泡在多種激素和生長因子的共同調控下,促進顆粒細胞和內膜細胞的增殖和分化及子宮內膜細胞和卵母細胞的成熟[17]。在這個過程中,只有大約1% 的卵泡能夠排卵,直徑為6~8 mm的小黃卵泡是卵泡在選擇過程中優先進入等級還是走向閉鎖的轉擇點:此階段大部分卵泡會走向閉鎖,另一小部分卵泡則發育成為大黃卵泡[4],只有進入小黃卵泡庫的卵泡才有可能被選擇發育成為排卵前卵泡[18]。等級前卵泡的發育會直接影響卵泡的選擇、成熟及排卵,進而影響產蛋規律[19]。本研究中QRT-PCR和Western blot試驗結果均顯示,PRSS35 mRNA和蛋白在小黃卵泡中的含量顯著高于其他卵泡(P<0.05),表明PRSS35可能是蛋雞等級前卵泡發育過程中的重要調控因子,可能參與卵泡的選擇。
在動物體內,絲氨酸蛋白酶(Serine protease)作為一種重要蛋白水解酶類,通過絲氨酸蛋白酶抑制劑(Serine protease inhibitor)來調節細胞分化、組織重建、血管形成、胚胎發育和病原侵入等過程[20]。研究發現,PRSS35在小鼠卵泡顆粒細胞、黃體妊娠早期的子宮中有表達,推測其可能在小鼠卵泡發育過程中發揮重要作用[21]。Sheng等[22]研究表明,PRSS35只在卵巢組織中有表達,證明其可能與卵母細胞的活力相關,從而影響其受精能力。此外,Patrik 等[14]認為,PRSS35在小鼠發育的卵泡膜細胞層表達,且在排卵卵泡顆粒細胞中表達較高;同時,在形成和退化的黃體中也有表達,推測PRSS35可能參與排卵以及黃體的形成和退化過程,關于PRSS35在家禽中的研究鮮見報道。本試驗通過對等級前大白卵泡和小黃卵泡2種卵泡進行免疫組織化學研究的結果顯示,PRSS35在蛋雞大白卵泡和小黃卵泡2種卵泡的顆粒細胞層、膜細胞層和卵丘細胞中均有 表達。
在哺乳動物卵泡中,雌激素的合成和分泌是受多種激素和細胞因子共同調節的[23]。促黃體素(LH)通過與卵泡膜細胞上的LH受體結合后,會激活cAMP-蛋白激酶,將膽固醇轉化為雄激素,雄激素再被轉運到顆粒細胞,在促卵泡素(FSH)與多種生長因子的共同介導下,使顆粒細胞進一步分化,從而具備合成芳構化酶的能力,最終把雄激素轉化為雌激素,而膜細胞則負責為顆粒細胞合成E2提供前體物質(雄激素)[24]。與哺乳動物不同,在禽類卵泡中相對簡單, 顆粒細胞中的膽固醇裂解酶將膽固醇裂解為孕激素后被轉運到膜細胞內,LH與卵泡膜細胞上的受體結合以后,使ATP轉化為cAMP,進而激活芳香化酶將孕激素轉化為E2[25],而合成的E2又可以反饋到顆粒細胞中,從而抑制顆粒細胞合成P4,進一步調節卵泡的發育、成熟及排卵[26]。卵泡液中E2的含量會直接影響卵泡的選擇、排卵或閉鎖。本研究通過ELISA法對不同大小等級前卵泡卵泡液中的E2含量進行測定,表明E2在小黃卵泡卵泡液中的含量顯著高于其他卵泡卵泡液(P<0.05),且E2含量在小白卵泡和大白卵泡卵泡液中顯著高于大黃卵泡(P<0.05)。推測PRSS35在小黃卵泡中可能會促進膜細胞合成分泌E2,從而參與卵泡的選擇。
4 結 論
本研究發現PRSS35在蛋雞卵泡的顆粒細胞層、膜細胞層和卵丘細胞均有表達;PRSS35 mRNA和蛋白在小黃卵泡中的含量顯著高于其他卵泡(P<0.05),E2在小黃卵泡卵泡液中的含量顯著高于其他卵泡卵泡液(P<0.01),在小白卵泡和大白卵泡卵泡液中顯著高于大黃卵泡(P< 0.05),推測PRSS35在小黃卵泡中可能會促進卵泡內膜細胞分泌E2,從而影響卵泡的選擇。

