常壓室溫等離子體與5-溴尿嘧啶復合誘變及快速選育腺苷高產菌株
楊心萍,宋詞,張偉豪,劉艷,2,王洲,2,薛正蓮,2*
1(安徽工程大學 生物與化學工程學院,安徽 蕪湖,241000) 2(微生物發酵安徽省工程技術研究中心,安徽 蕪湖,241000)
腺苷是一種遍布人體細胞的重要內源性核苷酸,可直接進入心肌經磷酸化生成腺苷酸,參與心肌能量代謝[1-2]。因其在心血管系統中有很重要的生化代謝和調節功能而被人們熟知[3]。微生物發酵法生產腺苷具有生產成本低、反應條件溫和、原材料廣泛等優點。目前腺苷菌株主要通過誘變選育方式得到,高效的誘變技術及篩選方法無疑可大大提高獲得高產菌株的效率。
由清華大學自主研發的新型常壓室溫等離子體(atmospheric room temperature plasma, ARTP)微生物快速突變技術具有安全性高、操作簡單、突變率高等優勢[4-7]。ARTP可以快速地突變細菌、真菌等多種微生物,是可以快速高效地獲得高產菌株的新型誘變劑[8-10]。大量的研究表明,ARTP誘變與其他誘變相結合的方式可以提高突變率[9,11-13]。本文選用化學誘變劑5-BU,其作用機理是作為堿基類似物,與正常堿基結構相似,在DNA復制過程中,取代正常堿基滲入DNA分子[14]。目前關于ARTP與5-BU結合的誘變方式還鮮有報道。
孔板發酵實現快速選育在發酵行業中有很多成功的應用[15-17]。與傳統的搖瓶發酵方式相比,孔板具有發酵體積小、篩選效率高等優勢。邊緣孔現象在酶聯免疫反應中較為常見,表現為邊緣孔顯色較中間孔顏色更深[18-19]。在孔板培養好氧微生物的過程中出現的邊緣孔效應,還未見報道。本研究使用48孔板對枯草芽孢桿菌進行發酵,對孔板均一性進行考察,以提高菌株篩選的準確性。
本研究運用ARTP與5-BU相結合的方式,對48孔板均一性進行考察,使用SG抗性平板以及48孔板發酵的方式,篩選得到遺傳穩定的腺苷突變菌株。以期該復合誘變方法能選育腺苷高產菌株,也為其他產核苷類物質菌株的選育提供了參考。
1 材料與方法
1.1 菌株
枯草芽孢桿菌(B-0),本實驗室保藏。
1.2 儀器及試劑
UV-5500PC紫外可見分光光度計,上海元析儀器有限公司;ARTP-IIS ARTP育種機,北京思清源生物科技有限公司。化學藥品均為國產分析純。
1.3 培養基
固體培養基(g/L):葡萄糖10,蛋白胨10,酵母膏10,牛肉膏10,尿素5,NaCl 2.5,瓊脂20,115 ℃滅菌30 min,pH 7。
種子培養基(g/L):葡萄糖10,蛋白胨10,酵母膏10,牛肉膏3,尿素5,KCl 2,泡敵0.3,115 ℃滅菌30 min,pH 7。
發酵培養基(g/L):葡萄糖106.25,玉米漿30,多糖茸精6,KH2PO41,MgSO4·7H2O 2.5,尿素3,KCl 2,(NH4)2SO43,MnSO4·H2O 0.05,檸檬酸4.5,味精4,泡敵0.3,115 ℃滅菌30 min,pH 7。
抗性培養基:在固體培養基上添加0.8~1.2 g/L SG制成抗性培養基,SG過濾除菌。
1.4 腺苷含量的測定
取適量發酵液于2 mL離心管中,煮沸5 min,8 000 r/min離心5 min后,使用濃度為 0.1 mol/L HCl溶液,采用10倍梯度稀釋法,稀釋至適當的濃度,于260 nm處測定吸光度。
1.5 發酵培養條件
孔板發酵中,使用已滅菌的鑷子夾取已滅菌的牙簽挑取單菌落,接入發酵液中;搖瓶發酵中,采用體積分數8%的種子液接入發酵液中。培養條件均為37 ℃,240 r/min,培養3 d。
1.6 抗性濃度的選擇
選取0、0.1、0.2、0.3、0.4、0.5、0.6、0.7和0.8 g/L的SG分別制備平板,每個質量濃度制備3個平板。取稀釋后的100 μL對數期菌液涂布于各個平板上,37 ℃培養3 d后觀察生長情況。
1.7 ARTP誘變處理
取1 mL對數期的菌懸液,離心去上清后使用生理鹽水垂懸,稀釋至106~108CFU/mL,完成菌懸液的制備。將小鐵片灼燒后放至室溫,均勻平鋪10 μL菌懸液。在ARTP機器放電功率為120 W,照射距離2 mm,氣流量為10 SLM的條件下,對小鐵片上的菌懸液分別進行0、15、30、45、60、75和90 s的誘變處理,誘變結束后充分振蕩洗脫,適當稀釋后,分別涂布于普通平板和抗性平板,每組3個平行,培養2~3 d后觀察生長情況。
1.8 5-BU誘變處理
取1 mL對數期的菌懸液,離心去上清后使用生理鹽水垂懸,37 ℃振蕩饑餓培養8 h,使其盡量消耗自身的營養物質。稱取0.02 g 5-BU,加入10 mL去離子水,50 ℃低溫熱溶[20]。將5-BU 加入完全固體培養基內,使其最終質量濃度為10、20、30、40、50和60 μg/mL。將饑餓培養8 h的菌懸液適當稀釋后,分別涂布于含有0.88 g/L SG和不含有SG的5-BU平板上,使其在生長的過程中被誘變,每組3個平行,培養2~3 d后觀察生長情況。
1.9 ARTP與5-BU復合誘變處理
將5-BU溶液與SG溶液分別加入固體培養基中,加入后的最終質量濃度分別為20 μg/mL與0.88 g/L。將ARTP誘變處理60 s后的菌懸液,適當稀釋后,涂布于普通平板和含有5-BU及SG的平板,培養2~3 d后觀察生長情況。
1.10 致死率、正突變率計算
經過1.6、1.7、1.8節中的方法處理后,根據菌株在不同平板上的生長情況,按照公式(1)、(2)分別計算不同處理時間下枯草芽孢桿菌的致死率與正突變率。

(1)

(2)
式中:U,未經處理的對照組平板上生長的菌落數;S,各處理劑量下平板上生長的菌落數;P,在含有0.88 g/L SG的抗性平板上生長的菌落數。
1.11 突變菌株遺傳穩定性檢測
將篩選得到的突變菌株連續傳代培養10代,分別檢測每代菌株發酵液中腺苷產量,以確定突變菌株的遺傳穩定性。
1.12 數據處理
采用Origin 2018繪圖,IBM SPSS Statistics 25 數據分析。
2 結果與分析
2.1 孔板均一性考察
2.1.1 48孔板邊緣孔效應驗證
在應用48孔板進行誘變菌株復篩時,發現高產菌株集中于48孔板邊緣位置。將此類“高產菌株”進行搖瓶發酵后,發現產量并未有明顯提升。這意味著孔板發酵過程中可能存在邊緣效應。如圖1所示,選擇24孔板中3個位置,即1號長邊緣孔、2號短邊緣孔,3號中間孔。選擇同一株菌進行發酵后,比較孔板中3個位置的腺苷含量,進行3組平行實驗,結果如表1所示。

圖1 48孔板位置示意圖Fig.1 48-well plate location diagram
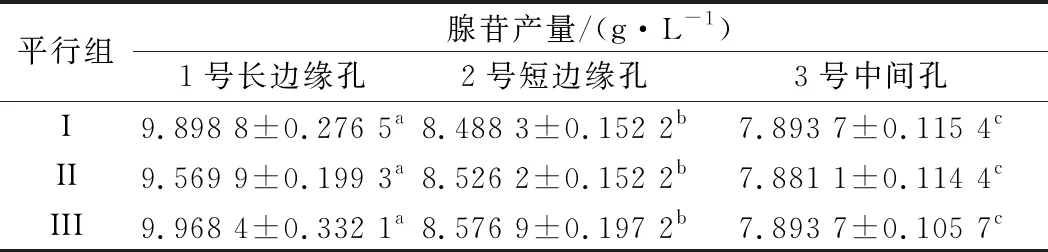
表1 48孔板不同位置腺苷產量Table 1 48-well plate adenosine yield at different positions
注:同行數據后不同小寫字母代表不同類型孔間存在顯著性差異(P<0.05)
3個位置孔中腺苷產量表現出明顯差異。對比發酵72 h不同孔間發酵液剩余量,發現邊緣孔剩余發酵液體積明顯低于中間孔體積。說明邊緣效應的出現可能與孔間水分蒸發不均有關。
2.1.2 孔板邊緣效應的消除
實驗結果表明采取空置邊緣孔及使用封口膜緊密纏繞孔板蓋與孔板的接口處,這2種方法均不能消除孔板邊緣效應,而將孔板邊緣孔位置填充2 mL的無菌水或發酵液,可有效消除邊緣孔效應。選擇同一株菌進行48孔板發酵后,對其產量進行分析,結果如表2所示,t值為0.003,小于顯著性水平α=0.05條件下的臨界值,故中間24孔孔間差異不顯著,可以排除在復篩過程中孔板間的系統誤差。

表2 48孔板孔間差的t-Test結果Table 2 t-Test result of difference between wellsin a 48-well plate
2.2 不同接種方式對腺苷產量的影響
采用單菌落接種發酵液的方式,可以減少種子培養過程,縮短篩選周期。將同一株菌,采用平板與種子液2種方式活化,將活化后的菌種接入發酵培養基,發酵結束后分別測定產量。如表3所示,t值為0.518,小于顯著性水平α=0.05條件下的臨界值,表明采用平板菌落及種子液2種接種方式差異不顯著。故在48孔板發酵中,采用單菌落直接接種以提高篩選效率。

表3 單菌落與種子液2種接種方式的t-Test結果Table 3 t-Test results of single colony and seed liquidinoculation methods
2.3 48孔板發酵與搖瓶發酵腺苷產量之間的相關性
隨機選擇誘變過程中得到的30株突變株,分別采用250 mL擋板搖瓶與48孔板發酵的方式,將得到的腺苷產量進行線性擬合后,y=1.014 9x-3.704 8,R2=0.921 3(圖2),表示2種發酵方式下的腺苷產量具有良好的線性關系,可以使用48孔板代替搖瓶發酵,提高篩選效率。

圖2 48孔板與250 mL搖瓶發酵腺苷產量的相關性Fig.2 Correlation between 48-well plate and 250 mL baffled shake flask fermentation yield
2.4 SG抗性濃度的選擇
SG作為腺苷的結構類似物,初篩過程中可以篩選掉大部分負突變菌株,提高篩選效率。按照1.6中的方法對SG臨界濃度進行確定,結果如圖3所示。當SG質量濃度為0.7 g/L時,平板菌株呈現微弱生長,當質量濃度為0.8 g/L時,平板上未見生長菌落。因此,0.8 g/L SG為菌株的臨界耐受濃度。將抗性濃度提升10%作為誘變初篩濃度,即SG抗性質量濃度為0.88 g/L。

a~i,SG質量濃度分別為0、0.1、0.2、0.3、0.4、0.5、0.6、0.7和0.8 g/L圖3 不同SG質量濃度平板篩選突變株Fig.3 Screening mutants with different SG concentrations
2.5 ARTP誘變最佳劑量確定
按照1.7中的方法進行誘變處理后,如圖4所示,ARTP對枯草芽孢桿菌有較強的致死能力,當照射60 s時,致死率達到88.24%,正突變率為36.36%,因此,后續復合誘變處理時間選定60 s。

圖4 ARTP誘變時間與枯草芽孢桿菌的致死率和正突變率的關系Fig.4 Relationship between ARTP mutagenesis time and lethal and positive mutation rates
2.6 5-BU誘變最佳劑量確定
5-BU作為堿基誘變劑[14,21],均勻混入培養基中,使菌株在生長的過程發生突變。按照1.8中的方法進行誘變處理后,當質量濃度為20 μg/mL,致死率與正突變率達到最高,分別為88.24%與18.18%,故20 μg/mL為最佳誘變劑量。

圖5 5-BU誘變濃度與枯草芽孢桿菌的致死率和正突變率的關系Fig.5 Relationship between 5-BU mutagenesis time and lethal and positive mutation rates
2.7 ARTP與5-BU復合誘變
如圖6所示,5-BU與ARTP單獨誘變時,誘變正突變率分別為18.18%和36.36%,復合誘變后,正突變率提升至50%。使用1.9中的方法進行復合誘變,對菌株進行6輪誘變處理后,結果如圖7所示,在第6輪誘變中,篩選到1株高產菌株,產量為11.99 g/L,較出發菌株提升34.67%。SG抗性濃度達1.1 g/L,較初始SG濃度提升37.5%。將得到的腺苷高產菌株命名為B-6。

圖6 三種誘變方式的正突變率比較Fig.6 Comparison of positive mutation rates among three mutagenesis methods

圖7 六輪ARTP誘變復篩結果Fig.7 Results of 6 rounds of ARTP mutagenesis rescreening
2.8 高產菌株的遺傳穩定性考察
對突變株B-6進行遺傳穩定性實驗,結果如圖8所示,經過10代連續劃線培養并發酵,對發酵液中腺苷產量進行測定,腺苷含量為11.85 g/L左右。結果表明突變株B-6具有較好的穩定性,能高效生產腺苷。

圖8 突變株B-6產腺苷的遺傳穩定性Fig.8 Genetic stability of adenosine-producing mutant B-6
3 結果與討論
建立高效、準確的選育方法是菌株誘變選育的關鍵。廖丹等[22]在熒光素酶報告基因實驗中,發現使用48孔板時存在邊緣孔效應,且用磷酸鹽緩沖液填充可以削弱邊緣效應。本研究通過對48孔板邊緣孔效應的考察,發現用48孔板培養枯草芽孢桿菌B-0時也存在邊緣孔效應,通過2 mL無菌水填充可以有效地消除邊緣孔效應。
ARTP誘變作為一種新型高效的誘變劑[4],與5-BU結合表現出良好的誘變效果。本研究中,采用ARTP與5-BU復合誘變的方式,并結合SG的抗性篩選,正突變率可達到50%,經過6輪誘變后,最終得到1株腺苷高產菌株B-6,48孔板中產量為11.94 g/L,較出發菌株B-0(產量為7.8 g/L)提升34.67%,經10代傳代培養后,腺苷產量穩定,可以用于后續的進一步研究。

