炙甘草多糖對小鼠巨噬細胞再極化的影響①
馮 磊 李 響 孟繁平 李 妍 (延邊大學醫學院免疫學教研室,延吉 133002)
血液中單核細胞被募集分布于組織成為巨噬細胞(macrophage),組織微環境中巨噬細胞通過經典極化的途徑和選擇性極化的途徑分別向M1型和M2型極化[1]。在細胞因子IFN-γ、病原體成分脂多糖(lipopolysaccharide,LPS)等刺激下,巨噬細胞向M1型極化,其細胞膜CD40、CD80和CD86等表達增加,并分泌促炎因子,抗病原體和抗腫瘤效應增強。而M2型極化后CD40、CD80和CD86等表達減少,CD206表達增加;其抗原提呈和介導炎癥活性下降,免疫調節、促進組織修復作用增強[2]。M1型和M2型是活化巨噬細胞的兩個極端狀態,其分化受到復雜環境的調節。M2 型可再極化為M1 型,反之亦然。腫瘤微環境中(tumor microenvironment,TME)的腫瘤相關巨噬細胞(tumor associated macrophage,TAM)傾向于M2型極化,分泌TGF-β、IL-10、血管內皮生長因子(vascular endothelial growth factor,VEGF)和基質金屬蛋白酶9(matrix metalloproteinase 9,MMP9)等細胞因子[3]。研究表明,局部TAM數量多與腫瘤患者癌轉移復發快、生存期短密切相關[4]。篩選逆轉M2極化的制劑,對干預TAM分化,輔助腫瘤治療具有重要意義。前期研究發現炙甘草的中等分子量多糖(medium molecular weight polysaccharide from roasted radixglycyrrhizae,MPRR)具有較強活化巨噬細胞的作用[5]。本研究通過探討IL-4誘導巨噬細胞向M2型極化,并檢測MPRR對其再極化的調節,闡明不同極化型巨噬細胞對腫瘤細胞生長的影響。
1 材料與方法
1.1材料 小鼠RAW264.7巨噬細胞和小鼠4T1乳腺癌細胞引自美國標準生物品保藏中心。胎牛血清購自黃巖四季青有限公司。1640 培養液購自美國 Gibco 公司。藻紅蛋白(phycoerythrin,PE)標記抗體(CD86、CD206 )和PE標記同型對照抗體購自天津三箭生物技術有限公司。羧基化聚苯乙烯熒光微球 (fluospheres carboxylate yellow-green 505/515)購自美國賽默飛公司。IL-4購自北京義翹科技有限公司。ELISA試劑盒(檢測小鼠IFN-γ和TGF-β)購自美國eBioscience公司。小鼠 STAT-6抗體、磷酸化STAT-6(Tyr641)抗體、β-actin抗體和辣根過氧化物酶(HRP)標記的二抗購自美國Abcam公司。牛血清白蛋白(BSA)、噻唑藍(MTT)和碘化丙啶(PI)等購自上海碧云天生物技術有限公司。蛋白電泳和免疫印跡相關緩沖液購自北京索萊寶生物科技有限公司。采用水提和醇沉法制備炙甘草多糖,采用超濾離心法制備炙甘草的中等分子量多糖(MPRR)[6]。用1640培養液溶解IL-4(50 μg/ml),分裝后-20℃保存;1640培養液溶解MPRR(5 mg/ml),過濾除菌并分裝后-20℃保存。
1.2方法
1.2.1細胞培養 自液氮中取出凍存RAW264.7 細胞和4T1細胞,復蘇后用含10%小牛血清1640培養液、5%CO2、飽和濕度、37℃培養。消化液(0.25%胰蛋白酶和 0.2%乙二胺四乙酸)消化后傳代培養,取對數生長期細胞用于實驗。
1.2.2免疫熒光染色和流式細胞術分析 接種細胞于6孔板,加入不同濃度IL-4(0、12.5、25、50和100 ng/ml),培養12 h,更換培養液繼續培養12 h,收集細胞,PBS洗滌細胞2次,采用直接免疫熒光,法檢測CD86和CD206的表達。即200 μl含0.5% BSA 溶液重懸細胞(細胞總數約為1×106個),加入抗體1 μg(PE標記抗CD86、CD206或同型對照抗體),避光染色30 min。PBS洗滌細胞2次,轉入流式管后上機檢測。以膜分子表達陽性細胞百分率代表實驗結果。相同方法分析其他處理因素作用后CD86和CD206表達。
1.2.3吞噬功能檢測 收集不同處理因素作用后的細胞,每組細胞數為(1~2)×106個,細胞與2 μl羧基化聚合苯乙烯熒光微球(細胞與微球的比例為1∶25~1∶100)孵育2 h后收集細胞,洗滌3次后采用流式細胞術檢測細胞內綠色熒光,發射綠色熒光的細胞為吞噬熒光微球的細胞,以陽性細胞百分率代表吞噬效應的強度。
1.2.4免疫印跡實驗 接種RAW264.7細胞于6孔板,按如下分組進行處理。M0組(以培養液培養細胞12 h,更換新培養液后繼續培養12 h),M2組(50 ng/ml IL-4 誘導細胞12 h,更換培養液繼續培養12 h),MPRR組(100 μg/ml MPRR 誘導12 h,更換培養液繼續培養12 h),Rp組(50 ng/ml IL-4 誘導12 h,洗滌細胞2次,100 μg/ml MPRR 誘導12 h)。收集不同處理因素誘導后細胞,PBS洗滌2次;末次離心棄上清,加入細胞裂解液提取細胞總蛋白。蛋白定量試劑盒測定各組樣品的蛋白濃度,并調為濃度一致;加入上樣緩沖液后水浴煮沸5 min,分裝蛋白樣品并冷凍保存。將蛋白樣品上樣于聚丙烯酰胺凝膠進行電泳分離;通過轉膜電泳將蛋白轉印于PVDF膜。用含5%脫脂奶粉的封閉液室溫下封閉2 h,洗滌3次后將膜與稀釋的一抗在4℃下反應過夜。次日洗滌PVDF膜3次,將膜與稀釋的HRP標記二抗在室溫下反應2 h。洗滌3次后與ECL發光工作液反應2 min,用凝膠成像系統曝光照相記錄結果。
1.2.5細胞因子含量檢測 接種細胞于6孔板,按M0組、M2組、MPRR組和Rp組進行處理。消化液處理并收集細胞,洗滌2次后按相同密度接種細胞于6孔板,以不含IL-4或MPRR的培養液繼續培養24 h;收集上清液并用0.22 μm無菌針頭過濾器過濾后分裝保存;采用ELISA試劑盒檢測培養上清液IFN-γ和TGF-β的含量。
1.2.6細胞生長檢測 接種4T-1于96孔板,對照組每孔加入200 μl;實驗組加入150 μl 培養液,并分別加入不同處理組的巨噬細胞培養上清液(M0組、M2組、MPRR組和Rp組)50 μl,繼續培養細胞,用MTT還原法檢測72 h后細胞增殖變化。檢測前4 h,每孔加入20 μl MTT溶液(5 mg/ml);繼續培養4 h后,棄上清,每孔加入200 μl 二甲基亞砜溶解細胞內還原產物甲臜,檢測490 nm吸光度值(A490),以各組A490均值代表不同處理因素對細胞生長的影響。
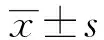
2 結果
2.1IL-4 流式細胞術檢測極化巨噬細胞CD86和CD206的表達 流式細胞術分析RAW264.7細胞在IL-4和MPRR的作用下,其CD86和CD206表達變化,隨IL-4濃度增加,CD86陽性細胞的百分率下降(P<0.05),而CD206陽性細胞的百分率增加(P<0.05);伴隨MPRR濃度增加促進CD86的表達(P<0.05),但CD206陽性細胞表達下降(P<0.05),見表1。
2.2流式細胞術檢測M2極化巨噬細胞再極化后CD86和CD206的表達 M0組(對照組)、M2組(M2極化組)、MPRR(極化組) 和Rp組(再極化組)的CD86和CD206表型分析, 與M0組比較,M2極化組 CD86表達減少(P<0.05)和CD206 表達增加(P<0.05),MPRR組CD86表達增加而CD206表達減少(P<0.05);與M2極化組比較,再極化組CD86表達增加而CD206表達減少(P<0.05),見表2。



GroupsDoseCD86CD206IL-4(ng/ml)061.01±4.38 9.56±2.6212.559.81±4.4610.89±1.662555.38±3.651)15.16±2.411)5054.31±4.791)18.38±3.681)10052.32±4.181)21.23±3.451)MPRR(μg/ml)2563.30±3.531)9.68±2.305066.07±5.061)7.03±2.261)10069.67±3.751)6.32±2.141)20070.30±3.801)5.84±1.811)
Note:Compared with IL-4 0 ng/ml,1)P<0.05.
如圖1所示,采用免疫印跡法分析轉錄因子STAT-6表達和磷酸化的變化。各組細胞STAT-6表達無明顯變化;M0組STAT-6磷酸化極低,與M0組比較,M2組細胞STAT-6磷酸化顯著增強;與M2組比較,再極化組磷酸化STAT-6(Tyr641)明顯下降。
2.3M2極化巨噬細胞再極化后吞噬功能分析 收集不同條件誘導后巨噬細胞,檢測M0組、M2組、MPRR組和Rp組細胞對熒光微球的吞噬,結果見表3。與M0組比較,M2極化組吞噬率下降(P<0.05),MPRR組吞噬效應增強(P<0.05);再極化組(Rp)的吞噬效應強于M2極化組(P<0.05)。
2.4流式細胞術檢測巨噬細胞條件培養上清中IFN-γ和TGF-β的水平 收集不同條件誘導后巨噬細胞的培養上清,檢測M0組、M2組、MPRR組和Rp組IFN-γ和TGF-β的濃度。與M0組比較,M2極化組IFN-γ表達減少(P<0.05)和TGF-β表達增加(P<0.05),MPRR組IFN-γ表達增加而TGF-β表達減少(P<0.05);與M2極化組比較,再極化組IFN-γ和TGF-β的表達均增加(P<0.05),見表4。
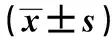


GroupsCD86CD206M061.77±4.799.78±1.36M254.64±3.711)17.64±2.381)MPRR68.88±3.591)6.72±1.561)Rp61.26±3.302)10.51±1.712)
Note:Compared with M0 group,1)P<0.05;compared with M2 group,2)P<0.05.

圖1 MPRR對M2極化細胞STAT-6表達和磷酸化的影響Fig.1 Effect of MPRR on expression and phosphorylation of STAT-6 in M2-polarized cells
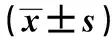


GroupsIFN-γM062.6±4.8M253.3±5.41)MPRR71.5±6.61)Rp65.1±7.62)
Note:Compared with M0 group,1)P<0.05;compared with M2 group,2)P<0.05.



GroupsIFN-γTGF-βM0514.8±21.6115.0±14.4M2249.4±26.31)245.4±25.91)MPRR591.6±25.21)90.6±12.81)Rp434.1±31.72)327.1±29.72)
Note:Compared with M0 group,1)P<0.05;compared with M2 group,2)P<0.05.
2.5巨噬細胞不同條件培養上清液對小鼠乳腺癌細胞增殖的影響 以新鮮培養液為對照,MTT還原法檢測不同的條件培養上清對4T1細胞生長的影響。M0組OD值為1.072±0.093,M2組OD值為1.482±0.086,MPPR組OD值為0.955±0.057,Rp組OD值為1.243±0.063。與M0組比較,M2組上清液OD值升高,MPPR組上清液OD值指標下降(P<0.05);與M2組比較,Rp組上清液OD值下降(P<0.05)。
3 討論
體內微環境中巨噬細胞可發生表型極化,而其功能也因不同極化而變化。靜息或未分化狀態的巨噬細胞(M0)可在 IFN-γ(活化Th1分泌)和LPS 誘導下向 M1 型轉變,轉錄因子STAT-1、NF-κB和AP-1轉位入核,調節IL-1、IL-6、IL-12、TNF-α、IFN-γ、一氧化氮合酶和多種趨化因子產生,其細胞膜CD40、CD80和CD86的表達增強。M1型巨噬細胞通過募集DC、NK和Th1,增強對病原體和腫瘤的免疫應答,NO和IFN-γ參與對腫瘤細胞和病原體的殺傷[6,7]。IL-4和IL-13(Th2等分泌)等細胞因子均可促進M2極化,M2高表達CD206、精氨酸酶 1(arginase 1,Arg1),分泌TGF-β、IL-4、IL-10、表皮生長因子(epidermal growth factor,EGF)和VEGF等,促進細胞生長和組織修復,促進Th2細胞介導的免疫。依據刺激物和功能不同,M2極化被細分為 M2a、M2b 和 M2c,M2a為Th2樣細胞因子誘導,是最早闡述的M2型極化[8]。M2b和M2c被稱為M2樣極化,Toll樣受體(或IL-1受體)信號與免疫復合物誘導M2b極化,而IL-10和TGF-β或糖皮質激素誘導M2c極化[9]。就細胞表面標志而言,巨噬細胞M1極化后CD40、CD80和CD86的表達增強;而M2極化表型通常伴隨CD206表達增加[10]。
M1和M2極化受到細胞內復雜信號的復雜調節。體內細胞因子IFN-γ 主要通過激活JAKs-STATs 信號通路而促進巨噬細胞M1極化,IFN-γ主要激活STAT1[11]。外源性誘導因子細菌脂多糖(lipopolysaccharide,LPS)主要通過TLR4-PI3K-NF-κB 信號通路促進M1極化。炎癥刺激、細胞應激和營養成分也可通過轉錄因子NF-κB促進M1極化,其信號經由PI3K、AKT和mTOR激酶轉導。AKT/PKB和哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是PI3K下游蛋白激酶分子。AKT即蛋白激酶B(proteinkinase B,PKB)家族有3個成員(AKT1、AKT2和AKT3)。單核細胞內AKT1由PI3K通過髓樣細胞白血病-1(myeloid cell leukemia-1)激活,維持巨噬細胞存活,AKT1活化強于AKT2時,巨噬偏向于M2極化[12]。AKT1基因敲除引起M1極化;而AKT2基因敲除引起M2極化。絲/蘇氨酸蛋白酶mTOR是偶聯能量供給、糖酵解和細胞脂類合成的調節點,結節性硬化復合體1和2(tuberous sclerosis complex,TSC1/2) 對其進行負調節。TSC1/2活性下降,則mTOR復合物1(mTOR complex1,mTORC1)活化加強,巨噬細胞釋放炎癥性細胞因子增加。蛋白激酶JNK是絲裂原激活蛋白激酶(mitogen-activated protein kinases,MAPKs)超家族成員,肥胖者脂肪組織中JNK激酶活性增強,通過激活轉錄因子AP-1促進M1極化[13]。Notch 受體(Notch1~4)和配體參與巨噬細胞極化調節,Notch1信號通過促進 NF-κB輔助TLR4促進M1極化。IL-4和IL-13 與巨噬細胞的受體 IL-4Rα結合,主要通過JAK-STAT6 信號通路誘導巨噬細胞M2 極化。STAT6 缺失下,IL-4不能抑制 MIG的表達。STAT6 激活過氧化物酶增殖物激活受體-γ (peroxisome proliferator-activated receptor,PPAR-γ)可促進Arg-1等M2特征性標志物表達。TGF-β也可通過JAK/STAT途徑促進 M2極化[14]。概括而言,轉錄因子STAT6對巨噬細胞M2極化至關重要,STAT6 抑制 STAT1,避免向M1型TAMs活化,抑制促炎細胞因子IFN-γ、TNF-α等產生。STAT6磷酸化激活后,促進干擾素調節因4(interferon regulatory factor 4,IRF4) 轉位入核,啟動M2相關基因表達。
腫瘤組織中募集了大量巨噬細胞,并趨向M2極化。腫瘤微環境中Th2樣細胞因子(IL-4、IL-13和IL-10),誘導TAM向M2極化,乳腺癌、卵巢癌肺癌等多種腫瘤細胞也分泌IL-4、IL-10和TGF-β等細胞因子,促進腫瘤組織中TAM向M2極化。研究表明,腫瘤組織中M2型細胞主要富集于缺氧區域,M1 型巨噬細胞則位于常氧區域。低氧誘導因子2α(hypoxia inducible factor 2α,HIF2α)參與實體瘤TAM誘導,TAM具有M2特征,不僅Arg1酶表達增加,NO等自由基減少,且VEGF、EGF和MMP-9表達增加[15]。腫瘤相關的表觀遺傳學變化和代謝產物參與巨噬細胞極化的調節,在缺氧的TAE中,巨噬細胞和腫瘤可發生代謝重編程,更多地依賴有氧糖酵解將葡萄糖轉換為能量。腫瘤細胞的有氧糖酵解可低效提供ATP,并伴隨乳酸等代謝產物增加,但代謝產物促進細胞骨架、蛋白和脂質的合成,有利于腫瘤細胞生長[16]。腫瘤微環境中TAM和癌細胞具有相似的表觀遺傳學變化,糖酵解形成的乳酸等產物可通過多種表觀遺傳學效應促進M2極化,主要包括DNA甲基化、組蛋白修飾和非編碼RNA調控[17]。甲基化轉移酶(methyltransferase,DNMT)催化DNA與甲基基團共價結合,腫瘤組織細胞和TAM均發現因DNMT1、DNMT3a和DNMT3b表達下降,而導致DNA低甲基化,進而促進M2極化。組蛋白修飾主要包括其甲基化、泛素化、乙酰化、磷酸化和ADP-核糖基化等,組蛋白甲基化Smyd2通過減少抑制IL-6和TNF-α表達,抑制M1極化;多種組蛋白修飾可通過促進Th2樣細胞因子表達使TAM向M2極化。
減少或逆轉TAM向M2型極化,對抑制腫瘤侵襲與轉移有重要意義。盡管巨噬細胞極化信號轉導復雜,TAM向M2極化主要受Th2樣細胞因子、代謝重編程和表觀遺傳機制的影響,理論而言是可逆轉和可調節的。有學者提出,M2b和M2c是M1型向M2型轉化的過度,通過促進M1極化可減少M2極化。免疫調節是真菌和植物多糖重要的藥理學活性。Th2和M2型巨噬細化參與哮喘發病,富含多糖的中藥湯劑炙甘草湯和四君子湯等常用于哮喘的治療,伴隨癥狀緩解,可發現局部組織中STAT6磷酸化減少[18,19]。前期工作中提取并分離不同分子量的水溶性炙甘草多糖,發現水溶性炙甘草的中等分子量多糖(MPRR)具有較強活化巨噬細胞的作用,能促進IFN-γ釋放,減少TGF-β釋放。為進一步研究MPRR是否可逆轉M2極化,本研究采用IL-4誘導小鼠RAW264.7 巨噬細胞,M2極化細胞IFN-γ分泌減少,CD86表達下降;而TNF-β分泌增加,CD206表達增加;將MPRR用于M2極化的巨噬細胞可減少CD206表達,促進CD86表達,增加IFN-γ分泌而減少TNF-β分泌。對STAT6表達和磷酸化分析,IL-4 促進STAT6(pTyr641),而MPRR可減少M2極化細胞內STAT6磷酸化。概括而言,MPRR可逆轉IL-4誘導的M2極化。MPRR也參與對巨噬細胞極化后吞噬功能的調節,其單獨作用促進巨噬細胞吞噬功能,誘導M2極化細胞再極化后也伴隨對其吞噬效應的增強。
腫瘤局部Th2通過釋放細胞因子促進癌細胞生長,而M2極化TAM不僅增加Th2樣細胞因子來源,并可通過MMP-9和VEGF等促進血管和淋巴管重塑;乳腺癌等腫瘤可釋放IL-10和TGF-β,參與腫瘤微環境中Th2偏移和TAM 向M2極化。除免疫細胞外,上皮細胞或乳腺癌等上皮源性腫瘤細胞也表達IL-4、IL-10和TGF-β等細胞因子的受體,Th2和M2極化細胞的旁分泌效應可促進癌細胞的生長[20]。本研究表明,M2極化巨噬細胞的培養上清液可促進小鼠4T1乳腺癌細胞增殖,而MPRR誘導組巨噬細胞的旁分泌作用對其生長有抑制作用;MPRR逆轉M2(IL-4誘導)極化后,也減弱其旁分泌促進乳腺癌細胞生長的效應。減少腫瘤微環境中M2型極化對減少炎-癌間的互相促進有重要意義。
概括而言,采用真菌和植物多糖不能直接殺傷腫瘤細胞,提示其可能通過對巨噬細胞 TAM極化的調節而一定程度改變有利腫瘤細胞生存的微環境。體內真實的腫瘤微環境中多種免疫細胞、組織細胞和腫瘤細胞自身均可分泌細胞因子,影響免疫細胞分化和腫瘤細胞表型。在體外研究的基礎上,尚需要通過體內研究來證實其免疫調節的活性。