環孢素A調節自噬對人滋養細胞氧化應激損傷的影響
徐秋霞,馬燕琳
0 引言
氧化應激是不良妊娠發生的關鍵因素,氧化應激狀態下活性氧(ROS)大量產生,損傷滋養細胞,引起胎盤淺著床等異常,導致胎兒宮內生長受限,以及相關的胎盤病理改變,如先兆子癇、死產和胎盤早剝等[1-2]。環孢素A(Cyclosporine A,CsA)是一種免疫抑制藥物,研究顯示,CsA可以促進絨毛滋養細胞增殖、運動、遷移和侵襲,可以顯著改善妊娠結局[3]。早孕期間滋養細胞處于生理缺氧和低營養狀態,在這種壓力環境下一種適應性線粒體自噬增強可以降低滋養細胞ROS水平,維持氧化和抗氧化平衡,保護細胞的完整性[4]。任何原因引起的這種平衡破壞都可以導致胎盤形成和發育異常,最終發生病理妊娠[5]。本研究使用永生化的人胎盤滋養細胞株HTR-8/SVneo,利用過氧化氫(Hydrogen peroxide,H2O2)構建氧化應激細胞模型,在此基礎上探討CsA對HTR-8/SVneo自噬的調節,以及CsA抗氧化對胎盤滋養細胞的保護作用。
1 材料與方法
1.1 主要試劑與儀器 人胎盤滋養細胞株HTR-8/SVneo購自中科院上海細胞生物科學研究所,DMEM/F12培養基、胎牛血清(Fetal bovine serum,FBS)購于美國Gibco公司,CsA購于美國Sigma公司,自噬體膜型(LC3-II)抗體和β-actin抗體購于美國Bioscience公司,丙二醛(MDA)、超氧化物歧化酶(SOD)和ROS檢測試劑盒購自南京建成生物工程研究所,RIPA蛋白裂解液、細胞凋亡流式細胞儀檢測試劑盒購自北京碧云天生物科技有限公司,細胞培養箱和全波長酶標儀購自美國Thermo公司,流式細胞儀為美國貝克曼庫爾特公司產品。
1.2 細胞培養 HTR-8/SVneo細胞培養于10% FBS的DMEM/F12培養基中,置于5% CO2、37 ℃細胞培養箱。
1.3 氧化應激細胞模型構建 按照李美和等[6]的方法構建H2O2氧化應激HTR-8/SVneo細胞模型,方法簡述如下:細胞接種于6孔板,2×105個細胞/孔,過夜培養細胞貼壁后,300 μmol/L H2O2處理HTR-8/SVneo細胞3 h,進行后續各項試驗。實驗分為對照組、氧化應激組、低劑量CsA組和高劑量CsA組,每組設置3個復孔。其中對照組不做任何處理,氧化應激組給予H2O2誘導氧化應激反應,低劑量CsA干預組在給予H2O2誘導氧化應激細胞模型前,使用2 μmol/L CsA預處理12 h,高劑量CsA干預組在給予H2O2誘導氧化應激細胞模型前,使用4 μmol/L CsA預處理12 h。
1.4 細胞凋亡檢測 胰酶消化后,收集上述四組細胞,按照細胞凋亡流式細胞儀檢測試劑盒說明書操作,加入熒光FITC標記的Annexin V和碘化丙啶(PI)避光染色1 h后,上流式細胞儀檢測,儀器自帶軟件分析凋亡細胞所占的比例,為Annexin V+和Annexin V+PI+2個區域的細胞。
1.5 MDA、SOD和ROS的檢測 MDA使用硫代巴比妥酸比色法檢測,SOD使用化學比色法檢測,ROS使用化學熒光法檢測(DCFH-DA熒光探針,熒光激發波長500 nm,接收波長532 nm),按照試劑盒說明書操作加入相關試劑,MDA和SOD對照標準品計算表達水平和活性單位,ROS記錄相對熒光光度值(Relative light units,RLU)。
1.6 自噬蛋白的Western blot檢測 胰酶消化后,收集上述四組細胞,1 000 g離心10 min,細胞沉淀中加入200 μl蛋白裂解液,100 ℃水浴20 min后,10 000 g離心20 min,取上清即為細胞總蛋白,SDS-PAGE凝膠電泳,每孔加入10 μl總蛋白,80 V電泳2 h分離蛋白后,電轉印至PVDF膜,5%脫脂牛奶封閉PVDF膜2 h后,按照抗體說明書加入LC3Ⅱ抗體(1∶1 000)或者β-actin抗體(1∶5 000)孵育過夜,加入辣根過氧化物酶標記二抗2 h后,顯影X光片曝光,掃描X光片,BandScan5.0軟件分析各條帶灰度值,對照內參β-actin,計算各樣品LC3Ⅱ的相對灰度值。
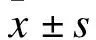
2 結果
2.1 CsA對氧化應激誘發滋養細胞凋亡的影響 對照組、氧化應激組、低劑量CsA組和高劑量CsA組HTR-8/SVneo細胞凋亡率分別為4.24%±0.72%、38.15%±4.63%、27.24%±3.16%、18.45%±2.28%,各組間比較差異有統計學意義(F=14.27,P<0.01)。其中低劑量CsA組和高劑量CsA組細胞凋亡率顯著低于氧化應激組(P<0.01),高劑量CsA組細胞凋亡率顯著低于低劑量CsA組(P<0.01)。見圖1。

圖1 細胞凋亡的流式細胞儀檢測
2.2 CsA對滋養細胞氧化應激的影響 對照組、氧化應激組、低劑量CsA組和高劑量CsA組HTR-8/SVneo細胞MDA、SOD和ROS間比較差異有統計學意義(P<0.01)。其中低劑量CsA組和高劑量CsA組細胞MDA和ROS顯著低于氧化應激組(P<0.01),高劑量CsA組細胞MDA和ROS低于低劑量CsA組(P<0.01),CsA組細胞SOD顯著高于氧化應激組(P<0.01),高劑量CsA組細胞SOD顯著高于低劑量CsA組(P<0.01)。見表1。

表1 四組MDA、SOD和ROS比較
注:與對照組比較,**P<0.01;與氧化應激組比較,△△P<0.01;與低劑量CsA組比較,##P<0.01
2.3 CsA對滋養細胞自噬蛋白的影響 對照組、氧化應激組、低劑量CsA組和高劑量CsA組HTR-8/SVneo細胞自噬蛋白LC3Ⅱ表達的相對灰度值分別0.23±0.05、0.11±0.02、0.38±0.07、0.75±0.13,各組間比較差異有統計學意義(F=15.11,P<0.01)。其中低劑量CsA組和高劑量CsA組細胞LC3Ⅱ蛋白相對灰度值顯著低于氧化應激組(P<0.01),高劑量CsA組LC3Ⅱ蛋白相對灰度值顯著低于低劑量CsA組(P<0.01)。見圖2。

圖2 LC3Ⅱ蛋白表達的Western blot檢測
3 討論
在早孕期間胎盤滋養細胞浸潤子宮肌層,改建子宮螺旋動脈,重塑血管內皮,將胎盤血管的“低排高阻”逐漸轉換為“低阻高排”狀態。早期的“低排高阻”狀態阻礙了母體血液進入胎盤,造成早孕期間生理性低氧和低糖環境,胎兒需要保持一個氧化與抗氧化平衡狀態才能正常發育。氧化應激是一種氧化與抗氧化失衡狀態,此時胎盤ROS生成過多,抗氧化物質產生減少,與流產、子癇前期等病理性妊娠的發生有密切關系[7]。
氧化應激損傷時ROS大量積累,ROS能氧化蛋白質、脂質和DNA,誘導細胞凋亡,本研究也觀察到,H2O2處理滋養細胞誘發氧化應激損傷后滋養細胞凋亡率顯著增加[8]。早孕期滋養細胞的生物學行為類似腫瘤細胞,研究顯示,CsA可以促進腫瘤增殖,滋養細胞增殖方式與腫瘤相似,提示CsA有可能促進滋養細胞增殖。Yu等[9]研究發現,CsA可以促進滋養細胞增殖和侵襲。CsA能夠與細胞漿內的環孢親和素結合蛋白高親和性結合,干擾和阻礙一些細胞因子的表達,調節免疫反應,有效抑制T細胞介導的細胞免疫應答,減弱機體對滋養細胞的排斥反應,促進細胞增殖和侵襲。Tang等[10]研究顯示,CsA可以通過FAK-Src通路抑制滋養細胞的氧化應激反應。本研究顯示,CsA干預后H2O2誘發的滋養細胞凋亡得到了顯著抑制,說明CsA對滋養細胞氧化應激損傷可以發揮保護作用。MDA、SOD和ROS是監控氧化應激的常用指標,MDA是氧化應激反應的代謝產物,SOD是一種抗氧化應激活性酶,本研究觀察到CsA干預后H2O2誘發的滋養細胞MDA和ROS升高得到了抑制,而SOD得到了顯著提升,上述結果進一步說明CsA可以發揮抗氧化應激損傷作用。
自噬可以參與滋養細胞的凋亡調控。早孕期滋養細胞的生理性低氧狀況下,自噬增強清除受損的線粒體和內質網,給細胞提供能量,保持細胞穩態[11]。研究顯示,抑制自噬可以誘導滋養細胞凋亡[12]。LC3Ⅱ是一個自噬標志蛋白,在自噬增強時LC3Ⅱ表達增多[13]。本研究顯示,CsA干預后LC3Ⅱ蛋白表達顯著高于氧化應激組,說明CsA可以增強滋養細胞的自噬,對滋養細胞凋亡的抑制可能與此相關。
綜上所述,本研究顯示,CsA可以增強滋養細胞自噬,對氧化應激損傷誘發的滋養細胞凋亡起到抑制作用。

