煙粉虱MEAM1隱種主要內共生菌的定位和分布
陳吉強 張毅波 張桂芬
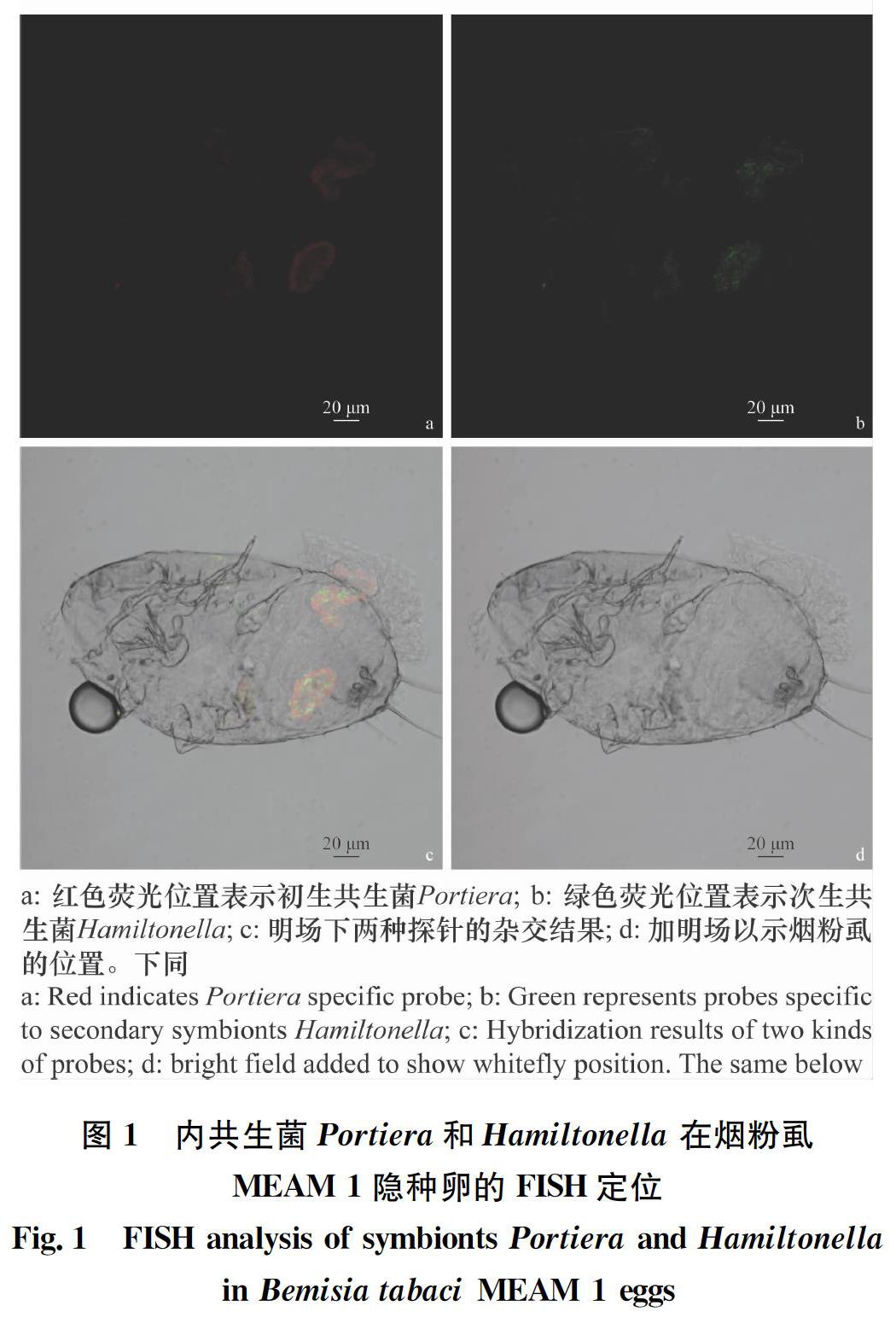
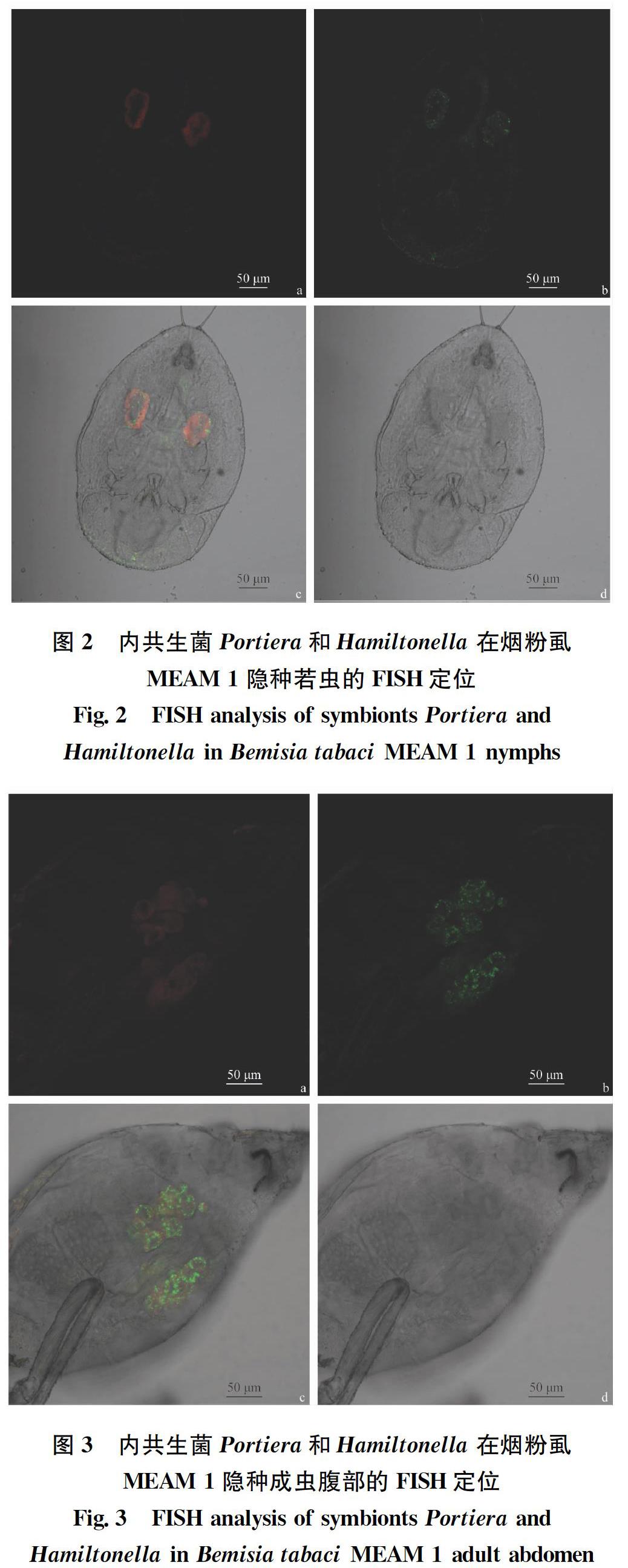

摘要 煙粉虱MEAM 1隱種是一種重要的世界性入侵害蟲,共生菌在其種群入侵和擴張中起著不可忽視的作用。本研究采用熒光原位雜交技術(FISH),明確其攜帶的初生共生菌(Candidatus Portiera aleyrodidarum)和次生共生菌(Candidatus Hamiltonella defensa和Rickettsia sp.)在不同發育階段蟲體中的定位和分布。結果顯示,煙粉虱MEAM 1隱種卵、若蟲和成蟲3個階段均攜帶3種共生菌,Portiera和Hamiltonella菌集中分布于含菌細胞中,其中Hamiltonella呈環形包裹于含菌細胞周邊;Rickettsia既在菌胞中呈“集中”分布,也“隨機”分布于蟲體其他部位或器官。上述結果明確了這3種共生菌在MEAM 1煙粉虱各個發育階段的分布特征,同時證明3種共生菌均能通過煙粉虱雌蟲垂直傳播,為進一步揭示內共生菌在煙粉虱入侵過程中的作用打下基礎。
關鍵詞 煙粉虱; 共生菌; 熒光原位雜交; 垂直傳播
中圖分類號: S 433.3 ?文獻標識碼: A ?DOI: 10.16688/j.zwbh.2019072
Abstract Bemisia tabaci (Gennadius) MEAM 1 is one of the most devastating invasive pests worldwide and its endosymbionts play an important role in the invasion and expansion of this pest insect. In this study, the fluorescence in situ hybridization (FISH) was used to identify the localization and distribution of the primary endosymbiont (Candidatus Portiera aleyrodidarum) and the secondary endosymbionts (Candidatus Hamiltonella defensa and Rickettsia sp.) in different developmental stages of B.tabaci MEAM 1. Three symbiotic bacteria were found in the eggs,nymphs,and adults of B.tabaci MEAM 1. Among them, Portiera and Hamiltonella were located inside the bacteriocytes and Hamiltonella around the bacteriocyte. Rickettsia was located both inside the bacteriocyte and randomly distributed in other parts or organs. These results revealed the distribution characteristics of the three endosymbionts in different developmental stages of B.tabaci MEAM 1, and provided evidence that all the three endosymbionts are vertically transmitted through the female of B.tabaci, and thus lay a foundation for further understanding the roles of endosymbionts in the invasion of B.tabaci.
Key words Bemisia tabaci; endosymbionts; fluorescence in situ hybridization; vertically transmitted
煙粉虱Bemisia tabaci (Gennadius)屬半翅目Hemiptera,粉虱科Aleyrodidae,是一種典型高度多食性的取食植物韌皮部汁液的世界性入侵害蟲。煙粉虱通過直接取食為害植物每年可導致數億美元的經濟損失,還可傳播100多種植物病毒及分泌蜜露污染植物[1-4]。煙粉虱被認為是一個獨特的,由超過35種形態上難以區分的隱種組成的復合種[5-9]。煙粉虱隱種以前被稱為生物型,其中在我國分布最廣泛的入侵種是B型和Q型,而B型也被稱為“中東-小亞細亞1”隱種(MEAM 1)或者Bemisia argentifolii,Q型也被稱為“地中海”隱種(MED)[10]。在過去的30年里,這兩個隱種在世界范圍造成了巨大的農業損失[11-12]。
煙粉虱MEAM 1隱種在20世紀90年代中期傳入我國,并且很快取代了中國本地種,而MED隱種于2003年第一次在我國云南昆明的觀賞性植物一品紅上被檢測到[13]。……

