馬鈴薯塊莖病原真菌拮抗菌株篩選及優良拮抗菌株鑒定
陳星伊 崔凌霄 楊成德
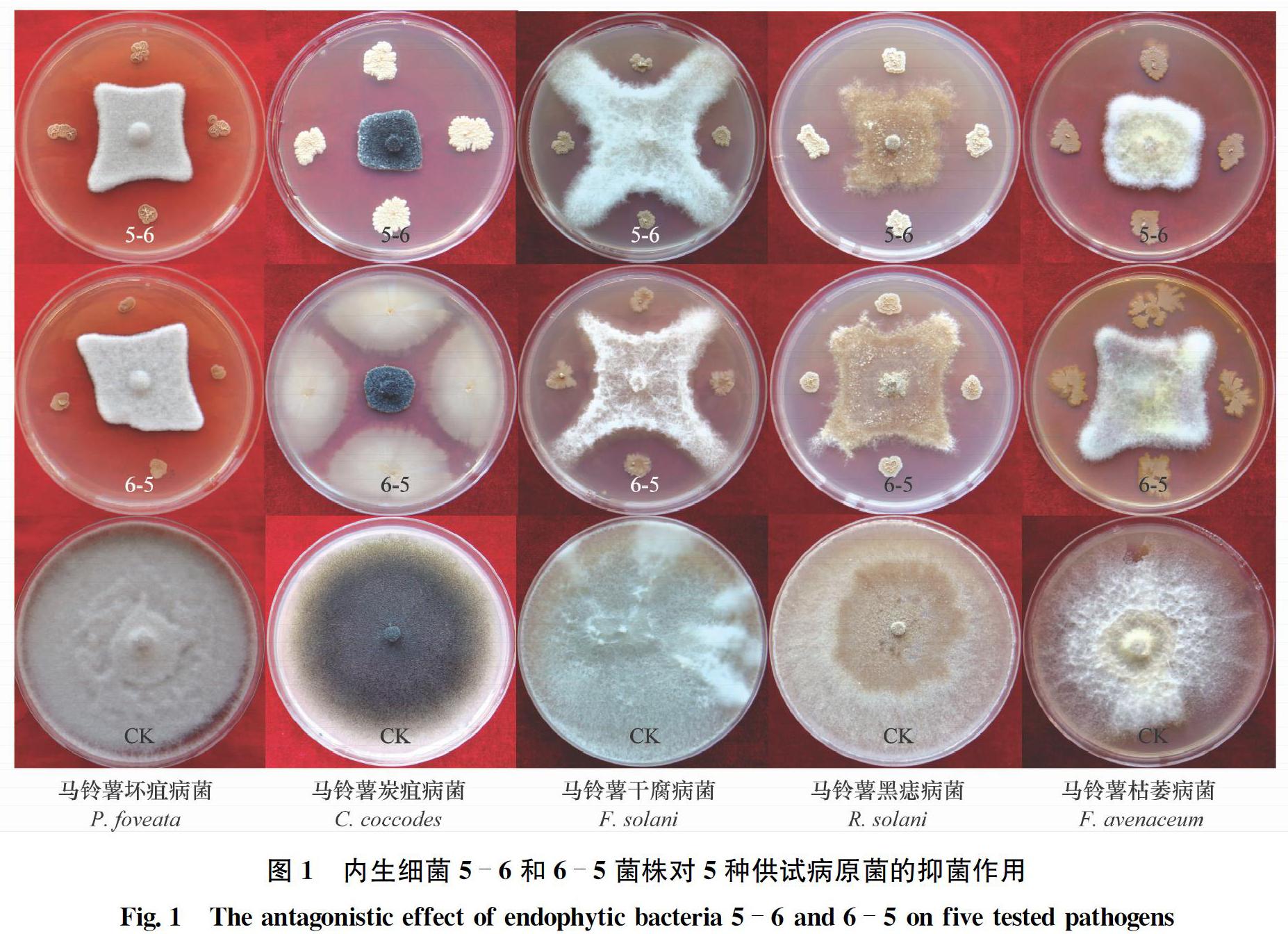


摘要 從馬鈴薯塊莖上分離內生細菌,以塊莖病原真菌為指示菌,采用平板對峙法篩選拮抗菌株,并利用形態學特征和 16S rDNA 基因序列分析對優良拮抗菌株進行鑒定。結果表明,從定西馬鈴薯塊莖中共分離得到72株內生細菌,其中19株對5種塊莖病原真菌的抑菌率均高于51.87%,特別是內生細菌6-5和5-6分別對馬鈴薯炭疽病菌Colletotrichum coccodes和馬鈴薯黑痣病菌Rhizoctonia solani的抑菌率達85.82%和72.18%,且具有固氮和產吲哚乙酸(IAA)功能,其產IAA量分別為3.37 mg/L和19.25 mg/L;根據形態特征及16S rDNA基因序列將菌株5-6鑒定為萎縮芽胞桿菌Bacillus atrophaeus,菌株6-5鑒定為貝萊斯芽胞桿菌Bacillus velezensis。
關鍵詞 馬鈴薯塊莖; 內生細菌; 分離; 抑菌功能; 鑒定
中圖分類號: S 476 ?文獻標識碼: A ?DOI: 10.16688/j.zwbh.2019017
Abstract In this study, endophytic bacteria were isolated from potato tubers, and tuber pathogenic fungi were used as indicator fungi. Antagonistic strains were screened by using tablet confrontation method, and excellent antagonistic strains were identified by morphological characteristics and 16S rDNA sequence analysis. The results showed that 72 endophytic bacteria were isolated from Dingxi potato tubers, and 19 of them had an inhibition rate of higher than 51.87% against 5 tuber pathogenic fungi; particularly, endophytic bacteria 6-5 and 5-6 had a bacteriostatic rate of 85.82% and 72.18% against Colletotrichum coccodes and Rhizoctonia solani, respectively. They had nitrogen fixation and IAA function, with an IAA yield of 3.37 mg/L and 19.25 mg/L, respectively. Based on morphological characteristics and 16S rDNA sequence, 5-6 and 6-5 were identified as Bacillus atrophaeus and Bacillus velezensis, respectively.
Key words potato tuber; endophytic bacteria; isolation; antibacterial function; identification
內生細菌 (endophyte)是指其生活史某一階段或全部階段生活于健康植物組織或器官的細胞間隙或細胞內的一類細菌,其可通過組織學方法從嚴格表面消毒的植物組織中分離獲得[1]。內生細菌可以通過抑菌、誘導產生次生代謝物、固氮、溶磷及產吲哚乙酸等多方面的有益生物功能,增強宿主植物抗病蟲害能力及生長競爭能力等[2-3]。內生細菌作為生防因子具有巨大優勢,是微生物資源開發應用中的又一資源庫。馬鈴薯是我國僅次于水稻、小麥和玉米的第四大農作物,且種植區域廣泛。2016年農業部又將馬鈴薯作為主糧作物進行產業化開發,使其已成為我國主要糧食作物和經濟作物。隨著馬鈴薯種植面積的擴大,其病害的發生也愈發嚴重,由于生物防治有諸多優點……

