血清hs-CRP、PCT 水平與PCOS 患者脂代謝的關系
常艷艷,桂俊豪,王瑞,戚佳茹,臘曉琳★
(1.新疆醫科大學第一附屬醫院,新疆 烏魯木齊;2.新疆軍區總醫院,新疆 烏魯木齊)
0 引言
多囊卵巢綜合征(PCOS)困擾著6%~12%的育齡期婦女[1],患者多因月經紊亂、不孕或痤瘡而就診。PCOS 的臨床表現各不相同,以高雄、排卵功能障礙和卵巢多囊樣外觀為主,除此之外,肥胖、內臟脂肪量增多、血脂異常、糖代謝障礙、炎癥反應也是該綜合征的常見特征。PCOS 的明確病因尚不清楚,可能受遺傳和環境因素相互影響。自2001 年PCOS 的炎癥發病機制被闡述后,陸續有研究證實了慢性炎癥參與了PCOS 的內分泌和代謝紊亂過程。本研究通過比較PCOS 患者兩種炎癥標記物的變化及表達特點,嘗試探討炎癥機制與PCOS 患者脂代謝紊亂的關系。
1 資料與方法
1.1 研究對象
本病例對照研究中,前瞻性隨機選擇2018 年12 月至2019 年12 月在新疆軍區總醫院門診就診的68 例PCOS 患者作為PCOS 組,其中BMI>25 kg/m2為P1 組,BMI<25 kg/m2為P2 組;選擇同期就診行優生檢查的52 例非PCOS 女性作為對照組。其中BMI>25 kg/m2為N1 組,BMI<25 kg/m2為N2 組。所有受試者年齡均在20~35 歲。本研究方案通過了醫院生殖醫學倫理委員會審查,征得了所有受試者的知情同意并簽字。
1.2 納入及排除標準
1.2.1 納入標準
PCOS 組嚴格采用國際統一的鹿特丹診斷標準,即:①稀發排卵或者無排卵;②臨床和(或)生化表現為高雄激素癥;③卵巢多囊樣改變,上述3 項中符合2 項即可診斷。同時需要排除其他高雄表現的疾病,比如:庫欣綜合征、先天性腎上腺增生、分泌雄激素的腫瘤、外源性雄激素增多等。對照組納入標準:要求排除PCOS 診斷,月經規律、性激素正常、無高雄的臨床表現,超聲檢查提示卵巢體積<10 mm3,單側卵巢竇卵泡數量<12 枚,子宮及雙側附件區無異常聲像改變。
1.2.2 排除標準
采樣前3 個月以內使用過抗生素、免疫抑制劑、激素藥物,以及對血糖、血脂、血壓有影響的藥物;患有上呼吸道感染、結核、克羅恩病、潰瘍性結腸炎、類風濕性關節炎、系統性紅斑狼瘡等急慢性炎性疾病;患有高血壓、高泌乳素血癥、子宮內膜異位性疾病、甲亢等特殊疾病。
1.3 研究方法
1.3.1 標本采集
所有對象在月經第2~4 天清晨空腹采集靜脈血10 mL,用EP 管分裝離心后的血清標本,置于-80 ℃超低溫保存,待測。
1.3.2 檢測方法
超敏C 反應蛋白(hs-CRP)采用美國貝克曼庫爾特公司提供的特定蛋白分析儀及試劑盒檢測;降鈣素原(PCT)使用德國羅氏診斷公司提供的電化學發光免疫分析儀及試劑盒檢測;總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)采用德國羅氏診斷公司提供的全自動生化儀及試劑盒檢測。所有檢測均嚴格按照試劑盒內說明書進行。
1.4 統計學處理
采用SPSS 25.0 統計軟件進行數據分析處理,對各組資料進行正態性檢驗和方差齊性檢驗,正態分布的計量資料數據以均數±標準差()表示,非正態分布的計量資料用中位數(四分位數間距)表示。組間比較采用兩獨立樣本t 檢驗或秩和檢驗,各因素間的關系采用Spearman 秩相關分析,以P<0.05 表示差異有統計學意義。
2 結果
2.1 一般性資料
表1 顯示PCOS 組與對照組比較年齡、收縮壓、舒張壓、BMI 無統計學差異(P>0.05),PCOS 組腰臀比(WHR)顯著高于對照組(P<0.05)。
表1 PCOS 組和對照組一般性臨床資料的比較

表1 PCOS 組和對照組一般性臨床資料的比較
注:WHR:腰臀比,*P<0.05,與對照組比較。
組別 年齡(歲)SBP(mmHg)DBP(mmHg)BMI(kg/m2) WHR PCOS 組(n=68)27.75±2.91 113.18±11.22 74.79±8.18 24.34±3.94 0.86±0.06*對照組(n=52)27.92±2.79 114.10±9.62 76.35±6.66 23.90±4.49 0.83±0.06
2.2 血脂及炎癥指標
表2 顯示,P1 組分別與P2 組、N1 組兩兩比較,P1組 的TC、TG、LDL-C、hs-CRP 和PCT 水 平 均 顯 著 升高(P<0.05),HDL-C 水平均顯著降低(P<0.05);N1 組與N2 組比較,N1 組的TC、TG、LDL-C、hs-CRP 和PCT 水平顯著升高(P<0.05),HDL-C 水平降低,但尚未達到統計學意義(P>0.05);P2 組與N2 組比較,P2 組的TC、TG、LDL-C、hs-CRP 和PCT 水平升高,HDL-C 水平降低,但差異尚未達到統計學意義(P>0.05)。
表2 血脂及炎癥指標
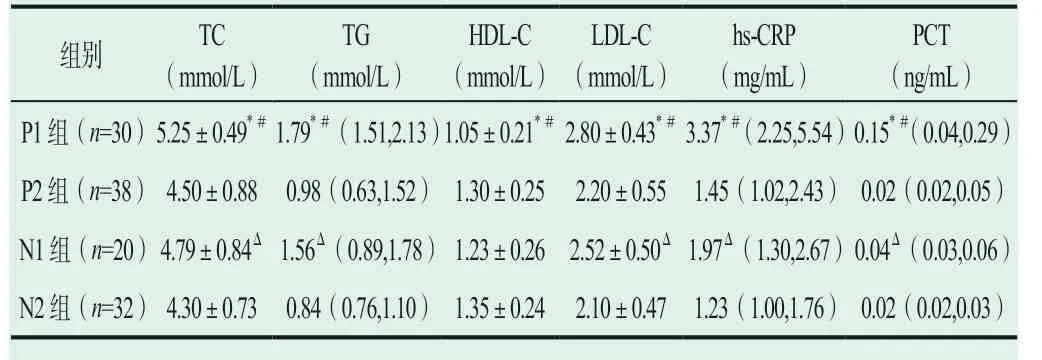
表2 血脂及炎癥指標
注:TC:總膽固醇;TG:甘油三酯;HDL-C:高密反應度脂蛋白膽固醇;LDL-C:低密度脂蛋白膽固醇;hs-CRP:超敏C 反應蛋白;PCT:降鈣素原,*P<0.05,與P2 組比較,#P<0.05,與N1 組比較,ΔP<0.05,與N2 組比較。
組別 (mm TC ol/L) (mm TG ol/L) (m HD m L ol-/C L)(m LD m Lo-l/C L) (hms-gC/m RLP)(n PgC/m T L)P1 組(n=30)5.25±0.49*#1.79*#(1.51,2.13)1.05±0.21*#2.80±0.43*#3.37*#(2.25,5.54)0.15*#(0.04,0.29)P2 組(n=38)4.50±0.88 0.98(0.63,1.52) 1.30±0.25 2.20±0.55 1.45(1.02,2.43)0.02(0.02,0.05)N1 組(n=20)4.79±0.84Δ 1.56Δ(0.89,1.78)1.23±0.26 2.52±0.50Δ 1.97Δ(1.30,2.67)0.04Δ(0.03,0.06)N2 組(n=32)4.30±0.73 0.84(0.76,1.10) 1.35±0.24 2.10±0.47 1.23(1.00,1.76)0.02(0.02,0.03)
2.3 相關性分析
表3 顯示,PCOS 患者血清hs-CRP、PCT 表達水平均與BMI、WHR、TC、TG、LDL-C 呈顯著正相關性(P>0.05),與HDL-C 呈顯著負相關(P<0.05)。

表3 炎癥標志物與各指標的相關性分析
3 討論
PCOS 是一種合并有肥胖、胰島素抵抗、脂代謝障礙的代謝性疾病[2]。脂肪的堆積是代謝綜合征的核心環節,脂肪組織除了可以儲存和釋放能量外,其在代謝調節、生理穩態和免疫功能方面也發揮著廣泛作用。體內脂肪尤其是內臟脂肪過多蓄積,將加重患者代謝紊亂[3]。脂代謝障礙是PCOS中最常見的代謝紊亂,發生率約為70%[4],主要表現為腹圍增加和高脂血癥[5]。本研究結果顯示,同樣的BMI 分組條件下,PCOS 組與對照組比較,PCOS 患者存在明顯的血脂異常,主要表現為高表達水平的總膽固醇(TC)、甘油三酯(TG)和低密度脂蛋白(LDL-C),低表達水平的高密度脂蛋白(HDL-C),這種差異尤其在肥胖組中更顯著,具有統計學意義。同時肥胖對照組與非肥胖對照組比較,血脂表達水平也有同樣的顯著差異。說明脂代謝異常是PCOS 突出的臨床表現,肥胖將加重脂代謝紊亂,同時肥胖也是脂代謝異常的獨立影響因素。
慢性炎癥被大量研究證實是PCOS 可能的發病機制,并與肥胖、高雄激素血癥、胰島素抵抗、糖尿病、脂代謝障礙等密切相關。C 反應蛋白(CRP)是一種炎癥反應的敏感指標,也是心血管疾病發病率最敏感的預測因子之一。有證據表明CRP 與胰島素抵抗、體重及脂肪量呈正相關。一項薈萃分析顯示[6],PCOS 患者無論體重如何CRP 均明顯增高,這一發現為PCOS 慢性低度炎癥的發病機制提供了有利的分析證據。降鈣素原(PCT)是降鈣素的前體,由甲狀腺濾泡旁細胞、脂肪細胞分泌,機體或組織器官受到炎癥刺激時可增高[7]。近年來陸續有研究發現PCT 在慢性低度炎癥狀態也會出現增高。一項對107 名PCOS 患者和93 名健康志愿者的對照研究發現,PCOS 患者血清PCT、hs-CRP、WBC 計數明顯高于健康婦女,且隨著體重增加升高愈加明顯;同時血清PCT 水平與BMI、腰臀比(WHR)、TC、TG 呈正相關。提示PCOS 機體內存在慢性炎癥反應,且PCT 是一種新的生物標志物[8]。我們的研究也有類似的結果,發現PCOS 患者的hs-CRP 和PCT 表達水平顯著高于對照組,且這兩種炎癥標志物的表達水平與BMI、WHR、TC、TG、LDL-C 呈顯著正相關,與HDL-C 呈顯著負相關,提示PCOS 存在慢性炎癥反應,隨著體重增加,代謝紊亂加重慢性炎癥反應越重。同時hs-CRP 和PCT 水平在肥胖對照組與非肥胖對照組間也存在顯著差異,說明BMI 也是炎癥反應的獨立影響因素。
綜上所述,PCOS 女性體內炎癥標志物hs-CRP 和PCT顯著升高,提示機體處于慢性炎癥狀態,且慢性炎癥與PCOS的脂代謝紊亂相互影響,密不可分。鑒于此,對PCOS 患者及時開展脂代謝狀況監測評估,并采取有效減重、減脂干預措施,有助于降低PCOS 患者并發心血管疾病的風險,也可為PCOS 的抗炎治療提供新思路。

