miR-133靶向NLRP3對小鼠Kupffer細胞炎性活化的影響*
徐秀亮, 楊江華, 盛皓宇, 梁曼曼, 陳 聰, 魯 稻, 江啟貴
(1池州市人民醫院感染科,安徽池州247000;2皖南醫學院附屬弋磯山醫院感染病科,安徽蕪湖241001)
庫普弗細胞(Kupffer cells,KCs)是肝臟中介導炎癥反應的單核-巨噬細胞群,可吞噬異物,可生成炎癥因子導致肝細胞損傷,其持續激活可促使非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)等發生[1]。而NAFLD可誘發肝臟脂肪變性和脂肪纖維化,最終導致肝硬化和肝癌,危害嚴重[2]。因此,減輕KCs介導的肝損傷可緩解疾病。微小RNA(microRNA,miRNA,miR)參與炎癥、肝細胞損傷和肝纖維化等過程[3],肝損傷和肝纖維化的乙型肝炎肝組織中miR-133高表達可能會介導慢性炎癥影響疾病進程[4],但miR-133在KCs中的作用尚未見報道。本研究通過分離小鼠KCs,并經脂多糖(lipopolysaccharide,LPS)誘導,探究 miR-133在KCs炎性活化中的作用。
材料和方法
1 動物
清潔級BALB/c小鼠,雄性,6~9周,體重(15~22)g,購自北京維通利華實驗動物技術有限公司,許可證號為SCXK(京)2017-0021,飼養條件:溫度(21±1)℃、濕度(50±10)%,光照/黑暗(12 h/12 h),自由飲水飲食。
本實驗經池州市人民醫院動物倫理委員會審核并批準。
2 藥品、試劑及儀器
LPS(貨號為 L4391-1MG)購自 Sigma;miR-133 inhibitor NC、miR-133 inhibitor、miR-133 mimic NC、miR-133 mimic、Lipofectamine 2000、核苷酸結合寡聚化結構域樣受體蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)3′UTR-WT和NLRP3 3′UTR-MUT均由廣州銳博生物設計并合成;引物由上海生工生物有限公司合成。TIANscript RT Kit(貨號為 KR104)和 miRNA First Strand cDNA Synthesis Kit(貨號為KR211)購自北京天根生化科技有限公司;小鼠白細胞介素1β(interleukin-1β,IL-1β)和腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)酶聯免疫吸附測定(enzyme-linked immunosorbent assay,ELISA)試劑盒、兔抗鼠NLRP3抗體、兔抗鼠含胱天蛋白酶募集結構域的凋亡相關斑點樣蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)抗體、兔抗鼠caspase-1抗體和兔抗鼠GADPH抗體均購自Abcam,貨 號 分 別 為 ab9722、ab1793、ab214185、ab175449、ab1872和ab181602;雙螢光素酶報告基因檢測試劑盒(貨號為D0010)由北京索萊寶科技有限公司生產。
實時熒光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)儀由ABI生產,型號為7500;全自動凝膠成像分析系統購自深圳市三利化學有限公司,型號為ZF-388。
3 方法
3.1 小鼠肝臟KCs的分離和培養 實驗前DMEM培養液添加10%胎牛血清、1×105U/L青霉素和100 mg/L鏈霉素混勻,置于4℃冰箱中制成DMEM完全培養液待用。采用膠原酶原位灌注加雙層梯度離心法獲得小鼠KCs[5]:麻醉小鼠分離消化肝臟,200目濾網過濾后加100μL PBS稀釋,1∶1加50%等滲Percoll溶液(stock isotonic Percoll,SIP)制成25%SIP,150×g離心15 min,分層由上往下為細胞碎片層、25%SIP層、KCs層、50%SIP層和其它層,小心吸取KCs置于新的EP管中,PBS稀釋,1 200 r/min離心5 min,沉淀為KCs。KCs置于DMEM完全培養液中,在37℃、CO2培養箱培養,細胞分離6 h后加碳素墨水(終體積分數為0.5%)再培養1 h,于顯微鏡下觀察細胞吞噬情況。
3.2 細胞分組 將經鑒定正確的細胞培養至對數生長期,分為正常(control)組、模型(model)組、miR-133 inhibitor對照(miR-133 inhibitor NC)組、miR-133 inhibitor組、miR-133 mimic對照(miR-133 mimic NC)組和miR-133 mimic組。除正常組外,其余各組添加1 mg/L LPS誘導[6],各組參照Lipofectamine 2000說明書分別轉染miR-133 inhibitor NC、miR-133 inhibitor、miR-133 mimic NC和miR-133 mimic,培養24 h鑒定各組細胞中miR-133水平。
3.3 RT-qPCR法檢測細胞中miR-133和NLRP3的mRNA水平 細胞培養24 h后,RNA提取試劑盒提取細胞總RNA,miRNA First Strand cDNA Synthesis Kit、TIANscript RT Kit將其逆轉錄成第1鏈cDNA。miR-133的上游引物序列為5'-CAGCTGGTTGAAGGGGACCAAA-3′,下游引物序列為5'-GGTGGCTTATGTTTGTAATCCC-3′;U6的上游引物序列為5'-ATATGGACGCTTCAATT-3′,下游引物序列為5'-AACGCTTCACGAATTTGCGT-3′;NLRP3的上游引物序列為 5'-GACCATCGGCCGGACTAAAA-3′,下游引物 序 列 為 5'-CTTGCACACTGGTGGGTTTG-3′;GAPDH的上游引物序列為5'-GGTTGTCTCCTGCGACTTCA-3′,下 游 引 物 序 列 為 5'-CCCTAGGCCCCTCCTGTTAT-3′。RT-qPCR 體系:10 μL 2×SYBR qPCR Mix,1 μL cDNA(40 ng/L),上、下游引物(10μmol/L)各0.5μL,8μL ddH2O。反應條件:94℃120 s;95℃ 40 s,62℃ 35 s,共 45 個循環。2-ΔΔCt法計算miR-133和NLRP3相對表達水平。
3.4 ELISA檢測細胞培養液中炎癥因子IL-1β和TNF-α水平 鑒定成功各組細胞,收集細胞培養液,300×g離心5 min收集上清,分裝置于4℃冰箱待用。嚴格按照小鼠IL-1β和TNF-αELISA試劑盒說明書檢測上清液中IL-1β和TNF-α水平。
3.5 Westerm blot實驗檢測細胞中NLRP3、ASC和caspase-1蛋白水平 按3.2培養細胞并鑒定成功,每孔加200μL蛋白裂解液冰上裂解15 min,10 000×g離心20 min,上清為總蛋白。凝膠電泳分離蛋白質后轉膜;5%脫脂奶粉室溫封閉2 h;加入各種Ⅰ抗(抗NLRP3、ASC、caspase-1和GADPH抗體),4℃孵育過夜;加入相應Ⅱ抗,室溫孵育1 h。DAB顯色試劑盒避光顯色,全自動凝膠成像分析系統拍照和定量分析。
3.6 雙螢光素酶鑒定miR-133與NLRP3的靶向關系 用TargetScan查找NLRP3 mRNA的3′-UTR與miR-133結合位點。設計合成NLRP3的3′UTR-WT和 3′UTR-MUT,分別與 miR-133 mimic 或 miR-133 mimic NC共轉染,雙螢光素酶報告基因檢測試劑盒檢測各組螢光素酶相對活性。
4 統計學處理
采用統計學軟件GraphPad Prism 8.0進行數據分析,計量數據以平均數±標準差(mean±SD)描述,兩兩比較采用SNK-q法。以P<0.05為差異有統計學意義。
結 果
1 LPS對KCs的影響
培養4 h的KCs呈圓形,細胞邊緣有較強的折光現象;隨著培養時間的延長,培養至24 h時KCs呈星形,細胞開始向周圍伸展;培養至72 h時KCs呈長梭形,體積較24 h時較大,邊界清晰,見圖1A。細胞中可見大量黑色顆粒,該顆粒是添加碳素墨水后的碳顆粒,證明該細胞具有較強的吞噬功能,該細胞即為KCs,見圖1B。與正常組相比,模型組細胞中miR-133水平降低(P<0.05);與模型組、miR-133 inhibitor對照組和miR-133 mimic對照組相比,miR-133 inhibitor組細胞中miR-133水平降低(P<0.05),miR-133 mimic組細胞中miR-133水平升高(P<0.05),見圖1C。
2 miR-133在LPS作用于KCs后對炎癥的影響
與正常組相比,模型組細胞中NLRP3 mRNA水平、培養液中IL-1β和TNF-α水平及NLRP3和caspase-1蛋白水平升高(P<0.05);與模型組、miR-133 inhibitor對照組和miR-133 mimic對照組相比,miR-133 inhibitor組細胞中NLRP3 mRNA水平、培養液中IL-1β和TNF-α水平及NLRP3和caspase-1蛋白水平升高(P<0.05),miR-133 mimic組細胞中 NLRP3 mRNA水平、培養液中IL-1β和TNF-α水平及NLRP3和caspase-1蛋白水平降低(P<0.05),見圖2。
3 雙螢光素酶驗證miR-133與NLRP3的靶位點
TargetScan分析發現,NLRP3 mRNA 的 3′-UTR含有miR-133序列保守堿基。螢光素酶實驗結果顯示,與 miR-133 mimic NC+3′UTR-WT 組相比,miR-133 mimic+3′UTR-WT組細胞螢光素酶相對活性下降(P<0.05),見圖3。
討 論
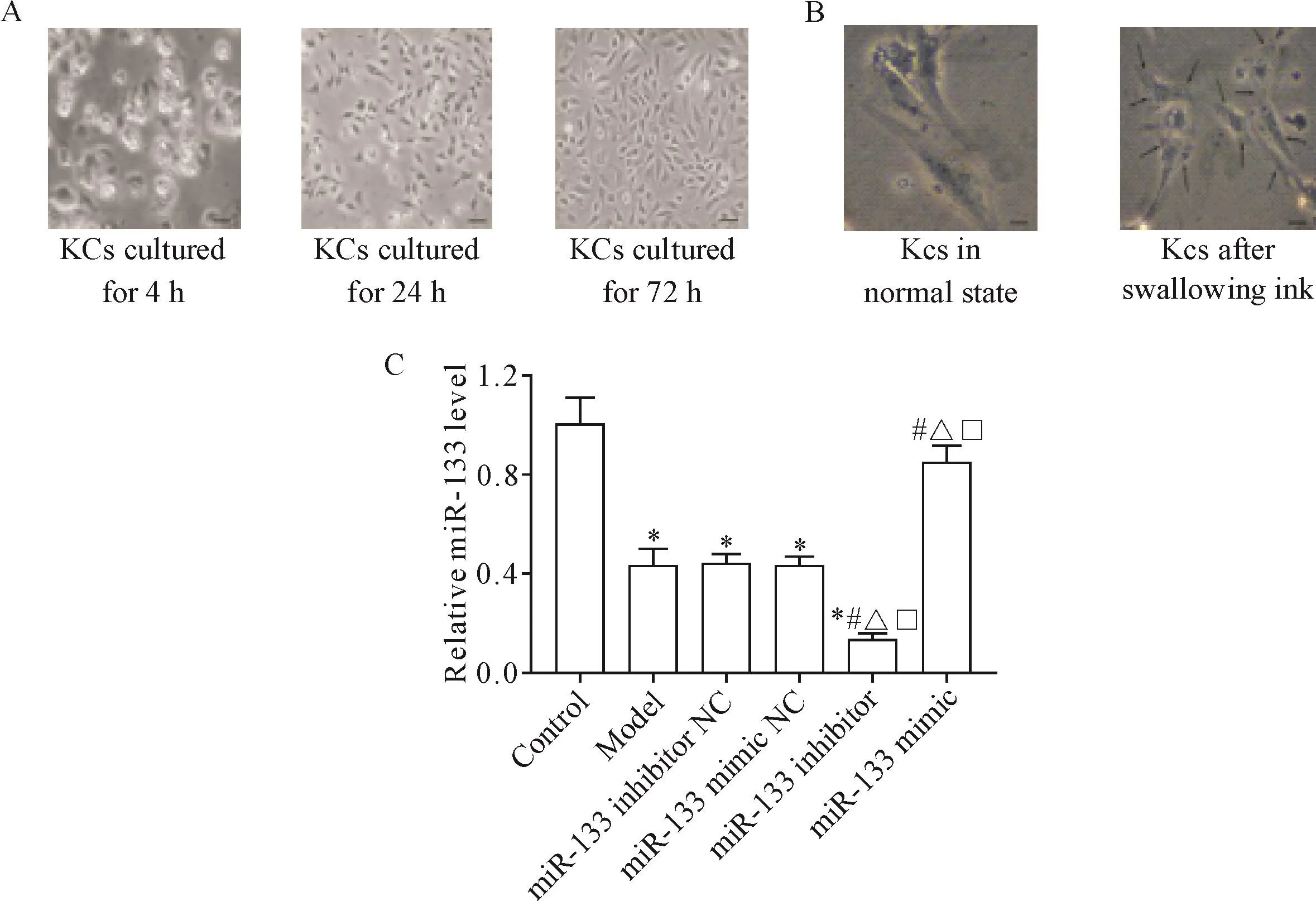
Figure 1.Influence of LPSon KCS.A:the shape of KCs(scale bar=100μm);B:identification of KCs(scale bar=50μm;black arrows indicate carbon particles);C:expression level of miR-133 in cells of each group.Mean±SD.n=6.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs miR-133 inhibitor NCgroup;□P<0.05 vs miR-133 mimic NCgroup.圖1 LPS對KCs的影響
miRNA靶向mRNA參與炎癥反應應用廣泛,可直接降解靶基因mRNA或抑制靶基因翻譯實現轉錄后的基因沉默[7-9],其中miR-133屬常見miRNA,包括miR-133a和miR-133b兩個成員,miR-133a在肝纖維化中具有抗纖維化作用,對肝臟起保護作用[10];在炎癥誘導的大腸癌中表達下調,可能參與從腸道炎癥到癌變過程[11]。miR-133b在肝癌中水平降低,在肝損傷期間產生新的肝細胞反應中起著作用[12];在變應性鼻炎小鼠鼻粘膜中表達下調,上調miR-133b通過靶向NLRP3可改善鼻摩擦、打噴嚏的頻率以及細胞因子TNF-α、IL-4、IL-5和IFN-γ水平從而緩解變應性炎癥和過敏癥狀[13]。推測miR-133影響疾病發生。本研究顯示,與正常組相比,模型組細胞中miR-133水平降低,提示miR-133在LPS誘導的KCs炎癥中表達下調,可能參與NAFLD炎癥及肝損傷過程,但其具體機制尚不清楚。與miR-133 inhibitor對照組相比,miR-133 inhibitor組細胞中miR-133水平降低;與miR-133 mimic對照組相比,miR-133 mimic組細胞中miR-133水平升高,本研究miR-133轉染成功。miR-133轉染情況不同,可能影響靶基因表達從而影響參與疾病反應。
NLRP3屬目前研究較多的炎癥小體,NLRP3炎癥小體激活誘導肝臟炎癥和纖維化的介質[14-15],在LPS誘導的小鼠炎癥性肝損傷中抑制NLRP3表達可降低肝臟中IL-1β、IL-18、IL-6和TNF-α水平,緩解炎癥,減輕肝損傷[16]。本研究顯示,與對照組相比,模型組細胞中NLRP3 mRNA和蛋白水平升高,提示LPS誘導可激活NLRP3,活化后的NLRP3發揮致炎作用。進一步研究TargetScan預測檢測到NLRP3 mRNA的3′UTR含有miR-133序列保守堿基,螢光素酶實驗驗證miR-133與NLRP3存在直接靶向結合位點,miR-133可通過直接靶向NLRP3而發揮作用。NLRP3激活后募集ASC并活化caspase-1,進而發揮致炎作用[17]。caspase-1可促進分泌IL-1β和TNF-α的分泌,從而加重炎癥反應[18]。IL-1β在NAFLD中高表達,高水平IL-1β可增加NAFLD實質損害和脂肪性肝炎[19];抑制TNF-α可改善NAFLD腸道微生態系統,可能導致調節血糖,脂質代謝和保護肝臟免受NAFLD損害[20]。本研究表明,與對照組相比,模型組細胞中caspase-1蛋白水平及細胞培養液中IL-1β和TNF-α水平升高,炎癥反應劇烈;降低miR-133水平可激活NLRP3,增加caspase-1活化,加重炎癥反應;升高miR-133水平則降低炎癥因子IL-1β和TNF-α各水平,減弱炎癥反應,實現對KCs的保護。
綜上所述,miR-133在KCs炎癥活化中低表達,增加miR-133水平可通過靶向NLRP3減輕小鼠KCs炎癥,實現對KCs的保護作用。本文首次證實miR-133在LPS誘導的KCs中低表達,高表達miR-133可通過靶向NLRP3發揮抑制炎癥作用。但本文只在細胞水平上初步探討miR-133在KCs中的作用情況,是否對臨床是否有意義尚需深入研究。
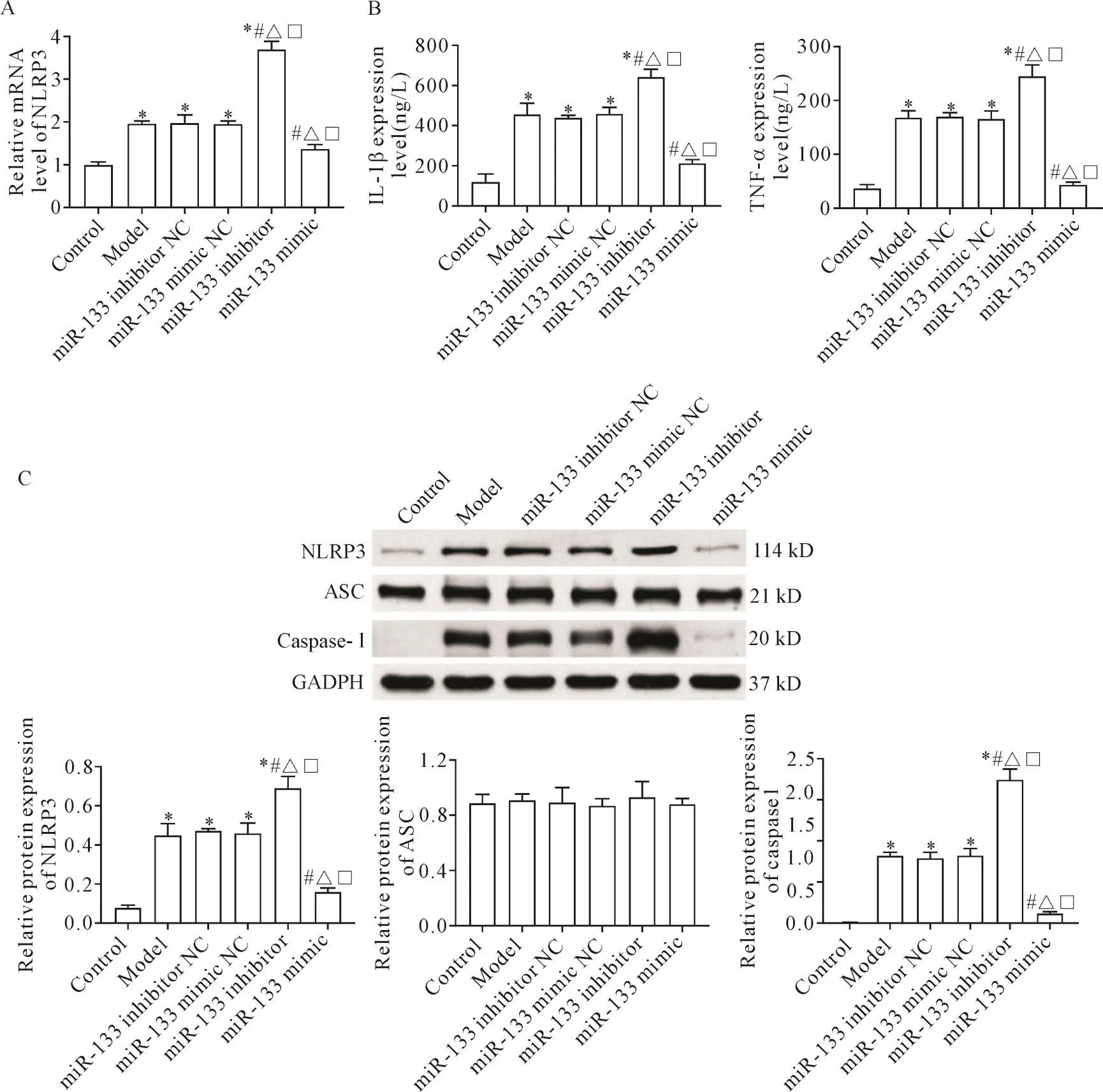
Figure 2.The effect of miR-133 on inflammation of KCs after LPSinduction.A:the mRNA expression level of NLRP3 in cells of each group;B:the levels of IL-1β and TNF-α in cell culture medium of each group;C:the protein levels of NLRP3,ASC and caspase-1 in each group.Mean±SD.n=6.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs miR-133 inhibitor NCgroup;□P<0.05 vs miR-133 mimic NCgroup.圖2 miR-133在LPS作用于KCs后對炎癥的影響

Figure 3.Target relationship verification between miR-133 and NLRP3.A:TargetScan prediction results;B:luciferase experimental verification results.Mean±SD.n=6.*P<0.05 vs miR-133 mimic NC+3′UTR-WTgroup.圖3 miR-133與NLRP3的靶向關系驗證

