馬鈴薯V型ATP酶E亞基基因的生物信息學分析
龐鵬湘,郜 剛
(山西師范大學生命科學學院,山西 臨汾 041000)
V 型ATP 酶(V-type ATPase,以下簡稱V-ATP酶)主要存在于真核生物膜系統中,通過將氫離子轉運到囊泡或胞外,酸化細胞環境,以溶酶體和高爾基體2 種細胞器參與其內吞途徑[1],其利用ATP 水解的能量轉化為電化學勢能,進而介導氫離子的跨膜轉運[2]。該酶在植物中的研究以擬南芥居多。在擬南芥中,至少有26 個基因編碼了全酶的12 個亞基[3]。研究發現該酶在擬南芥不同的部位所行使的功能具有很大的差異。如:V-ATP 酶C1 亞基在膨大的子葉、黃化幼苗下胚軸、根伸長區中的表達,支持了V-ATP 酶在細胞體積增大中的作用;在根冠,V-ATP 酶影響根系的生長以及對中度鹽脅迫的耐受性[4]。同時研究發現ATP 酶B亞基可能參與擬南芥花粉萌發、花粉管生長、細胞內物質流動和細胞應急脅迫、質子傳遞等生殖生物學過程[5]。在對蝴蝶蘭的研究中發現V-ATP酶E亞基在抵抗低溫脅迫中有重要作用。
在擬南芥中,V-ATP酶E亞基有3個亞型,各亞型間在功能上具有不同程度的特化,其中AtVHA-E1 是胚胎發育表達的主要亞型,而AtVHA-E2是花粉特異表達亞型,在配子體發育中具有專一性但又不是必需的,主要在發育種子的胚乳及周圍組織中表達的是AtVHA-E3亞基。對突變體研究表明,AtVHA-E3 能夠恢復AtVHA-El 缺失的表型,而AtVHA-E2卻不能。
目前,沒有太多的V-ATP 酶在馬鈴薯中的表達、功能等相關研究。有文章報道,在馬鈴薯中克隆一個V-ATP酶,使用對照和150 mmoL NaCl耐受性愈傷組織系的Tonoplast 富集囊泡作為模型系統來研究其活性以及參與液泡作為馬鈴薯耐鹽機制。結果發現液泡膜上的pH 梯度和Na+/H+反向物質對鹽的響應增加強烈,使得Na+隔離到液泡,在這個過程中V-ATP 酶發揮一定的催化作用,推論該酶有助于馬鈴薯耐鹽性的表現[4]。
利用分子生物學公用數據庫,對基因的分子生物學特性、生化特性進行分析,預測其蛋白質的結構。本研究以馬鈴薯幼苗為材料,克隆了V型ATP 酶E 亞基基因的全長,并對其序列進行分析,為下一步驗證馬鈴薯V-ATP 酶E 亞基基因的功能及在青枯菌脅迫中的分子調控機制研究奠定基礎。
1 材料與方法
1.1 V型ATP酶E亞基基因的電子克隆
將實驗室前期工作中獲得的一條受青枯菌誘導上調表達的馬鈴薯(基因型為ED13)的EST序列,在NCBI 中運行BLASTn 程序[6]。作為Query 的EST 與NCBI 數據庫中XM006352196.2 基因相似最高為98%。通過Bioedit軟件將序列拼接,直到不能延伸為止。
1.2 V型ATP酶E亞基基因編碼蛋白質的生物信息學分析
用在線服務器NCBI ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析核酸序列的開放閱讀框。通過NCBI Conserved domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)預測相關的V-ATP酶的保守結構域;運用ProtParam(http://www.expasy.org/cgi-bin/ProtParam.pl)和ProScale(http://www.expasy.org/cgi-bin/Protscale.pl)[7]進行分析蛋白的分子量(Molecular weight)、等電點(Theoretical pI)、親水性平均系數(Grand average of hydropathicity,GRAVY)、不穩定指數(Instability index)和脂溶指數(Aliphatic index)。CBS服務器的SignalP4.1 server 系統(http://www.cbs.dtu.dk/services/SignalP/)用來分析信號肽[8]。利用WOLF(PSORThttps:/ /wolfpsort.hgc.jp/)和TargetP2.0 Serverr(http ://www. cbs. dtu. dk/services/TargetP/)分析蛋白質的亞細胞定位[9]。TMHMM Server 分析蛋白質的跨膜區域[10]。NetPhos 2.0 Server(http:// www. cbs. dtu.dk/services/NetPhos/)分析蛋白質磷酸化位點。PSIPRED analysis(http://bioin f.cs.ucl.ac.uk/psipr ed/)進行蛋白質二級結構預測[11],SWISS models(https://swissmodel.expasy.org/)進行蛋白質三級結構預測[12]。
1.3 V型ATP酶E亞基基因序列的進化分析
進入NCBI,輸入目標基因的氨基酸序列,點擊BLAST進行同源性分析,按照相似度由高到底的順序,選擇一定條數的序列依次下載,并使用MEGA 5.0軟件的鄰接法(Neighbor-Joining,NJ)用來構建系統樹,來進行進化地位分析[8]。
2 結果與分析
2.1 V型ATP酶E亞基基因序列
馬鈴薯V型ATP酶E亞基序列通過電子克隆獲得了一條堿基個數為1 257 的序列(圖1),通過ORF Finder分析核酸序列的開放閱讀框,得到這條序列的開放閱讀框堿基個數為726(126~852),以ATG為起始密碼子,以TAG為終止密碼子,編碼的蛋白質個數為241。NCBI Conserved domains保守結構域的預測,得到一個保守結構域vATP-synt_E,該家族包括液泡ATP合成酶E亞基以及古細菌ATP合成酶E亞基。
2.2 V型ATP酶E亞基基因編碼蛋白質的生物信息學分析
每種氨基酸都有特定的理化性質,而整個蛋白質的性質則往往是其組成氨基酸性質的加和。V型ATP酶E亞基蛋白在馬鈴薯基因組中blastp,有4條目標基因,這4個基因染色體位置尚不明確,運用ProtParam和ProScal進行分析V型ATP酶E亞基蛋白理化性質分析,蛋白的分子量(Molecular weight)是27 689.84 D、等電點(Theoretical pI)是7.28、不穩定指數(Instability index)是44.06,該數值高于閾值40,為不穩定蛋白,V型ATP酶E亞基蛋白屬于不穩定蛋白、半衰期在哺乳動物的網織紅細胞中為30 h,在酵母細胞中大于20 h,在大腸桿菌體內大于10 h、脂溶指數是增加球形蛋白熱穩定性的一個積極因素,該蛋白的脂溶指數(Aliphatic index)是95.06、正電荷殘基數(Arg + Lys)和負電荷殘基數(Asp+Glu)各是38個。蛋白質的種類、空間結構及活性、功能都與肽鏈中氨基酸的種類及順序有關(表1),該蛋白由20種氨基酸組成,其中Glu(E)含量最高,為11.2%,其次Lys(K)、Leu(L),占9.1%;Thr(T)和Trp(W)含量最低,分別為0.8%、0.4%,親水性平均系數(Grand average of hydropathicity,GRAVY)是-0.551,該數值為負值則說明該蛋白為親水性蛋白,在整個肽鏈當中呈極不均勻分布(圖2);疏水性氨基酸很明顯的少于親水性的氨基酸,并且親水性在第50~100個氨基酸區間較高;疏水性在第100~150個氨基酸區間比較高,所以V型ATP酶E亞基蛋白屬于親水性蛋白。
信號肽主要由疏水性氨基酸組成,運用SignalP4.1 server進行信號肽分析,預測結果為,該序列不存在信號肽,這與馬鈴薯V-ATP酶E亞基蛋白這一膜蛋白性質相符合。基因編碼的蛋白質在細胞中的分布與該蛋白的功能緊密相關,從而在一定程度上反映了該基因的功能。利用WOLF 和TargetP2.0 Serverr 分析蛋白質的亞細胞定位,該蛋白細胞質可能在細胞質(Cyto)、葉綠體(Chlo)、細胞核(Nucl)、線粒體(Mito)和過氧化物酶體(Pero)中,主要分布在細胞質和葉綠體中。蛋白質序列含有跨膜區,可能作為膜受體起作用,也可能是定位與膜的錨定蛋白。將蛋白質序列在TMHMM Serverv 2.0中檢索,預測其無跨膜區。NetPhos 2.0 Server進行磷酸化位點的預測,其結果顯示,該氨基酸序列共10個磷酸化位點,8個Ser、1個Thr和1個Tyr。
了解蛋白質的空間結構不僅有利于認識蛋白質的功能,也有利于認識蛋白是如何執行其功能的。SWISS model預測得到蛋白質三級結構(圖3),利用SWISS model預測的蛋白質三級結構與模板之間的序列同源性為32.09%(V-typeproton ATPase subunit E,SMTL ID:3j9t.1P)。該蛋白質的三級結構有α螺旋、延伸鏈、β轉角和不規則卷曲4種形式。其中最主要的二級結構是α螺旋,共由168個氨基酸參與形成4段α螺旋區域,占全部氨基酸的69.71%;19個氨基酸參與形成延伸鏈,占全部氨基酸的7.88%;β轉角由9個氨基酸形成,占全部氨基酸的3.73%;45個氨基酸形成不規則卷曲,占比為18.67%。
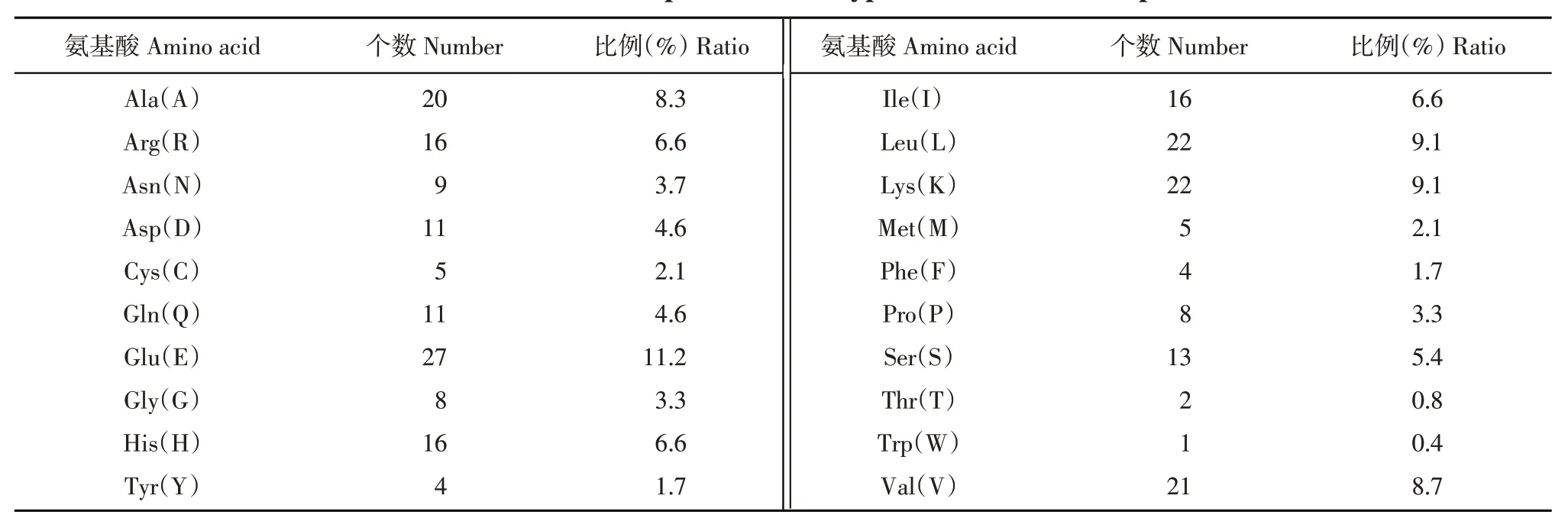
表1 V型ATP酶E亞基蛋白的氨基酸組成Table 1 Amino acid composition of V-type ATPase E subunit protein
2.3 V型ATP酶E亞基基因系統進化分析
通過系統進化樹,可以研究生物進化和系統發育過程,概括各種生物之間的親緣關系。運行MEGA 5.0軟件,將與該序列匹配度較高的20條序列輸入,構建進化樹(圖4)。從圖4中可以看出,馬鈴薯V-ATP 酶E 亞基與馬鈴薯E 亞基屬于同一分支,與煙草、煙草變種和潘那利番茄V-ATP酶E亞基的同源性也相對較高,而與木薯、巴西橡膠樹、蓖麻、可可、榴蓮屬、米莎草(芭蕉亞種)、蓮屬、金魚草等同源性較遠。
3 討 論
從馬鈴薯中克隆了V-ATP酶E亞基基因的全長序列,并對其進行了生物信息學分析,結果表明,該序列沒有信號肽,具有多種功能保守域,編碼的蛋白質為一親水性蛋白,具有水解酶活性,研究結果與其他生物V-ATPase E亞基的特征一致。
V-ATP酶在細胞內參與多種生化反應,例如含有與肌動蛋白結合和位點,參與細胞骨架的形成以及細胞的運動;具有調節hsp70活性的結構域,預測具有調節蛋白質的折疊、多肽在細胞器膜上的易位、協調對壓力的反應,以及特定的蛋白質降解有關;多種酶的催化活性,參與細胞的生長,細胞內酸化的主要調節劑、參與物質的轉運[13,14]、參與到多種信號傳導的過程[15],涉及多種脅迫生理調控[16,17],過表達V-ATPase E 亞基的轉基因擬南芥植物增強了對鹽和甘露醇耐受性[18]。其作用機制有待于進一步研究。顯然,試驗結果為進一步研究V-ATPase E 亞基基因功能及在青枯菌脅迫下的響應機制提供了依據。
V 型ATP 酶E 亞基蛋白位于KEGG 中,V-ATP 酶E 亞基參與的途徑分類范圍屬于生物特異性生物系統,包括吞噬、氧化磷酸化和代謝途徑。吞噬作用是通過細胞攝取相對大顆粒的過程,并且是組織重塑,炎癥和防御感染因子的中心機制。當吞噬細胞表面上的特異性受體識別顆粒表面上的配體時,形成吞噬體。形成后,新生的吞噬體逐漸獲得消化特征。吞噬體的這種成熟涉及與其他膜細胞器的調節相互作用,包括再循環內體,晚期內體和溶酶體。吞噬體和溶酶體融合釋放出有毒產物,殺死大多數細菌并將其降解成碎片。表明V-ATPase E 亞基基因可能響應青枯菌脅迫。
V-ATP 酶的分布廣泛且結構復雜,對細胞的生理功能有著重要作用,研究表明V-ATP 酶的表達及相應的調控有多種方式。V-ATP 酶的功能調控方式包括V1 和V02 個結構域的解離和結合,內部巰基的可逆氧化,激活劑和抑制劑的影響,靶標膜的選擇幾個方面。V-ATP 酶的表達調控方式包括轉錄水平的調控和轉錄后水平的調控。其中,翻譯后修飾(PTM)是調節基因表達的關鍵水平之一,其決定了真核細胞翻譯后蛋白質的命運,對疾病的診斷和預防有用,真核V-ATP 酶E功能可以通過催化V1 區和膜嵌入的V0 區的可逆解離來調節,具體的調控機制有待進一步研究。

