微小核糖核酸miR-449a 通過凋亡及細胞周期對結直腸癌轉移癌細胞LOVO 的影響
王嵐玉,馬煜,張潔,張國志,陳建立
(華北理工大學附屬醫院普外科,河北 唐山)
0 引言
微小RNA(miRNA)是一種進化上保守的內源性的小非編碼RNA,主要通過靶向結合3’-UTR,調節mRNA 的穩定性和蛋白的翻譯來發揮作用[1]。在過去的十幾年里,很多體內和體外的實驗研究已經證明,miRNA 在腫瘤的發生發展中起關鍵作用[2],有些miRNA 已被提出作為癌癥治療的新型潛在靶標[3]。目前為止,有研究表明miR-449a 在多種腫瘤中呈現較低表達,包括肝癌、胃癌等,能夠抑制腫瘤細胞增殖、侵襲和轉移[4-5]。本實驗旨在探究miR-449a 在結直腸癌轉移癌細胞中的表達,觀察在結直腸癌細胞株中過表達和敲低miR-449a 對結直腸癌轉移癌細胞凋亡和細胞周期的影響,并研究此過程細胞中一些凋亡相關蛋白的表達情況。
1 材料與方法
1.1 材料
miR-449a mimics 和mimics NC,miR-449a Inhibitor 和Inhibitor NC(銳博公司);人結腸黏膜上皮細胞系NCM460 以及人結直腸癌細胞系SW480、人結直腸癌轉移癌細胞LOVO;胎牛血清;RPMI-1640 培養基;磷酸緩沖鹽溶液;trizol;Lipofectamine 2000轉染試劑(Invitrogen);PCR 引物、miRNAqPCR Kit;BCA 蛋白濃度測定試劑盒;Bradford 蛋白測定試劑(碧云天生物股份有限公司);一抗兔抗B 淋巴細胞瘤/白血病-2 基因(Bcl-2)、一抗兔抗Bcl-2相關蛋白X、天冬氨酸特異酶切的半胱氨酸蛋白酶-3;一抗鼠抗β-微管蛋白,辣根過氧化物酶標記的二抗羊抗小鼠IgG、辣根過氧化物酶標記的二抗羊抗兔IgG;超敏ECL 發光試劑盒;聚偏二氟乙烯膜(PVDF 膜);Total RNApure reagent 試劑盒(北京莊盟生物基因公司);RevertAid Frist Strand cDNA Synthesis Kit 試劑盒(賽默飛世爾科技公司);2×SYBR qPCR Mix(北京莊盟生物基因公司);一步法TUNEL 細胞凋亡檢測試劑盒(綠色熒光)(碧云天生物股份有限公司);細胞周期檢測試劑盒(聯科公司)。
1.2 細胞培養
SW480、HT29、HCT15、LOVO 和NCM460 細胞株分別在添加10%胎牛血清的RPMI-1640 培養液培養,置于37℃,5%CO2 培養箱中常規培養,每天換液一次,取對數生長期的細胞用于后續實驗。
1.3 dsRNA、miRNA 序列的選擇和細胞轉染
miR-449a mimics 和mimics NC,miR-449a Inhibitor 和Inhibitor NC 由銳博生物公司設計制作。取對數生長期的細胞接種與6 孔細胞培養板,轉染時細胞融合度約為50%至80%時,根據對結直腸癌細胞的不同處理分為4 組:上調組,上調對照組,下調組,下調對照組。更換無血清RPMI-1640 培養基12h 后,采用轉染試劑Lipofectamine 2000 進行轉染實驗,進行轉染4 至6h 后,更換新完全培養基,24h 后觀察細胞狀態并及時更換完全培養基。每組設置三個復孔,實驗重復3 次。
1.4 總RNA 的提取和qPCR 分析
將轉染48h 后的收集的細胞放置在1.5mL 的離心管中,利用Trizol 法提取細胞中總RNA,然后分析細胞中miR-449a 的表達水平。miR cDNA 合成參照賽默飛世爾科技公司RevertAid Frist Strand cDNA Synthesis Kit 試劑盒說明操作。加樣完成后,將其放置在PCR 儀中進行逆轉錄,運行程序:在42℃,60min;70℃,5min。以逆轉錄反應獲得的cDNA 做模板,按照北京莊盟生物基因公司2×SYBR qPCR Mix 試劑盒說明操作,反應條件為:①預變性:94℃、3min、1 個循環;②PCR 擴增:共40 個循環,每個循環包括變性(94℃、15s)、退火(60℃、30s)、延伸(72℃、30s)。利用熒光定時定量PCR 儀進行上述實時定量PCR 反應及檢測,U6snRNA作為內參。每組設置三個復孔,實驗重復3 次。結果數據采用2-△△CT 方法分析。
1.5 TUNEL 法檢測細胞凋亡
將轉染后的結腸癌細胞及空白組培養24h 后(n=4),通過TUNEL 檢測法檢測各組細胞的凋亡情況:將4 組細胞爬片用4%多基聚甲醛固定30min,PBS 緩沖液洗5min,加入含0.1% TritonX-100 的PBS 冰浴孵育2min,PBS 緩沖液沖洗2 次×10min,將TUNEL 工作液加入6 孔板中37℃避光孵育60min,PBS 緩沖液沖洗3 次×10min,DAPI 染色液染色10min,PBS 緩沖液沖洗3 次×5min,將爬片取出,抗熒光淬滅劑封片,免疫熒光顯微鏡下采集圖片。用Image-ProPlus6.0 軟件隨機抽取6 個區域分別測定TUNEL 熒光數量,DAPI 染色細胞核數量,用TUNEL 熒光數量/DAPI 細胞核數量表示凋亡細胞水平。實驗重復 3 次。
1.6 Western blot
將轉染后的結腸癌細胞及空白組常氧培養24h 后(n=4),將處理好的細胞培養板取出后,加入4℃預冷的PBS 溶液漂洗3 遍,吸盡殘留的PBS 溶液,加入RIPA 裂解液,于冰上裂解,30min 后用細胞刮收集蛋白,然后超速離心后取上清,運用BCA 法測定蛋白濃度,并按比例加入SDS-PAGE 蛋白上樣緩沖液(10×)混勻,煮沸5min,保存于-20℃。取16μg/孔蛋白上樣,8%分離膠進行電泳,將相應分子量的蛋白轉移至PVDF 膜,BSA 封閉2h,分別與相對應的一抗(bcl-2、bax、caspase-3、β-tublin)4℃搖床過夜,TBST 洗4 次,每次5min。再分別與抗兔的HRP 標記的二抗室溫孵育2h,TBST 洗4 次,每次5 min,最后使用ECL 化學發光。用灰度值表示。實驗重復3 次。
1.7 細胞周期分布分析
經過指定的處理后,用胰蛋白酶收集細胞,用磷酸鹽緩沖液洗滌兩次,然后使用細胞周期染色試劑盒(聯科生物,杭州,中國)用DNA 染色溶液和碘化丙啶染色30 分鐘。通過流式細胞儀評估染色的細胞,并通過FlowJo 軟件(TreeStar,Ashland,OR,USA)分析數據。

表1 轉染各組LOVO 結腸癌轉移癌細胞BCL-2、BAX 及caspase-3 蛋白相對表達量
1.8 數據分析
所有數據采用統計軟件 SPSS 20.0 分析,數值均采用表示。多組比較采用單因素方差分析法,兩兩比較用LDS 法;兩組比較采用t 檢驗。
2 結果
2.1 人結直腸癌細胞系中miR-449a 信使RNA 的表達量明顯下降
如圖所示(圖1)miR-449a 在結直腸癌細胞系中的表達RTqPCR 結果顯示,在人結腸黏膜上皮細胞系NCM460 和人結直腸癌細胞系HCT15、HT29、SW480、人結直腸癌轉移癌細胞系LOVO 中miR-449a mRNA 的相對表達量分別為(0.148±0.193)、(0.062±0.043)、(0.017±0.006)、(0.002±0.003)。與正常人結腸黏膜上皮細胞系NCM460 中的miR-449a 信使RNA 的表達相比較,人結直腸癌細胞系中miR-449a 信使RNA 的表達量明顯下降,差異有統計學意義(P 均<0.001).結果表明,在結直腸癌細胞系中,miR-449a 均呈較低表達,我們選擇LOVO 繼續后面實驗研究。

圖1 人結腸黏膜上皮細胞系NCM460 與結腸癌細胞系的miR-449a 相對表達情況
2.2 轉染miR-449a 的mimics、Inhibitor 后細胞內miR-449a的水平檢測(RT-qPCR)
轉染后將細胞在培養箱培養24h 后,用RT-qPCR 檢測細胞內miR-449a 的水平。如圖所示(圖2、3),轉染過表達質 粒miR-449a-mimics 后,LOVO 細 胞miR-449a 表 達 量 為7945.787±848.388。轉染敲低質粒miR-449a Inhibitor 后,LOVO細胞miR-449a 表達量為0.593±0.064。數據均具有統計學意義(P均<0.05),說明轉染成功。
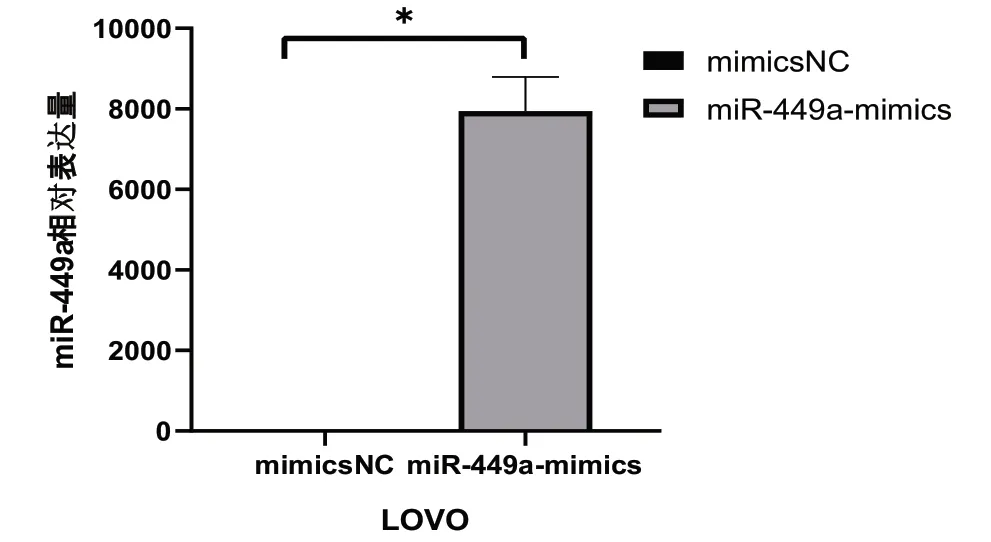
圖2 轉染過表達質粒的LOVO 結腸癌轉移癌細胞的對照組和實驗組比較
2.3 轉移癌細胞株LOVO 中miR-449a 過表達和抑制對bcl-2、bax、caspase-3 的影響(Western blot)
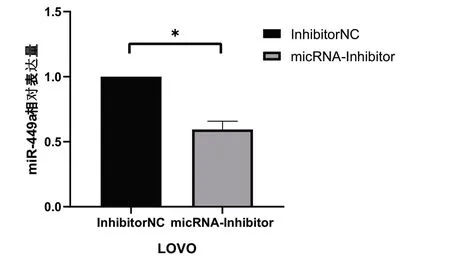
圖3 轉染敲低質粒的LOVO 結腸癌轉移癌細胞的對照組和實驗組比較
Western blot 結果顯示,上調組的LOVO 細胞,與上調NC 組及空白組相比,caspase-3,bax 的表達升高,bcl-2 的表達下降(P均<0.01);而在下調組與下調NC 組、空白組相比,bcl-2、bax、caspase-3 的表達則無明顯差異(P 均>0.05);空白組、上調NC 組、下調NC 組各細胞組比較無統計學差異(P 均>0.05) (如圖4、表1)。

圖4 轉染各組LOVO 結腸癌轉移癌細胞BCL-2、BAX 及caspase-3 蛋白相對表達量
2.4 轉移癌細胞株LOVO 中miR-449a 過表達和抑制對結腸癌細胞凋亡的影響(TUNEL)
TUNEL 實驗檢測結果顯示,和上調NC 組、空白組相比,上調組的結直腸癌細胞明顯凋亡增加(P<0.001),而下調組與下調NC 組、空白組則無明顯差異(P>0.05);空白組、上調NC組、下調NC 組各細胞組比較無統計學差異(P 均>0.05)(如圖7)。[TUNEL-陽性細胞比值:空白組(0.110±0.013);上調NC組(0.108±0.003);上調組(0.179±0.038);下調組(0.088±0.008)下調NC 組(0.118±0.018)]。
2.5 轉移癌細胞株LOVO 中miR-449a 過表達和抑制對結腸癌細胞細胞周期的影響
上調NC 組處于G0/G1 期的細胞百分比高于空白組和上調NC 組(P<0.01),出現明顯的G0/G1 期阻滯,下調組與下調NC 組、空白組則無明顯差異(P>0.05);上調組進入S 期和G2/M 期的細胞百分比均低于空白組和上調NC 組(P 均<0.01),下調組與下調NC 組、空白組則無明顯差異(P 均>0.05);空白組與下調組、下調NC 組各細胞周期百分比比較無統計學差異(P 均>0.05)(見表2)。

表2 轉染各組結腸癌轉移癌細胞LOVO 的細胞周期百分比比較
3 討論

圖7 轉染各組LOVO 結腸癌轉移癌細胞tunel 表達量
結腸癌的發生是遺傳、飲食、環境、生活習慣及腸道微生態等多因素共同作用的結果,在我國發病率呈逐年上升且年輕化趨勢[6]。由于相關預防保健知識的缺乏,在我國及其他發展中國家,大多數結腸癌患者在發現時已處于疾病中晚期,喪失手術機會。因此,分子靶向治療在晚期腫瘤治療中的運用,已經成為治療的新關注點[7]。研究表明,多種miRNA 在結直腸癌中有比較重要的作用。本研究通過檢測了幾種常見結腸癌細胞株和人結腸黏膜上皮細胞系NCM460 中miR-449a 的表達,結果證明了在結腸癌細胞系中miR-449a 也呈較低表達。
作為脊椎動物中進化保守的miRNA,miR-449a 在腫瘤發生進程中的作用也受到廣泛關注.研究發現,miRNAa 在肝癌、膀肌癌、結腸癌及胃癌病人的癌組織中的表達普遍低于癌旁正常組織[8-11]。本研究通過轉染技術而過表達結腸癌細胞株SW480 和轉移癌lovo 中miR-449a,研究其對腫瘤細胞凋亡的影響。結果表明,miR-449a 明顯促進細胞凋亡,同時檢測各組細胞中凋亡相關蛋白的表達發現,bcl-2 蛋白表達下降較顯著,而bax、caspase-3蛋白的表達卻上調。
Bcl-2 是線粒體凋亡途徑的關鍵調節因子,能夠通過抑制細胞色素C 從線粒體膜間隔釋放到細胞質中而發揮其抗凋亡功能[12]。有軟件預測bcl-2 很有可能是miR-449a 的一個靶向結合基因[13],而miRNA 能夠與靶基因mRNA3’-UTR 結合,在轉錄后水平調節基因表達。有資料顯示,在多種腫瘤細胞的凋亡過程中,發現有caspase 的活化[14-15]。因此,我們推測miR-449a 的異常表達可能結腸癌具有相關性,可能是通過下調靶基因bcl-2 的表達而引起bax 蛋白的改變,同時激活了caspase-3 蛋白的表達,最終引起了結腸癌細胞的凋亡。當然,miR-449a 可能也有很多其他的靶基因,通過改變這些個基因的表達引起細胞凋亡,這也是今后繼續研究的方向和切入點。

