小鼠股骨缺損模型的構建及SDF-1 表達的檢測
董 苑,李彩霞,趙 嫻,駝曉宇,劉 流,馬 蕓
(1) 昆明醫科大學附屬第一醫院乳腺外科,云南昆明 650032;2) 昆明醫科大學學報編輯部,云南 昆明 650500)
臨床上多種疾病可能造成人體骨組織的缺損,小范圍的骨缺損可以自行修復,但大范圍的骨缺損并不能完全自行修復[1]。骨缺損的研究在組織工程研究領域的地位非常重要,在從動物試驗通向臨床研究的過程中,需要建立標準化的動物模型,筆者對標準化動物模型的要求是制作的骨缺損范圍一致性,可重復性好,以達到研究結果嚴謹的目的[2]。骨損傷發生后,局部微環境發生變化,局部會產生多種細胞因子,這些細胞因子對各種細胞尤其是間充質干細胞的遷移、趨化、黏附、增殖和分化起到了尤為重要的作用[3]。其中,基質細胞衍生因子-1(stromal cell-derived factor-1,SDF-1) 是其中尤為重要的一員,SDF-1 是一種分泌型蛋白,屬于CXC 趨化因子亞家族成員,在骨缺損修復過程中起到重要作用[4]。骨損傷出現后,局部SDF-1 分泌迅速增加,SDF-1 促使周圍CXCR4+干細胞向骨損傷部位趨化遷移。因此,深入研究SDF-1 在骨缺損修復中的動態變化為研究干細胞趨化促進骨再生修復提供重要的依據。本實驗為求探尋更優的小鼠骨缺損模型制作方法,動態監測骨缺損局部SDF-1 表達,了解其動態變化的趨勢及特點。為求進一步了解SDF-1 在骨損傷修復過程中的作用及對間充質干細胞趨化作用的影響。
1 材料與方法
1.1 試驗動物與材料
健康成年昆明鼠35 只,雄性,體重(19~25)g 普通飲食,實驗動物均飼養于昆明醫科大學實驗動物中心。打磨機(SAEYANG MARATHON-3),SDF-1 抗體(Abcam,編號:ab25117,稀釋比例1:100),EnvisionTM 試劑盒,抗體稀釋液,DAB顯色劑(Dako)。光學顯微鏡(OLYMPUS)。
1.2 實驗方法
1.2.1 小鼠股骨缺損模型的構建 麻醉:0.5%戊巴比妥鈉,5 mg/kg 腹腔注射麻醉。顯露:右膝關節上方偏外側平行股骨切口,顯露股骨中段。制造骨缺損:使用SAEYANG MARATHON-3 打磨機,制造骨缺損范圍約2 mm×2 mm,使用打磨機過程中局部滴注生理鹽水以避免局部熱損傷產生局部炎癥。術畢縫合肌膜和皮膚。術后管理:口服抗生素,局部固定,正常喂養(見圖1)。
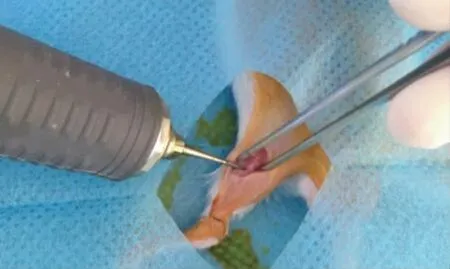
圖1 小鼠股骨缺損建立過程Fig.1 Establishment of mouse femoral defect
1.2.2 小鼠骨缺損部位SDF-1 動態表達的檢測(免疫組化法) 模型制作成功后的小鼠正常喂養,定期處死小鼠(術后第1、2、4、7、14 天,每次處死7 只),分別對骨缺損側股骨及對側股骨取材,常規固定,石蠟包埋,切片。SDF-1 免疫組化染色。
SDF-1 陽性表達定位于細胞漿,呈棕黃色顆粒狀。我們將小鼠脾臟進行染色,已知B 細胞作為陽性對照,同時設置PBS 代替一抗作為陰性對照。
結果判讀:采用半定量計分方式。按著色強度及陽性細胞數兩種評分結合。(1) 按染色強度來分,3 分,棕褐色;2 分,棕黃色或金黃色;1分,淡黃色;0 分,無著色。(2) 按陽性細胞數:選擇染色比較均勻的陽性表達區域,選取5 個HP計數陽性細胞占比。4 分,陽性細胞率>75%;3分,陽性細胞率51%~75%;2 分,陽性細胞率26%~50%;1 分,陽性細胞率5%~25%;0 分,陽性細胞率<5%。最后評分由強度及陽性細胞數兩種評分相加而得,6~7 分為強陽性(+++),4~5 分為陽性(++),2-3 分為弱陽性(+),0-1 為陰性(-),所有結果判讀均由兩名病理醫師獨立完成,若出現評分不一致情況則重復觀察后再進行結果確定[5]。
1.3 統計學處理
使用SPSS 統計軟件,對不同時間段處死小鼠骨缺損側和未手術側SDF-1 表達評分之間結果比較采用配對秩和檢驗。P<0.05 為差異有統計學意義。
2 結果
骨缺損制作過程順利,耗時短,制作過程中骨缺損斷面光滑,無不規則斷裂面及碎骨形成。實驗動物除一只在術中意外死亡外,其余均存活至正常處死,局部創面未出現感染及血腫形成等情況。
SDF-1 術后動態檢測結果表明,骨缺損模型建立后,骨缺損區域局部SDF-1 表達評分明顯增高,并在不同時間點均呈現持續高表達,且局部陽性程度較健康無骨缺損側明顯增高(見圖2,圖3)。二者之間差異有統計學意義(P<0.05)。表明在骨缺損發生后,局部SDF-1 分泌明顯增多,且能在骨缺損后的不同時間點持續分泌。

圖2 SDF-1 免疫組化染色(×400)Fig.2 Immunohistochemical staining of SDF-1(×400)
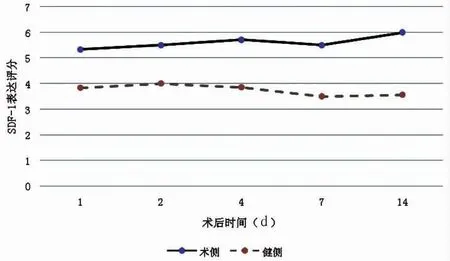
圖3 SDF-1 骨缺損側和未手術側表達評分結果Fig.3 SDF-1 expression scores on the defect side and the non-operation side
3 討論
骨缺損研究是組織工程修復中的重要研究領域,在此研究領域中,構建標準化的動物模型可以保證實驗結果的一致性及可重復性,只有這樣,才能更好地從實驗研究向臨床研究轉化[3],因此,在骨缺損修復的研究過程中,對骨缺損模型的要求是簡便易行、可重復性好、一致性好,因此選擇何種方式建立骨缺損是需要思考的問題。而骨缺損模型中,骨缺損范圍大小建多大也至關重要,筆者知道,骨缺損的大小和愈合率呈負相關。Van Steenberghe D[6]曾經指出,在小鼠中<2 mm 的骨缺損不作處理即可獲得良好的修復。傳統構建骨缺損模型常用的方法是使用骨鉗,但骨鉗的力度和范圍較難掌握,容易出現骨質碎片及不規則斷面而造成骨缺損模型的不一致性。在本實驗中構建的骨缺損模型位于股骨,范圍約2 mm×2 mm,制作過程中未使用傳統骨鉗而使用打磨機對局部骨質進行打磨發現,打磨機對于骨缺損制作的大小范圍較傳統骨鉗可控制性好,制作過程快速,不易造成骨折及不規則缺損面,動物模型一致性強。因此,筆者通過打磨機制作的小鼠骨缺損動物模型為組織工程骨缺損的領域的研究提供了較好的動物模型。
機體發生骨缺損或者骨折后,局部出現出血及血腫形成,局部可產生一系列的炎癥反應、細胞因子的釋放及炎癥細胞的浸潤,在局部組織修復的過程中,血腫逐漸由肉芽組織替代,血腫機化進而進行局部修復。因此,筆者知道細胞因子的釋放在骨缺損修復過程中起到了非常關鍵的作用。SDF-1 就是以上細胞因子中非常重要的一員。SDF-1 是一種分泌型蛋白,相對分子質量高度保守,是CXC 趨化因子亞家族的成員。SDF-1 在許多正常組織都有表達。SDF-1 特異性受體為CXCR4,SDF-1 與CXCR4 特異性結合發揮生物學功能。體內許多細胞表面都表達CXCR4 受體,包括所有CD34+細胞、單核細胞、淋巴細胞等。SDF-1 與其特異性受體CXCR4 結合可以參與體內許多生物學過程,其中調控及參與干細胞歸巢方面的研究最為受到重視。Ali 等[7]通過SDF-1/CXCR4 軸水平的調節,可影響間充實干細胞在大鼠模型中的歸巢。Yu Y 等[8]發現炎癥及缺氧刺激導致的SDF-1 變化可增加骨髓間充質干細胞歸巢。研究表明[9-10],當局部組織損傷后,SDF-1分泌明顯增加,通過SDF-1/CXCR4 軸的作用,可促使CXCR4+的干細胞向損傷的部位發生定向遷移,干細胞發生趨化及分化,參與組織的修復和再生。于此同時,筆者研究組也曾發現外周血內皮祖細胞可以促進骨缺損部位SDF-1 分泌從而促進骨髓間充質干細胞等歸巢而加強骨缺損修復過程[11]。因此,通過對SDF-1 在組織缺損修復過程中的研究,可以為SDF-1 在局部骨再生修復的研究中提供新的思路。
本實驗通過探討使用打磨機方法制造小鼠骨缺損模型,同時,對骨缺損局部SDF-1 進行的持續的檢測,通過免疫組化的方法,獲得骨缺損發生后SDF-1 分泌動態變化的過程。筆者發現,骨缺損發生后,缺損側局部的SDF-1 表達所有時相對比健側均有持續性的增高。說明骨缺損發生后,局部SDF-1 出現持續高水平分泌。由此可見,SDF-1 作為重要的趨化因子,在骨缺損修復過程中起到了非常重要的作用。
綜上所述,使用打磨機方法制造骨缺損,過程快速,可重復性好,大小范圍較傳統骨鉗易掌握且安全有效,為下一步研究提供了較好的動物模型。在骨缺損發生后,局部SDF-1 分泌增加。SDF-1 在骨缺損修復過程的各時相點,均呈現較高表達,提示SDF-1 作為干細胞重要的趨化因子,在骨缺損修復中可能發揮著重要的作用。

