聚偏氟乙烯/磷酸化納米二氧化硅螯合金屬鋯雜化膜
孫俊芬,張逸飛,陳 龍
(東華大學 a. 材料科學與工程學院; b. 纖維材料改性國家重點實驗室,上海 201620)
含磷蛋白作為蛋白質中非常重要的一個大類,其在各個領域都有非常大的發展潛力,例如卵清蛋白、酪蛋白[1]、卵黃磷蛋白[2]等都有優良的藥用和生物研究價值。同時蛋白質磷酸化[3]也是當今蛋白質研究的重點之一,因為蛋白質磷酸化作為真核細胞信號轉導中的核心,在生命系統中發揮著重要作用。因此,蛋白質磷酸化選擇性分離是蛋白質分析中的重要任務。
固定化金屬螯合親和層析技術(immobilized metal-chelated affinity chromato-graphy,IMAC)是一種新型親和層析技術,它主要用于分離生物大分子。1975年Paroth[4]提出這項技術,便引起了社會的廣泛關注,IMAC技術具有很多獨特的優點,不僅對蛋白質的分離具有選擇性和特異性,以及分離得到的目標蛋白質純度高,而且還可以用于基因工程技術、核酸的純化與分離等生物醫療衛生領域。膜分離技術作為一種新興交叉學科的高新技術,已經在日常生活中得到廣泛的應用,而將膜分離技術與IMAC技術相結合能夠很好地選擇性分離含磷蛋白。
近些年來,IMAC技術的螯合配基又有了許多新的嘗試,例如以磷酸基團作為新型的金屬螯合劑。Zhou等[5]提出了磷酸基團作為新的金屬螯合劑,同時螯合鋯(Zr)與鈦(Ti)金屬離子,對于含磷的蛋白質有很強的特異性吸附能力。文獻[6-7]研究表明,Zr與磷酸基團特異性結合對于含磷蛋白有優良的吸附效果。常用的固定金屬親和層析膜的改性方法即通過化學改性在膜表面接枝功能基團,這種方法對于膜的化學和物理性能都有很大影響,所以需要選擇一種擁有更高穩定性的層析膜來試驗。聚偏氟乙烯(PVDF)膜擁有優良的物理化學性能以及穩定性,是理想的膜材料。文獻[8-12]通過在PVDF膜基體中添加無機粒子來制備雜化膜。利用納米粒子表面的功能基團做進一步氨基化、磷酸化和固定螯合金屬,可以達到分離含磷蛋白的目的[13-14]。
本文利用原位合成法和相轉化法來制膜,同時利用改性后功能化納米粒子對卵清蛋白的高吸附性和高分子膜的選擇性分離原理,制備出了聚偏氟乙烯/氨基化納米二氧化硅(PVDF/NH2-SiO2)雜化膜,最后通過磷酸化添加磷酸基團并螯合Zr離子,從而實現對卵清蛋白的選擇性吸附。本文所采用的制膜方法比較簡單,并且對卵清蛋白的分離固定時間較短,同時也在最大程度上保持了原有蛋白質的活性。
1 試 驗
1.1 試驗材料及儀器
試驗材料:聚偏氟乙烯(PVDF,6020,蘇威(上海)有限公司);正硅酸乙酯(TEOS,分析純,國藥集團化學試劑有限公司);3-氨丙基三乙氧基硅烷(APTES,高純,國藥集團化學試劑有限公司);N-甲基吡咯烷酮(NMP,分析純,國藥集團化學試劑有限公司);N,N-二甲基乙酰胺(DMAc,化學純,國藥集團化學試劑有限公司);卵清蛋白(生化試劑,上海阿拉丁生化科技股份有限公司);聚乙烯吡咯烷酮90(PVP K90,工業級,國藥集團化學試劑有限公司);聚乙烯吡咯烷酮30(PVP K30,工業級,國藥集團化學試劑有限公司)。
試驗儀器:電子分析天平(CB603-N型,上海精密科學儀器儀表有限公司);恒溫振蕩器(SHZ-05型,上海申能博彩生物科技有限公司);電熱真空干燥箱(ZKF-035型,上海實驗儀器廠);紅外光譜儀(Nicolet 8700型,美國Nicolet公司);紫外可見分光光度計(UV-1800型,島津儀器蘇州有限公司);雙穩定時電泳儀(DYY-8C型,上海泰坦科技股份有限公司);掃描電子顯微鏡(Quanta-250型,捷克FEI);電感耦合等離子體發射光譜儀(Prodigy型,美國Leeman);X射線多晶衍射儀(Bruker D2 PHASER型,德國布魯克AXS公司)。
1.2 磷酸化Zr+PVDF/NH2-SiO2雜化膜的制備
取質量分數為15%的PVDF顆粒于三口燒瓶中,然后加入質量分數為3%的PVP K90和質量分數為2%的PVP K30作為制孔劑,以NMP/DMAc(質量比為9∶1)為混合溶劑,分別加入質量分數為0、 4%、 8%、 10%的TEOS,再加入APTES(其與TEOS的質量比為1∶13),最后緩慢滴加幾滴0.15 mol/L的稀鹽酸作為催化劑,調節溫度為45 ℃,轉速為230 r/min,在此條件下溶脹2 h,之后溫度調節為75 ℃,轉速為280 r/min,溶解攪拌24 h。整個制備過程中分別加入不同質量分數的TEOS來制膜,從而可以制備出有不同TEOS含量的PVDF/NH2-SiO2雜化膜鑄膜液。
將上述鑄膜液趁熱倒入潔凈的燒杯中,并用保鮮膜封口,防止空氣中水分的進入,使其在室溫下靜置脫泡10 h。待完全脫泡后,將鑄膜液流延在潔凈的不銹鋼板上,用3號刮刀進行刮膜,使鑄膜液展開形成具有一定厚度(300 μm)的均勻薄層,然后馬上將附著有薄膜的不銹鋼板放入水中凝固,使得薄膜固化,在凝固浴中浸泡1~2 d,然后測定膜的水通量,并做掃描電子顯微鏡(SEM)、衰減全反射傅里葉變換紅外光譜(ATR-FTIR)、電感耦合等離子體(ICP)元素等分析。
磷酸化:取80 g磷酸與100 mL 二甲基甲酰胺置于400 mL燒杯中混合均勻,在100 ℃下,將所制備好的膜放入其中,進行磷酸化1 h,再用蒸餾水浸泡沖洗干凈。
螯合固定Zr:取1.78 g ZrOCl2溶解于200 mL蒸餾水中,將磷酸化膜放入其中,浸泡8 h,再用蒸餾水浸泡沖洗干凈,烘干后進行測試表征。磷酸化Zr+PVDF/NH2-SiO2雜化膜制備反應流程如圖1所示。
1.3 膜的結構表征和性能評價
1.3.1 紅外光譜測定
測試前將膜在烘箱中完全烘干,采用傅里葉變換紅外光譜儀對PVDF純膜和改性以后的PVDF/NH2-SiO2雜化膜進行ATR-FTIR分析,波數范圍為4 000~400 cm-1,掃描次數為32次,精度為4 cm-1。
1.3.2 表觀形態表征
測試前先將膜在30 ℃真空烘箱中干燥12 h,然后將膜放在液氮中冷凍并使其脆斷,以保證其截面結構不受損傷,最后置于離子濺射噴金儀中對其截面進行噴金處理。在掃描電子顯微鏡下觀察PVDF純膜和磷酸化Zr+PVDF/NH2-SiO2雜化膜上表面、下表面以及膜斷面處的形態結構。
1.3.3 X射線衍射光譜測定
把磷酸化Zr+PVDF/NH2-SiO2雜化膜置于60 ℃的真空烘箱中干燥24 h,然后用X射線衍射儀分析膜的物相組成,步長為0.02°,2θ測量范圍為10°~60°,掃描速度為0.1(°)/s。
1.3.4 ICP元素分析
將含不同質量分數TEOS的PVDF/NH2-SiO2雜化膜在60 ℃的真空烘箱中烘干12 h,用ICP發射光譜儀測試樣品中硅(Si)、磷(P)、 Zr的元素組成。
1.3.5 卵清蛋白吸附性能
分別剪取若干塊1.5 cm×1.5 cm的膜,然后將它們置于真空烘箱中,設定溫度為60 ℃,在此條件下烘10 h至完全干燥,然后用分析天平準確地稱取各張膜的質量并做記錄。取一塊膜置于樣品瓶中,并用移液槍在瓶中加入事先配置的5 mL 質量濃度為2 g/L的卵清蛋白溶液,蓋好瓶蓋,將恒溫振蕩器的溫度設定為25 ℃,調節振動頻率,振蕩24 h,最后再用分光光度計在280 nm波長處測定卵清蛋白溶液的吸光度,并計算出卵清蛋白的質量濃度,根據式(1)計算膜吸附量q(mg/g)。
(1)
式中:c0為原液中卵清蛋白質量濃度,mg/mL;c1為吸附后溶液中卵清蛋白質量濃度,mg/mL;m為膜的干質量,g;V為卵清蛋白溶液的體積,mL。
取質量濃度為2 g/L的卵清蛋白吸附原液,在25 ℃下振蕩吸附24 h,測試吸附前后卵清蛋白溶液的吸光度,計算膜的吸附量;然后用蒸餾水沖洗雜化膜,將膜置于10%的氨水溶液中,在25 ℃下振蕩24 h,測量蛋白的解吸附率,即為第一次吸附試驗;將雜化膜烘干后稱其質量,重復上述步驟4次,來測定雜化膜的重復吸附率,根據式(2)計算膜的解吸附率(%)。
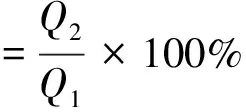
(2)
式中:Q1為膜的吸附量,mg/g;Q2為膜的解吸附量,mg/g。
2 結果與討論
2.1 傅里葉變換紅外光譜分析
純PVDF膜、用APTES改性的PVDF/NH2-SiO2雜化膜,以及磷酸化Zr+PVDF/NH2-SiO2雜化膜的傅里葉變換紅外光譜如圖2所示。其中,PVDF純膜的PVDF質量分數為15%,APTES改性的PVDF/NH2-SiO2雜化膜中TEOS質量分數為4%,磷酸化Zr+PVDF/NH2-SiO2雜化膜中TEOS質量分數為4%。由圖2可知:PVDF純膜在3 411 cm-1處沒有吸收峰,當PVDF純膜中引入氨基化SiO2后,在3 411 cm-1處出現了強烈的吸收峰,該吸收峰為N—H鍵的伸縮振動吸收峰,說明氨基化改性以后雜化膜內加入了NH2基團,實現了SiO2粒子的氨基化;與PVDF純膜相比,改性后的PVDF/NH2-SiO2雜化膜在1 640 cm-1處出現了一個小的吸收峰,該吸收峰為N—H鍵的面內彎曲振動吸收峰,同樣也說明了氨基化改性以后雜化膜內加入了NH2基團,證明實現了SiO2粒子的氨基化。對比曲線a和b可知,曲線c在1 076 cm-1處出現了一個新的吸收峰,此吸收峰為與Si和P化學鍵相關的吸收峰,說明磷酸化處理改性的PVDF/NH2-SiO2雜化膜中加入了含有Si和P的基團,證明PVDF/NH2-SiO2雜化膜上成功接入了磷酸基團。而固定螯合金屬Zr的吸收峰在此FTIR譜圖中不能顯示,需用其他表征方法進一步測定。
2.2 表觀形態分析
不同TEOS質量分數的PVDF/NH2-SiO2雜化膜(未經過磷酸化和螯合金屬處理)的上表面與下表面的SEM圖如圖3所示,其放大倍數為10 000倍。從圖3可以看出:雜化膜的上表面都是比較致密的形態結構,而下表面的孔洞比較多;隨著TEOS質量分數的增加,雜化膜表面的孔洞也越來越多,孔徑逐漸增大,且納米粒子的團聚現象減少。因為TEOS經過水解-聚合反應形成硅氧聚合物,可以產生較長的線型硅氧鍵,然后隨著硅氧鍵的伸展與鏈之間的相互交聯,最后形成了一種交聯的無規網絡結構,它們能夠與PVDF的大分子鏈互相纏繞,SiO2粒子穿插在PVDF溶液中,可以有效地阻礙PVDF大分子間的聚集,并且當PVDF鑄膜液固化時,可以在無機相和有機相之間產生一定的空隙。
Fig.3 SEM images of top and bottom surfaces of PVDF/NH2-SiO2membranes with different TEOS mass fractions
2.3 X射線衍射光譜分析
由于PVDF分子鏈結構上含有很多氟基團(—F),因而分子鏈之間會形成氫鍵,制備得到的PVDF純膜會具有相對比較高的結晶度。試驗中采用TEOS與APTES和PVDF共混制備PVDF/NH2-SiO2雜化膜的實質是破壞了PVDF分子鏈之間的氫鍵。PVDF純膜和不同質量分數的TEOS改性的磷酸化Zr+PVDF/NH2-SiO2雜化膜的XRD測試結果如圖4所示。由圖4可知,作為一種結晶型聚合物,PVDF純膜在20°左右有一個明顯的衍射峰,用TEOS和APTES共混改性后雜化膜的衍射峰相較于PVDF純膜的衍射峰尖銳程度明顯下降,衍射峰面積也減小,且隨著TEOS質量分數的增加,PVDF雜化膜的結晶度呈現逐漸降低的趨勢。因為TEOS和APTES的加入破壞了PVDF分子鏈之間的氫鍵,隨著TEOS質量分數的增加,PVDF的結晶結構被破壞得越嚴重,膜的結晶度也隨之降低。
2.4 元素組成分析
不同質量分數的TEOS改性制得的磷酸化Zr+PVDF/NH2-SiO2雜化膜的P、Si、Zr含量進行ICP(inductively coupled plasma)元素分析測試,結果如表1所示。

表1 磷酸化Zr+PVDF/NH2-SiO2雜化膜的ICP元素分析結果
由表1可知,在改性后的雜化膜上測到了P、 Si、 Zr 3種元素的存在,可以說明金屬Zr已經成功地螯合到了PVDF/NH2-SiO2雜化膜上,并且當TEOS質量分數為8%時,PVDF/NH2-SiO2雜化膜可以負載更多的金屬Zr。隨著TEOS質量分數的增加,雜化膜上Si的含量也增加。這是由于TEOS的增加則導致鑄膜液中硅氧聚合物增加,從而導致Si含量增加。隨著TEOS質量分數的增加,雜化膜上P和Zr的含量先升高后降低。這是由于TEOS質量分數較低時,膜上固定的磷酸基團較少,所能螯合的Zr離子有限,所以Zr含量較低;當TEOS質量分數繼續增加時,膜上功能基團(如NH2等)數量增加,能與更多的磷酸基團反應,進而能夠固定螯合更多的Zr離子;但當TEOS質量分數繼續增加,SiO2含量也隨之增加,會形成團聚現象,從而導致能與硅烷偶聯劑APTES反應脫水縮合的基團下降,并引起磷酸化和螯合金屬的下降。
2.5 卵清蛋白吸附性能分析
2.5.1 TEOS質量分數對雜化膜吸附性能的影響
磷酸化Zr+PVDF/NH2-SiO2雜化膜對質量濃度為2 g/L的卵清蛋白的吸附量隨TEOS質量分數的變化如圖5所示。
從圖5可以看出,隨著TEOS質量分數的增加,磷酸化Zr+PVDF/NH2-SiO2雜化膜對卵清蛋白的吸附量先快速上升,然后緩慢升高到最大值,再略微降低,當TEOS質量分數為8%時,磷酸化Zr+PVDF/NH2-SiO2雜化膜對卵清蛋白的吸附量達到最大值,為150.7 mg/g。由此說明,通過在PVDF鑄膜液中加入TEOS后能夠有效地提高PVDF膜對卵清蛋白的吸附能力,且加入不同質量分數的TEOS改性的磷酸化Zr+PVDF/NH2-SiO2雜化膜對蛋白質的吸附能力的提高程度是不同的。這是由于加入PVDF鑄膜液中的TEOS經過水解-聚合反應可以生成硅氧聚合物,并且產生了較長的線性硅氧鍵,由于大分子鏈之間的相互交聯以及硅氧鍵的不斷伸展,最后便會產生線性交聯的三維無規網絡結構,它們能與PVDF分子鏈互相纏繞,SiO2穿插在PVDF溶液中,有效地阻止了PVDF大分子間的聚集,然后通過TEOS與APTES可以引入功能基團,進而與磷酸基團反應,由于磷酸基團可以螯合Zr,而Zr對于含磷蛋白(如卵清蛋白)有很好的吸附效果。隨著TEOS質量分數的增加,加入的APTES濃度也在增加(APTES和TEOS的質量比為13∶1),由于反應過程是TEOS水解成SiO2粒子,然后與APTES反應,即對SiO2粒子進行氨基化,所以在SiO2粒子上的氨基也在增加,可以引入更多的磷酸基團以及固定螯合更多的Zr,所以磷酸化Zr+PVDF/NH2-SiO2雜化膜對卵清蛋白的吸附會隨著TEOS質量分數的增加而增加;當TEOS質量分數增加到8%后,由于雜化膜表面積有限,引入的磷酸基團和固定的Zr會達到一個最大值,這時磷酸化Zr+PVDF/NH2-SiO2雜化膜對卵清蛋白的吸附提供的吸附位點和吸附空間達到最大值,所以吸附量也達到最大值;繼續增加TEOS質量分數,SiO2含量也增加,使得其本身發生了團聚現象,從而導致與硅烷偶聯劑APTES脫水縮合的反應基團下降,P和Zr的含量也隨之下降,引起吸附效果的下降。
2.5.2 磷酸化Zr+PVDF/NH2-SiO2雜化膜的重復吸附
利用磷酸化Zr+PVDF/NH2-SiO2雜化膜吸附卵清蛋白不是本文研究的最終目的,還需通過對磷酸化Zr+PVDF/NH2-SiO2雜化膜進行解吸附處理,從而將其所吸附的卵清蛋白釋放出來,這樣可以將釋放出的卵清蛋白另作他用,同時將磷酸化Zr+PVDF/NH2-SiO2雜化膜循環使用。磷酸化Zr+PVDF/NH2-SiO2雜化膜(TEOS質量分數為8%,磷酸化處理1 h)對卵清蛋白的重復吸附率的測試結果如表2所示。
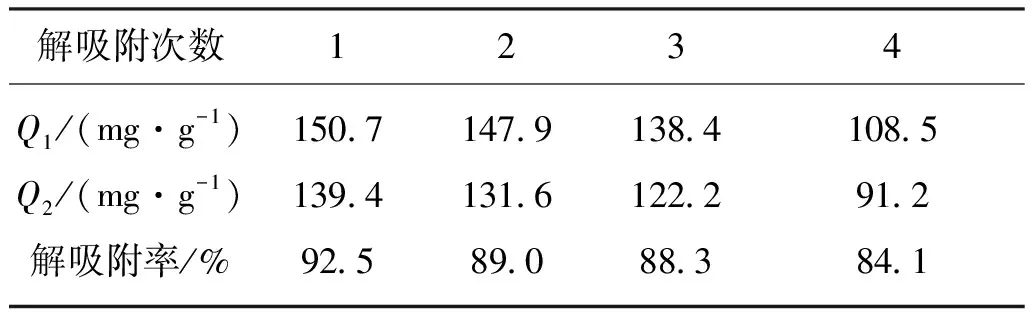
表2 磷酸化Zr+PVDF/NH2-SiO2雜化膜對卵清蛋白的重復吸附容量
試驗中采用質量濃度為2 g/L的卵清蛋白溶液(用pH值為5的緩沖溶液配置)進行吸附,然后用質量分數為10%的氨水溶液對雜化膜進行解吸附處理,重復4次。由表2可知,隨著重復吸附次數的增加,磷酸化Zr+PVDF/NH2-SiO2雜化膜對卵清蛋白的吸附量和解吸附量均逐漸減少。這可能由于膜在每次使用的過程中均有一部分蛋白質未被洗脫,從而造成了膜的污染。但是從整體上而言,試驗中所制得的磷酸化Zr+PVDF/NH2-SiO2雜化膜對卵清蛋白具有良好的重復吸附和解吸附能力,可以循環使用。
3 結 語
本文成功地用APTES改性TEOS制備出氨基化的SiO2,并用原位合成法制備分散良好、性能優異的PVDF/NH2-SiO2雜化膜,最后成功對膜進行了磷酸化和螯合固定金屬鋯。研究結果表明,隨著TEOS質量分數的增加,磷酸化Zr+PVDF/NH2-SiO2雜化膜對卵清蛋白的吸附量先快速上升,然后升高到最大值,穩定后再略微降低,當TEOS質量分數為8%時,雜化膜對卵清蛋白的吸附量達到最大值,為150.7 mg/g。通過將磷酸化Zr+PVDF/NH2-SiO2雜化膜循環使用,表明該雜化膜具有良好的重復吸附和解吸附能力。

