高效液相色譜-串聯質譜研究呋喃妥因代謝物在鯽魚體內的殘留消除規律
方雙琪,張 帥,張小軍,嚴忠雍,梅光明,胡夢玲
(1.浙江海洋大學食品與藥學學院,浙江舟山 316022;2.浙江海洋大學海洋與漁業研究所,浙江省海洋水產研究所,浙江省海洋漁業資源可持續利用技術研究重點實驗室,浙江舟山 316021)
呋喃妥因(nitrofurantoin),是一種人工合成的硝基呋喃類抗菌藥物[1]。主要通過作用微生物酶系統,抑制乙酰輔酶A,干擾微生物糖類的代謝,從而起到殺菌和抑菌的效果[2],可用來預防和治療禽畜、水產動物傳染病,其原藥在動物體內數小時就代謝為1-氨基乙內酰脲(AHD)。研究表明,硝基呋喃類代謝物可與組織蛋白緊密結合,以結合態形式在體內長時間殘留,具有致畸、致癌、致突變的作用[3]。因此,從安全角度考慮,歐美及我國等許多國家及地區都先后發布了禁止使用硝基呋喃類藥物的禁令[4-5]。但因其價格低廉,殺菌效果好以及用藥習慣等因素,仍有養殖戶在養殖過程中違規使用此類藥物。
出于藥物監管和風險評估的需要,目前已有了硝基呋喃類藥物在青石斑魚Epinephelus awoara[6]、鱸魚Lateolabrax japonicus[7]、羅非魚Oreochromis spp[8]、草魚Ctenopharyngodon idella[9]、大菱鲆Scophthalmus maximus[10]等水產動物體內的富集及消除規律的研究,為開展風險評估及實施科學監督提供了大量的基礎數據,但尚無單獨采用液相色譜-串聯質譜研究呋喃妥因代謝物在鯽魚體內殘留消除規律的報道。本實驗以鯽魚為實驗對象,采用藥浴給藥的方式,研究呋喃妥因代謝物AHD 在鯽魚體內的殘留消除規律,以期獲得AHD 在鯽魚體內代謝消除的時間,為鯽魚的健康養殖和藥物風險防控提供理論依據。
1 材料與方法
1.1 儀器與試劑
ACQUITY 型高效液相色譜儀(美國Waters 公司);Quattro Preemier XE 型串聯三重四級桿質譜儀(美國Waters 公司);LPD2550 型多管渦旋混合儀(萊普特科學儀器有限公司);AvantiJXN-30 型貝克曼離心機(庫特爾商貿有限公司);ZD-85 型恒溫振蕩器(常州國華電器有限公司);Nitrogen Evaporator 112 型氮吹儀(美國Organomatio 公司)。
呋喃妥因,質量分數99.8%;呋喃妥因代謝物(AHD),質量分數99.7%;內標(AHD-HCL-13C3);.乙酸銨、2-硝基苯甲醛、甲醇、甲酸為色譜純;乙酸乙酯、鹽酸、二甲基亞砜、磷酸氫二鉀為分析純;水為超純水。
1.2 試驗動物
鯽魚購于浙江省舟山市臨城商業街老碶菜市場,體質量(160±10) g,體長(18±2) cm。隨機抽樣檢測魚體內不含呋喃妥因原藥及其代謝物AHD 殘留后作為實驗用魚。將鯽魚暫養在帶有增氧泵的藍色聚乙烯養魚缸中飼養3 d,使其適應試驗環境。每日投喂不含呋喃妥因的飼料,檢查并將死亡的鯽魚剔除,挑選個頭均勻,外觀健康的鯽魚進行試驗,試驗期間水溫為(22±1) ℃。
1.3 實驗設計與采樣
試驗前將鯽魚隨機分成3 個平行實驗組和1 個空白對照組,并在魚缸內使用增氧泵。將呋喃妥因用少量丙酮溶解后加水混勻添加到3 個實驗組中,使水體呋喃妥因質量濃度為100 ng·mL-1。避光藥浴鯽魚12 h,藥浴結束后,將3 個平行實驗組的鯽魚分別轉到3 個清水缸進行代謝實驗,分別在代謝后的0、1、2、4、6、9、12、24、36、48、60、96、144、1 960 h 甚至更長時間點采集鯽魚背部肌肉以及內臟混合樣品(肝、腸、腎、膽)進行分析,每個時間點取3 個平行試驗組樣品及1 個空白對照組樣品,樣品采集于-20 ℃冰箱保存,待測。
1.4 鯽魚體內AHD 的測定
稱取肌肉樣品(2.0±0.1)g、內臟混合樣品(腸、膽、肝、腎)(1.0±0.1)g 于50 mL 離心管中,加入100 ng·mL-1的內標工作液0.10 mL,渦旋混合50 s 后加入5 mL 0.2 mol·L-1鹽酸溶液和0.15 mL 0.05 mol·L-12-硝基苯甲醛溶液,渦旋振蕩50 s,置于37 ℃下恒溫避光振蕩衍生16 h[11]。
取出離心管放置冷卻到室溫,加入1 mol·L-1磷酸氫二鉀溶液4.5~5 mL,調節pH 至7.0~7.5。重復2次加入乙酸乙酯5 mL,渦旋振蕩5 min,6 000 r·min-14~10 ℃低溫離心6 min,取上清液置于15 mL 離心管中,40 ℃下氮氣吹干。肌肉殘渣用1.0 mL 甲醇水溶液(1:9)溶解,振蕩30 s,經0.22 μm 有機濾膜過濾,轉移至進樣瓶待測;內臟殘渣加入1 mL 正己烷,振蕩30 s,4 500 r·min-14~10 ℃低溫離心3 min,取下層溶液過濾膜,待測。
1.5 檢測方法
1.5.1 色譜條件
色譜柱:ACQUITY UPLC BEHC18 柱(2.1 mm×50 mm×1.7 mm);樣品室溫度10 ℃;柱溫40 ℃;進樣量5 uL;流速0.2 mL·min-1;流動性A 為含有體積分數0.1 %的甲酸和2 mmoL·L-1的乙酸銨溶液,B 為甲醇,梯度洗脫程序見表1。

表1 流動性梯度洗脫程序Tab.1 Gradient eLution program of the mobiLe phase
1.5.2 質譜條件
離子化模式:電噴霧電離源(ESI+);離子源溫度:120 ℃;掃描模式:多反應監測(MRM),母離子、子離子、錐孔電壓和碰撞能量等質譜多反應監測實驗條件見表2。
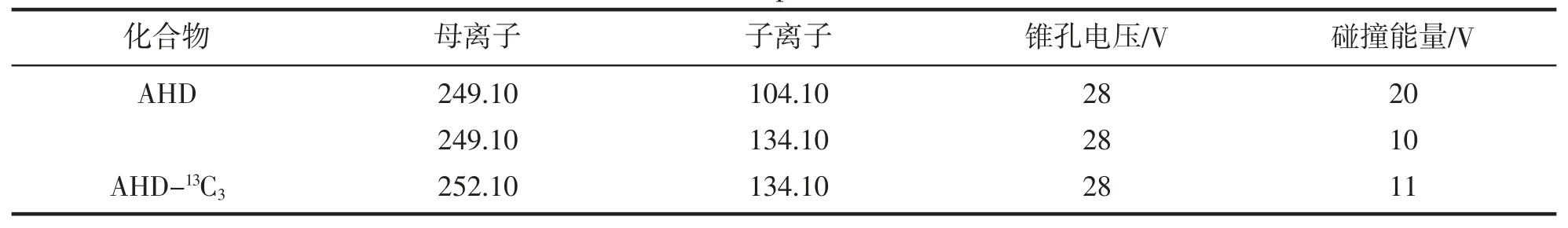
表2 MRM 模式下質譜測定的特征離子Tab.2 Characteristic ions of mass spectrum determination in MRM mdde
1.6 標準工作曲線制作
分別準確移取10 ng·mL-1標準工作液0.10、0.20 mL,100 ng·mL-1標準工作液0.05、0.10、0.25 mL和1 μg·mL-1標準工作液0.05、0.10 mL 于7 個離心管中,除不加樣品外,按1.5 步驟操作,按1.6 步驟測定。以測得的峰面積為橫坐標,相應的質量濃度為縱坐標作線性回歸,繪制標準曲線。
1.7 回收率與精密度
在空白鯽魚肌肉及內臟樣品中添加呋喃妥因代謝物標準品,制得3 個濃度水平樣品,分別為1.0、5.0、10.0 μg·kg-1。按照1.5 進行樣品處理后,按1.6 進行測定,每個添加水平做3 個平行,每個平行分別在1 d內重復進樣3 次。
1.8 結果計算
AHD 測定結果由儀器工作站按內標法自動計算,樣品中AHD 的質量比計算計算公式如下:

M 為樣品中AHD 的質量分數比(μg·kg-1);C 為AHD 在UPLC-MS 檢測的質量濃度(ng·kg-1);V 為最終定容體積(mL);m 代表質量(g)。
呋喃妥因代謝物的回收率(%)計算公式:

呋喃妥因代謝物平均消除速率v[12],計算公式如下:

其中:Mmax、Mmin分別代表消除過程中AHD 質量分數的最大值和最小值,t1、t2:分別代表藥物濃度達到最大和最小值所需要的時間。
2 結果與討論
2.1 前處理條件的優化
鯽魚內臟組織樣品中含有較多的脂類、色素等雜質,回收率低,且其殘留物經復溶后,乳化嚴重,過膜困難,甚至導致無法上機檢測。實驗在鯽魚空白內臟樣品中添加呋喃妥因代謝物標準品25 μg·kg-1,制得兩個水平加標樣品,其中一個樣品不添加除脂劑,另一個在氮吹后加入1 mL 正己烷,分別重復實驗和進樣3 次,計算兩種實驗方式的回收率并比較色譜圖。圖1 和2 分別為未添加除脂劑和添加正己烷的色譜圖,由圖可見,內臟樣品經正己烷除脂后,AHD 響應值較高,基線走動平穩,干擾峰較少,且回收率為99.2%,而未經除脂的加標樣品色譜圖雜峰多,且AHD 不能與雜峰很好地分離,回收率低。

圖1 未添加除脂劑的內臟色譜圖Fig.1 Visceral chromatogram without degreaser added

圖2 添加正己烷除脂后的內臟色譜圖Fig.2 Visceral chromatogram after de-lipiding with n-hexane
2.2 線性范圍、檢測限和定量限
呋喃妥因代謝物AHD 標準溶液衍生化后測定得到的標準曲線表明:AHD 在1.0~100.0 ng·mL-1濃度范圍內,線性關系良好,相關系數為0.999 787,線性方程為y=0.987 874x+0.350 042。最低檢測限為三倍基線噪音的藥物質量比,定量限為10 倍基線噪音藥物質量濃度。該測定方法對AHD 的檢測限(S/N>3)為0.25 μg·kg-1,定量限(S/N>10)為0.5 μg·kg-1。
2.3 回收率與精密度
本試驗條件下,以1.0、5.0、10.0 μg·kg-1為3 個添加水平,每個水平測定3 次,測定得到AHD 在鯽魚肌肉中的回收率為92%~110.6%,相對標準偏差為4.25%~7.74%;AHD 在內臟中的回收率為89.5%~110.2%,相對標準偏差為6.64%~11.74%。
2.4 給藥方式和實驗環境
本實驗以鯽魚為實驗對象,與文獻報道研究藥物在水產動物體中代謝動力學及其殘留代謝規律時的采用口灌[13]和拌飼投喂[14]的方式不同,本實驗采用的是藥浴給藥方式。藥浴在自然條件下進行,模擬人工養殖條件下水產養殖者使用呋喃妥因時可能會采用的給藥方式,試驗結果更加接近于實際,給藥物監督和管理工作提供依據。
實驗水體溫度為(22±1) ℃,有研究發現一般情況下,藥物的吸收和消除速率隨水溫的增高而加快,如有研究顯示呋喃西林代謝物氨基脲(SEM)的消除速率在22 ℃水溫條件下要比28 ℃時慢[15];而水體溫度升高,水中溶氧量飽和度降低,魚體很容易缺氧死亡,影響鯽魚的存活率,影響實驗的準確度;且水產動物在高溫季節,攝食量加大,自身的新陳代謝也會加快,因此實驗中應保持水體溫度的一致性。
2.5 消除過程中AHD 在鯽魚體內的殘留量
鯽魚經含有100 μg·mL-1質量濃度的呋喃妥因水溶液藥浴12 h,原藥通過魚皮、魚鰓等組織進入魚體后迅速代謝為其代謝物AHD,且內臟和肌肉中的AHD 的含量隨著代謝時間的變化呈現不同的變化趨勢。由圖3 和4 可知,代謝0 h 時,肌肉中AHD 的含量為0.74 μg·kg-1,之后逐漸上升,2 h 后達到最大值為1.95 μg·kg-1,之后呈波動下降趨勢,60 h 之后開始緩慢下降,144 h 后低于檢測限0.25 μg·kg-1,平均消除速率為0.012 μg·kg-1;內臟中的殘留量在代謝0 h 時僅為4.89 μg·kg-1,代謝9~96 h 之間,內臟中的殘留量呈現較大的波動變化,并在9、36、96 h 后達到3 個不同峰值,144 h 之后呈緩慢下降趨勢,220 h 后低于檢測限0.25 μg·kg-1,平均消除速率為1.47 μg·kg-1。

圖3 AHD 在鯽魚肌肉中的消除曲線Fig.3 Elimination curve of AHD in the muscle of carp
本實驗表明AHD 在鯽魚體內消除速度緩慢,且肌肉的消除速率明顯低于內臟。丁軍偉等[6]研究發現AHD 在青石斑魚體內代謝緩慢,停藥163 d 時AHD 在肌肉中的殘留量仍高于液質檢測限0.5 μg·kg-1。王明興等[14]研究發現呋喃西林代謝物氨基脲(SEM)在凡納濱對蝦體內代謝緩慢,代謝30 d 后體內仍有SEM 殘留,且各組織代謝速率不同,肌肉中的殘留量明顯大于內臟中的腸、肝、胰腺。而譚志軍等[10]研究SEM 和呋喃唑酮代謝物(AOZ)在大菱鲆肌肉、肝臟、血液中的代謝規律時發現,肝臟中SEM 和AOZ 的含量最高,但3 種組織中SEM 和AOZ 具有相同的消除規律,且具有很長的消除半衰期,較難消除。以上研究表明硝基呋喃代謝物在水生生物體內代謝緩慢,且體內各組織代謝能力不同,這可能是由于硝基呋喃代謝物能與動物組織中的蛋白質結合,從而形成難以消除的殘留物,因此鯽魚肌肉中的AHD 消除緩慢。并且肝臟是代謝器官,而腎臟是排泄器官,同時也是代謝物最容易殘留和蓄積的部位,因此AHD 在內臟中殘留量高但代謝消除快,而由于內臟混合樣品中的基質復雜,腸、膽、肝、腎等的蓄積代謝能力不同,因此在不同器官在不同的時間達到最大殘留量,使得出現3 個不同的高濃度峰值,但具體內臟哪個部分的藥物殘留濃度最高,AHD 在內臟各器官中代謝速度的快慢差異,還需要進一步研究。

圖4 AHD 在鯽魚內臟中的消除曲線Fig.4 Elimination curve of AHD in the viscera of carp
3 結論
本實驗建立了HPLC-MS/MS 測定呋喃妥因代謝物在鯽魚體內的殘留量,并通過內臟除脂優化,提高了內臟樣品的回收率,得到了呋喃妥因代謝物單獨在鯽魚體內的殘留消除規律。實驗數據表明呋喃妥因代謝物在鯽魚體內很難消除,且本次實驗是單次低濃度的藥浴給藥,由此可見,如果養殖者在養殖過程中多次給藥或單次更高劑量投藥,AHD 在鯽魚體內的代謝消除期會更長,一旦帶有AHD 殘留的水產品進入市場,對消費者的身體健康將會造成極大的危害,因此有關部門應加大監管力度,嚴格禁止養殖戶使用此類藥物,從而保證水產品的質量安全。

