自身免疫肝炎患者外周血PBMCs自噬基因表達及Th17/CD4+CD25+CD127lowTreg細胞與肝臟功能相關性研究
汪永強,李顯勇,楊 琳,劉世軍,項 明
(四川省內江市第二人民醫院 檢驗科,四川 內江641001)
自身免疫性肝炎(AIH)是一種針對肝細胞自身免疫反應所介導的慢性肝損傷,目前對于AIH的發病機制尚未完全明確。研究報道該疾病與自身免疫異常、自身反應性T淋巴細胞、調節性T淋巴細胞缺陷、PD-L1等與AIH疾病的發生發展相關[1]。近年來研究證實自噬在自身免疫、炎癥、神經退行性疾病等發病過程中扮演一定的角色[2,3],自噬對B淋巴細胞、T淋巴細胞的存活進行調控,從而從多層次多方面參與了SLE的發生,Th17細胞過量分泌的IL-17細胞因子加重炎癥細胞局部浸潤及組織器官的損傷,且與肝損傷與炎癥活動度相關[4,5],表明自噬與自身免疫的核心淋巴細胞有一定的關系。但自噬與AIH的關系及Th17/Treg與肝臟功能相關性尚未見報道,本研究以AIH為研究對象,探討AIH患者外周血PBMCs中自噬關鍵基因Beclin 1、LC3 mRNA表達及外周血Th17細胞、調節性CD4+CD25+CD127lowT(Treg)細胞含量,分析與肝臟功能相關性,探討自噬與免疫平衡在AIH疾病發生中的作用。
1 資料與方法
1.1 資料
1.1.1研究對象 以我院2015年7月至2019年6月收治的35例自身免疫性肝炎(AIH)為研究對象,該研究對象均為治療前患者,男性16例,女性19例,平均年齡53±10.6歲,AIH診斷標準符合2008年國際免疫性肝炎小組提出的AIH診斷簡化積分系統及2010版美國肝病學會發布的診斷指南,另選取30例我院健康管理中心體檢者為對照組,無各類自身免疫性疾病、乙型肝炎、酒精性、藥物性、代謝性肝病等,并經健康管理師評定為健康者,其中男14例,女16例,平均年齡(48±12.5)歲,以上兩組在性別、年齡方面差異無統計學意義(P>0.05)。
1.1.2儀器與試劑 熒光定量PCR儀為ABI 7500,自噬基因Beclin 1與LC3基因表達引物合成與試劑為TaKara公司,熒光顯微鏡為奧林巴斯BX-51,間接熒光免疫試劑與免疫印跡試劑為德國(歐蒙)醫學實驗診斷有限公司。流式細胞儀為Beckman coulter公司,各類流式熒光標記單克隆抗體為Beckman公司,酶聯免疫(ELISA)法檢測白細胞介素IL-17試劑盒為武漢博士德公司,生化分析儀為Beckman AU5800,肝臟損害相關生化指標檢測試劑為九強公司。
1.2 方法
1.2.1PBMCs提取 靜脈采集研究對象2 ml靜脈全血,EDTA-K2抗凝,與Hanks等體積混合并混勻,緩慢加入含Ficoll(4 ml)液的離心管中,2 000 r/min密度梯度離心25 min,用Tip頭小心吸取中層細胞層,Hanks液離心洗滌3次,重懸待用。
1.2.2自噬相關基因Beclin 1與LC3 mRNA表達檢測 兩種基因引物序列參照文獻設計并合成[6],提取上述步驟所得PBMC細胞總RNA,經逆轉錄cDNA后用熒光染料法Sybr Green qPCR檢測Beclin 1與LC3 mRNA的表達,擴增條件為95℃ 3 min,95℃ 7sec,57℃ 10sec,72℃15 sec,40cycle,AIH組與對照組與各組βactin內參比較,用2-△Ct方法計算基因相對表達水平并統計學分析。
1.2.3Th17細胞與Treg細胞的檢測 操作流程嚴格按照Beckman coulter試劑盒說明書進行,用EDTA-K2抗凝全血,在試管中加入10 μl熒光抗體混合物和100 μl的抗凝全血,渦旋混勻后室溫避光孵育20 min,加入500 μl Optilyse C紅細胞裂解液,渦旋混勻后室溫避光放置10 min,直至血液透亮,加入PBS,室溫避光5 min,加入100 μl已充分混勻的Flow-count絕對計數微球,渦旋混勻后應用流式細胞儀,進行Th17、Treg細胞檢測。IL-17水平檢測,嚴格按照說明書用ELISA法檢測血清中IL-17含量。
1.2.4抗核抗體與肝病相關自身抗體檢測 間接免疫熒光法:用PBS緩沖液將血清1∶100稀釋并點樣,將Hep-2細胞/猴肝包被的基質玻片反扣加樣板上(ASMA檢測用大鼠胃基質),按照說明書方法進行后續實驗,在熒光顯微鏡BX-51下觀察綠色熒光并攝像,進行定性與核型分析。免疫印跡法:步驟為:將待檢血清用樣本緩沖液1∶100稀釋后加入包被有相應抗原的印跡膜條,室溫搖床震動30 min,洗膜后加酶標記二抗,室溫搖床震動30 min,洗膜后加顯色劑顯色10 min,用蒸餾水終止反應,用掃描儀掃描吸光度A值,觀察結果。
1.2.5肝臟功能指標的檢測 靜脈血肝素抗凝,離心分離血漿,免疫球蛋白采用散射比濁法檢測,各種酶類采用速率法檢測,參數設置嚴格按照說明書進行。

2 結果
2.1 AIH組與對照組肝臟功能實驗室指標與自身抗體結果
兩組肝臟功能指標如表1所示,AIH組ALT、AST、TBIL、GGT、AKP、IgG均高于對照組,差異具有統計學意義(P<0.001)。AIH組ANA陽性率(間接免疫熒光滴度大于1∶320或至少一項ANAs免疫印跡法檢測陽性)為74.3%,高于對照組9.7%,χ2=27.86,P=0.000。AIH組自身免疫性肝病自身抗體陽性率(ASMA、M2、SLA/LP、LC-1、sp100、gp120至少一項陽性)為65.7%,對照組為3.2%,χ2=27.74,P=0.000。
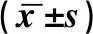
表1 AIH 組與對照組血清肝臟功能指標水平比較
2.2 Beclin 1與LC3 mRNA表達相對量
目的基因與內參基因在兩組實驗溶解曲線分析呈現單一峰,擴增曲線光滑平穩。AIH組Beclin 1 基因相對表達含量為(5.73±4.07)×2-7,與對照組比較,差異無統計學意義(t=0.587,P=0.559);AIH組LC3 mRNA基因表達相對含量為(2.82±2.06)×2-6,對照組為(6.45±5.04)×2-6,差異具有統計學意義(t=-3.745,P=0.001),如圖1。

圖1 Beclin 1與LC3 mRNA表達
2.3 LC3 mRNA表達與肝臟功能指標的相關性
LC3 mRNA與ALTr=-0.360,P=0.034,與ASTr=-0.178,P=0.305,與GGTr=-0.074,P=0.672,與AKPr=-0.166,P=0.342,與TBILr=-0.097,P=0.580,IgGr=0.003,P=0.986,見圖2。

圖2 AIH組LC3 mRNA表達與肝功能指標相關性
2.4 Th17/CD4+T與Treg/C4+T、IL-17檢測結果
AIH組Th17/CD4+T均值為2.61±2.09%,對照組為1.27±0.99%(t=3.394,P=0.001),Treg/C4+T在AIH組為4.86±2.49%,低于對照組(8.32±2.26%)(t=-5.882,P=0.000),AIH組血清IL-17結果為16.03±5.21 pg/ml,對照組12.86±4.19 pg/ml(t=2.704,P=0.009),見圖3至圖5。

圖3 AIH組Th17/CD4+流式圖

圖4 AIH組Treg/C4+T流式圖

圖5 Th17/CD4+T、Treg/C4+T、血清IL-17在兩組中的含量
2.5 Th17/CD4+T與Treg/C4+T比值與肝臟功能指標的相關
Th17/Treg比值與ALT、GGT的相關性分別為r=0.596、0.506,P<0.05;與AST、AKP、TBIL、IgG的相關性分別為r=0.260、0.092、0.077、-0.061,P>0.05。如圖6。

圖6 AIH組Th17/Treg比值與肝功能指標的相關性
3 討論
肝臟炎癥、高免疫球蛋白血癥、血清中可檢測出多種自身抗體等是自身免疫性肝炎(AIH)的主要臨床特征。目前的研究證實,該疾病與遺傳因素、環境因素、藥物或生物因素、自身免疫調節異常等相關[7,8]。隨著醫學技術水平的進步及對AIH認識的不斷加深,我國AIH患者的檢出率逐年增加[9]。
自身免疫性肝炎的診斷主要依據血清學和病理組織學檢查,并排除其它病毒性肝炎。本研究納入的35例研究對象均排除了各種類型肝炎及肝臟疾病。AIH的初期實驗室檢查主要體現在肝臟功能異常、高免疫球蛋白血癥及外周血清檢測到各種自身抗體,超過95%的自身免疫性肝炎患者出現血清學異常。Ⅰ型自身免疫性肝炎血清抗體主要為ANA和SMA抗體,Ⅱ型自身免疫性肝炎臨床檢出率很低,其自身抗體主要體現為抗LKM-1和LC-1[10,11]。本研究納入的AIH患者肝臟酶學指標、總膽紅素、免疫球蛋白IgG均較對照組高,與AIH的診斷相符合。AIH組ANA陽性率為74.3%,自身免疫性肝病自身抗體陽性率為65.7%,P=0.000。若以ANA和肝病相關自身抗體任一出現陽性計算,AIH自身抗體陽性率為91.4%(32/35),與文獻報道大致一致[12],35例AIH患者中30例為I型自身免疫性肝炎,SMA檢出14例,SLA/LP檢出5例,sp100檢出5例,gp210檢出4例,表明自身抗體診斷AIH的特異性較差,但敏感性較高,本研究AIH患者自身抗體的類型主要體現在ANA和ANAs方面,我們在前期的研究也表明了這一點[13]。
自噬的通俗含義為“自食”,是由溶酶體介導降解和消化受損的細胞器、細胞成分、及生物大分子物質,達到細胞內穩態的主要機制,與細胞的增值、分化、凋亡等相關。自噬的生物學過程受細胞信號傳導通路的控制,目前研究證實主要受一些列自噬相關基因(Autophagy-related genes,Atgs)及蛋白的精密調控[14],Atgs種類較多,已證實的在自噬過程中起主要作用的有mTOR、Beclin 1、LC3等,其中mTOR信號通路為人類研究較多的自噬通路且活化后起負向調節自噬現象[15],在多種自身免疫性疾病領域表明,自噬與自身免疫性疾病的發生發生密切相關,自身免疫性疾病多肌炎方面,與壞死性肌病比較,多肌炎患者肌纖維自噬蛋白LC3和p62陽性率低于壞死性肌病,通過檢測自噬蛋白可以很好地區分壞死性肌炎和多肌炎[16]。RA小鼠模型研究表明,青蒿酯下調小鼠軟骨細胞中PI3K,AKT,mTOR,p-PI3K,p-AKT,p-mTOR Bcl-2 和 Bcl-x的表達,提高了Bax,LC3II/LC3I 、 Becline-1 蛋白的表達,同時青蒿酯通過抑制PI3K/AKT/mTOR信號通過加速軟骨細胞自噬和凋亡,從反面證明RA小鼠模型軟骨細胞自噬基因表達是下調的[17],也證實了mTOR信號通路為自噬通路且活化后起負向調節自噬現象。然而在活動性類風濕關節炎患者滑膜組織中,自噬相關基因Beclin、Atg5、LC3 mRNA和蛋白與關節置換術病人比較,均呈增高趨勢,進一步研究發現,LC3-II蛋白與RA活動指標CRP、ESR、CCP具有較好的正相關性,表明RA患者滑膜中自噬機制是增強的[18]。這兩個關于自噬與RA關系的研究結果并不一致,表明自噬與自身免疫性疾病之間的關系尚不清楚,是否與研究的細胞種類不同,尚需進一步研究。有關自身免疫性肝炎與自噬的研究報道更少,由于自身免疫性疾病的本質是機體產生自身抗體,故選取外周PBMC細胞更有說服力,我們的研究結果表明:AIH患者外周血PBMC細胞Beclin 1 基因表達與對照組沒有差異,而LC3 mRNA基因表達明顯下調,與采用相同研究方案的SLE患者結果比較一致[19]。進一步結果表明LC3 mRNA表達與肝臟谷丙轉氨酶呈負相關。
機體免疫功能紊亂是發生自身免疫性疾病的因素之一,Th17細胞可促進自身免疫性疾病的發生,其主要機制是分泌的IL-17細胞因子誘導TNFα、IL-6等促炎分子及炎癥細胞聚集與浸潤,導致機體免疫炎癥反應。相反CD4+CD25+Treg細胞通過表達CD25(IL-2a受體)、Foxp3、CTLA4以及趨化因子受體等,起到機體免疫平衡與自穩的作用,是機體重要的免疫調節細胞[20]。在AIH患者外周血PBMC細胞基因層面,證實白介素17A(IL-17A)、白介素22(IL-22)mRNA表達下調[21]。在AIH患者外周血清層面,IL-17、IL-6、 IL-21和 TNF-α 同樣增高,流式細胞術也證實了Th17增高而Treg細胞降低,Th17頻率與ALT、AST呈正相關,而Treg細胞沒有相關性[22]。在動物小鼠模型和AIH急性期患者,CD3+CD4+CD25+Foxp3+Tregs細胞下降,CD3+CD4+CD25- Foxp3+T、 CD3+CD4+IFN-γ+Th1、 CD3+CD4+IL-17+Th17、 CD3+CD4+IL-2+Th22細胞以及 Th1/Th17/Th22-細胞因子均增高,IL-17A和IL-22 與肝臟損傷具有正相關性[23]。本研究同樣證實AIH患者存在Th17與CD4+CD25+CD127lowTreg免疫失衡的現象,Th17頻率與ALT、GGT呈正相關(P<0.05),雖然與AST沒有明顯的相關性,但表明有一定的相關趨勢。因Th17/Treg細胞是一對重要的促炎和抑制炎癥的細胞,組合分析更能反映機體的免疫失衡狀態,我們分析了Th17/Treg比值與肝功能指標的相關性,結果表明該比值與ALT、GGT具有正相關性,與TBIL、AST、AKP、IgG沒有明顯的相關性。
綜上所述,AIH患者外周血免疫細胞存在自噬與免疫失衡現象,自噬與免疫失衡與肝臟損傷有關,提高機體自噬和免疫調節T淋巴細胞功能有望成為治療AIH的新靶點。

