ELISA測定中HRP/TMB顯色體系的優化及穩定性研究
劉鳳銀, 盧嘉輝, 巫嘉琦, 黃燕璇, 鄒紅麗, 梁岳, 穆洪濤
(廣東第二師范學院 生物與食品工程學院, 廣東 廣州 510303)
*通信作者:穆洪濤,男,山東德州人,廣東第二師范學院生物與食品工程學院講師,博士.
0 引言
酶聯免疫吸附測定(Enzyme Linked Immunosorbent Assay,ELISA)是將抗原抗體結合的高度特異性及酶的高效催化性相結合的一種免疫分析方法,具有靈敏度高、快速簡便、成本低廉等優點,目前已廣泛應用于臨床醫學、食品科學、藥物分析、動物檢疫、病蟲害防治等領域[1-3]. ELISA測定中,最后一步的酶催化顯色反應起到信號放大作用,通過測定顏色的深淺來計算待測物的含量. 因此,底物顯色液的質量及顯色系統的穩定性直接決定了試驗的成敗[4-6]. 目前,雖已有商品化的顯色液產品,但由于涉及商業機密,其配方極少公開,同時存在產品質量參差不齊、價格昂貴等問題,當教學或科研中需使用大量顯色液時,將大大增加實驗的成本和不穩定性因素[7].
本研究以農藥氟樂靈間接ELISA顯色系統為例,通過單因素試驗,初步探討各因素對辣根過氧化物酶/3,3′,5,5′-四甲基聯苯胺(HRP/TMB)顯色體系的影響,通過正交試驗確定最佳工作條件,并對顯色液的儲藏穩定性進行研究,以期提供一種HRP/TMB顯色體系的優化方法及一種靈敏度高、性能穩定的顯色液配方,為相關領域工作者提供參考.
1 材料與方法
1.1 材料
1.1.1 實驗材料與試劑
鼠源抗氟樂靈單克隆抗體、氟樂靈包被原(實驗室自制);牛血清白蛋白(BSA)、HRP標記的羊抗鼠IgG抗體(HRP-IgG)(美國sigma公司);TMB、過氧化脲、吐溫-20、二甲基亞砜(DMSO)、甘油、蔗糖(上海阿拉丁試劑公司);96孔酶標板(廈門怡佳美實驗器材有限公司). 其他試劑均為國產分析純;實驗用水為一級水.
ELISA測定中所用緩沖液. 磷酸鹽緩沖液(PBS,0.01 mol/L,pH 7.4);碳酸鹽緩沖液(CB,0.05 mol/L,pH 9.6);洗滌緩沖液(PBST,0.01 mol/L,pH 7.4,PBS-0.5 mol/L,吐溫-20);封閉液(0.01 mol/L,pH 7.4,PBS-1% BSA,10%蔗糖,現配現用);終止液(10% H2SO4).
1.1.2 實驗儀器
SP-Max 2300A2光吸收型全波長酶標儀(上海閃譜生物科技有限公司);Wellwashi MK2洗板機(美國Thermo公司);PHSJ-4F pH計(上海儀電科學儀器股份有限公司);JA2603B(M)分析天平(0.1 mg)(上海精科科學儀器有限公司);微量移液器(德國艾本德股份公司);DK-8D電熱恒溫水槽(上海醫用恒溫設備廠);DHG-9140AD 鼓風干燥箱(上海東麓儀器設備有限公司);NC-B型超純水設備(重慶尼珂).
1.2 方法
1.2.1 間接ELISA的操作步驟
包被:將氟樂靈包被原用CB稀釋成1 μg/mL進行包板,100 μL/孔,37 ℃水浴箱中孵育過夜;洗滌:傾去孔內液體,洗滌液洗板2次. 封閉:加封閉液120 μL/孔,37 ℃孵育3 h,甩干孔內液體,倒置于37 ℃烘箱中,烘干1 h備用. 加樣及孵育:將抗氟樂靈單克隆抗體用PBST稀釋至合適濃度,100 μL/孔,37 ℃孵育40 min,洗板5次. 加酶標二抗:將HRP-IgG用PBST稀釋5 000倍,100 μL/孔,37 ℃孵育40 min,洗板5次. 顯色:加顯色液,100 μL/孔,37 ℃孵育后,每孔加50 μL終止液,終止反應. 測定:采用酶標儀測定各孔在450 nm處的吸光值A450 nm.
1.2.2 顯色液的配制
顯色液采用雙組分形式. 將0.2 mol/L乙酸鈉、0.1 mol/L檸檬酸按不同體積比混合,配置成不同pH的緩沖液,加入過氧化脲得組分1;精確稱取TMB溶于DMSO中,并加入一定體積的甘油,配置成儲備液,用含有EDTA-Na20.1 g、一水合檸檬酸0.42 g的溶液稀釋到合適濃度得組分2. 使用時,將組分1、組分2等體積混合,現配現用.
1.2.3 單因素試驗
進行ELISA實驗,測定各孔A450 nm值. 考察pH(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5)、TMB質量濃度(0.05、0.1、0.2、0.4、0.8、1.6 g/L)、過氧化脲質量濃度(0.1、0.2、0.4、0.8、1.6、3.2 g/L)、DMSO體積分數(0.5%、1%、2%、4%、8%、16%)、甘油體積分數(0、0.5%、1.0%、2%、4%、8%)、顯色時間(5、10、15、20、25、30、35、40 min)對顯色效果的影響. 通過調整氟樂靈單克隆抗體的濃度,使最大吸光值在1.0~1.5之間. 同時做空白對照試驗,考察顯色液的自發顯色.
1.2.4 正交試驗
以緩沖液pH、TMB質量濃度、過氧化脲質量濃度、顯色時間為考察因素,根據單因素試驗結果,選取單因素峰值和前后臨近兩點共計3個水平,進行4因素3水平正交試驗. 具體正交試驗因素水平設置見表1.
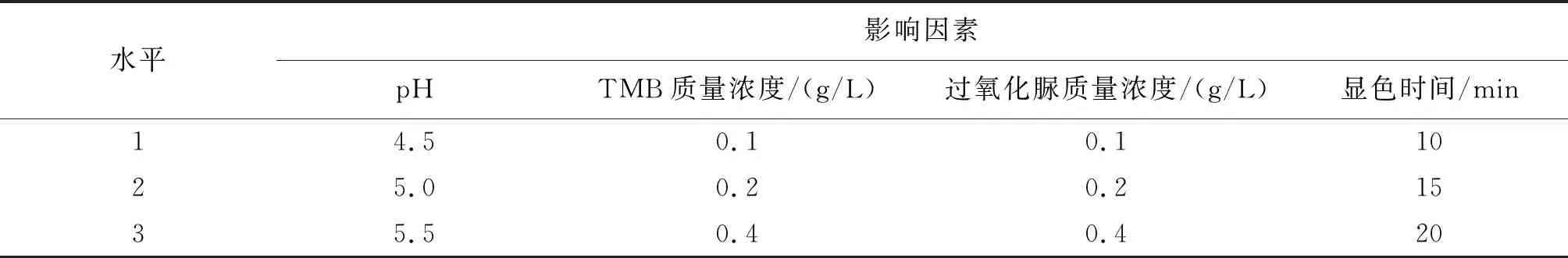
表1 正交試驗因素水平
1.2.5 穩定性試驗
配制顯色液組分1、組分2,4 ℃密封避光儲存. 每隔10 d取出與當天新配制組分1、組分2同時用于ELISA試驗,分別測定其對應的吸光值,前者記為A,后者記為A0. 以儲存時間為橫坐標、比吸光值A/A0為縱坐標,繪制曲線,確定本配方顯色液的儲存穩定性及使用有效期.
1.2.6 自制顯色液與市售同類產品對比分析
按照最佳工作條件,配制HRP/TMB雙組分顯色液. 在氟樂靈ELISA檢測體系中,分別采用自制的和三種市售的雙組份顯色液,進行試驗,顯色0、3、6、9、12、15、18 min后測定A450 nm. 以顯色時間為橫坐標、A450 nm為縱坐標,繪制曲線,比較不同顯色液的靈敏度、顯色時間、本底值及穩定性等性能參數.
1.3 數據處理
實驗做3個平行試驗. 實驗數據采用excel計算數據平均值及標準差;采用spss 19.0進行正交試驗設計及數據方差分析;采用origin 8.5對數據進行擬合分析.
2 結果與討論
2.1 單因素實驗
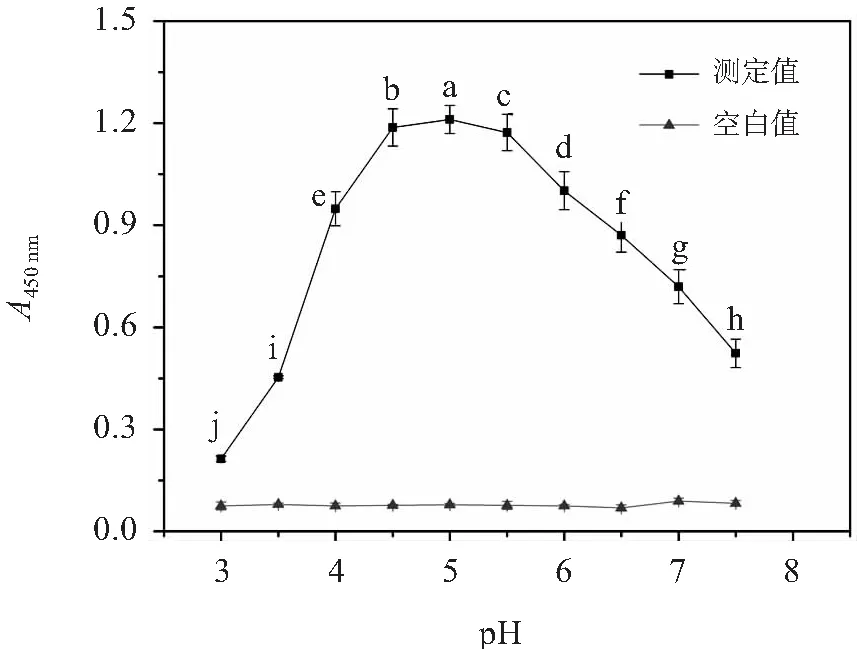
a~j字母不同表示差異顯著(p<0.05)圖1 pH對顯色效果的影響
2.1.1 pH對顯色效果的影響
HRP/TMB顯色體系中,pH主要通過改變酶和底物的解離狀態,影響酶與底物的結合能力以及酶的催化能力,進而影響顯色效果[8-9]. 根據采用的供氫體的不同,pH對顯色效果的影響亦不同. 通過調整緩沖液兩組分的體積比,使顯色液的最終pH分別為3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5,考察以TMB作為供氫體時, pH對顯色效果的影響. 結果見圖1. 可以看出,顯色液的pH對顯色效果有顯著影響. 當pH為4.5~5.5時顯色效果最佳,當pH大于5.5或小于4.5時,A450 nm顯著降低.
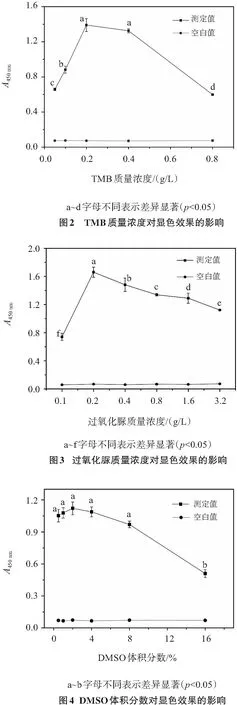
2.1.2 TMB質量濃度對顯色效果的影響
可作為HRP供氫體的有鄰苯二胺(OPD)、2,2′-聯氨-雙-3-乙基苯并噻唑啉-6-磺酸(ABTS)和TMB,前兩者由于具有潛在的致癌性而逐漸被TMB所替代[10]. 本研究中,采用TMB作為供氫體. 由圖2所示,隨著TMB質量濃度的提高,吸光值先增大后降低;TMB質量濃度為0.2 g/L時,吸光值最大,0.4 g/L時吸光值稍降,但兩者無顯著差異;0.8 g/L時吸光值顯著下降,可能原因是組分1、組分2混合后,pH升高,TMB溶解度下降,其在溶液中的分散度下降;配置TMB質量濃度為1.6 g/L顯色液時,TMB過飽和析出.
2.1.3 過氧化脲質量濃度對顯色效果的影響
HRP對受氫體的專一性很高,僅作用于H2O2、小分醇的過氧化物和尿素過氧化物,其中過氧化脲的穩定性遠高于前兩者[5,11]. 為了獲得穩定性更高的顯色液,保證實驗的重復性,本研究采用過氧化脲作為受氫體. 由圖3所示,隨著過氧化脲質量濃度的提高,吸光值先增大后逐漸降低,0.2 g/L時達到最大. 可能原因是HRP以鐵卟啉為輔基,分子中含有一個Fe2+,高質量濃度過氧化脲致部分Fe2+氧化為Fe3+,導致酶失活;同時,高質量濃度過氧化脲有一定的漂白作用,導致吸光值降低.
2.1.4 DMSO體積分數對顯色效果的影響
在顯色劑的配置中,TMB的溶解度是一關鍵因素,直接影響到檢測的敏感性[10]. TMB為脂溶性,性質穩定,但溶解度較低,其中在DMSO中的溶解度最大(20 mg/mL),因此本研究采用DMSO作為TMB的溶劑. DMSO體積分數過低,TMB的分散效果不佳,但有機溶劑體積分數過高會降低酶活性,影響顯色效果. 由圖4所示,當DMSO體積分數控制在8%之內時,吸光值變化不大,超過16%時,吸光值下降明顯;DMSO體積分數為2%時,吸光值達到最大,因此本研究選取2%作為最佳DMSO體積分數. 此體積分數下,TMB的溶解度良好.
2.1.5 甘油體積分數對顯色效果的影響
TMB對溫度敏感,儲備液需4 ℃存放,但由于DMSO在4 ℃呈固態,導致取用不便. 本研究嘗試加入一定體積分數的甘油,使儲備液保持液體狀態. 故考察了不同體積分數甘油對顯色效果的影響,見圖5. 可以看出,適當加入一定體積分數的甘油,吸光值增大,有助于顯色反應的進行;但甘油體積分數過高,吸光值緩慢降低,抑制顯色反應的進行. 本著靈敏、節約原則,選取儲備液可保持穩定液態時甘油的加入量,即0.5%.
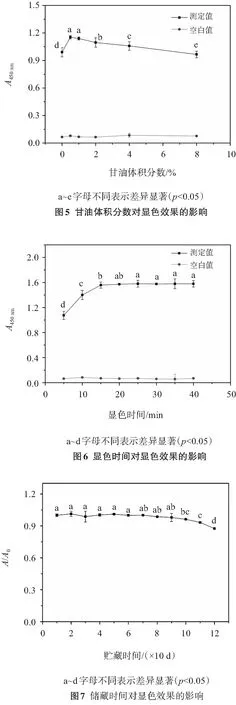
2.1.6 顯色時間對顯色效果的影響
酶促反應為一可逆過程. 隨著反應的進行,底物TMB質量濃度越來越低,產物濃度越來越高,酶促反應速率逐漸降低. 由圖6所示,當顯色反應進行15 min時,底物TMB已基本消耗完畢,吸光值最大;隨著顯色時間的延長,吸光值基本保持不變.
2.2 正交實驗
影響HRP/TMB顯色的因素很多,本研究根據單因素試驗結果,選取了對顯色影響較大的四個因素:pH、TMB質量濃度、過氧化脲質量濃度和顯色時間,進行L9(34)正交試驗,考察各因素之間的交互作用. 結果見表2. 由極差分析結果可知,對顯色效果影響的主次順序為 TMB質量濃度>過氧化脲質量濃度>pH>顯色時間. HRP/TMB顯色體系的最佳反應組合條件為A2B3C3D1. 此組合在表2中未出現,正交實驗均值最高組合為A1B3C3D3. 進一步比對兩種組合下的顯色效果,A2B3C3D1組合顯色吸光值為1.501,A1B3C3D3組合顯色吸光值為1.392,兩者有顯著性差異(t=16.700 8,p<0.05),因此確定最佳顯色條件為A2B3C3D1,即pH為5.0,TMB質量濃度為0.4 g/L,過氧化脲質量濃度為0.4 g/L,DMSO體積分數為2%,甘油體積分數為0.5%,顯色時間為10 min.
2.3 穩定性試驗
為提高實驗效率,避免每次使用前都需要現配組分1和組分2,本研究測定了其3個月內顯色效果的變化情況. 為防止不同批次包被、一抗濃度和酶標抗體稀釋度對吸光值的影響,本研究采用比吸光值代替吸光值,以提高數據的可信性. 結果見圖7. 可見,90 d后,顯色液的顯色效果呈緩慢下降趨勢;110 d后下降趨勢明顯. 120 d內,本底值穩定在0.1以下,顯色液自發顯色不明顯. 因此,顯色液組分1和組分2,需分別存放在4 ℃冰箱中,3個月內穩定性良好.
2.4 自制顯色液與市售同類產品對比分析
為考察本研究制備出的HRP/TMB雙組分顯色液的質量,本研究選購了3種市售的代表性雙組分顯色液產品,與本實驗自制顯色液,同時進行ELISA實驗,從靈敏度、顯色時間、本底值及穩定性幾個方面進行對比分析. 具體結果見圖8. 從圖中可知,與市售顯色液1相比,自制顯色液靈敏度較高,顯色反應較迅速,時間較短;與市售顯色液2相比,自制顯色液靈敏度與其相當,但比其顯色時間短;與市售顯色液3相比,自制顯色液靈敏度略低,兩者均反應較迅速,在12 min左右,達到了顯色平臺期. 四種顯色液的本底值都比較低,其中市售顯色液3的本底值略高,但均保持在0.2以下,在顯色時間內,不影響結果. 作為商品化產品,3種市售顯色液的有效期均在18個月以上,穩定性遠優于本實驗自制的顯色液.

表2 正交試驗結果
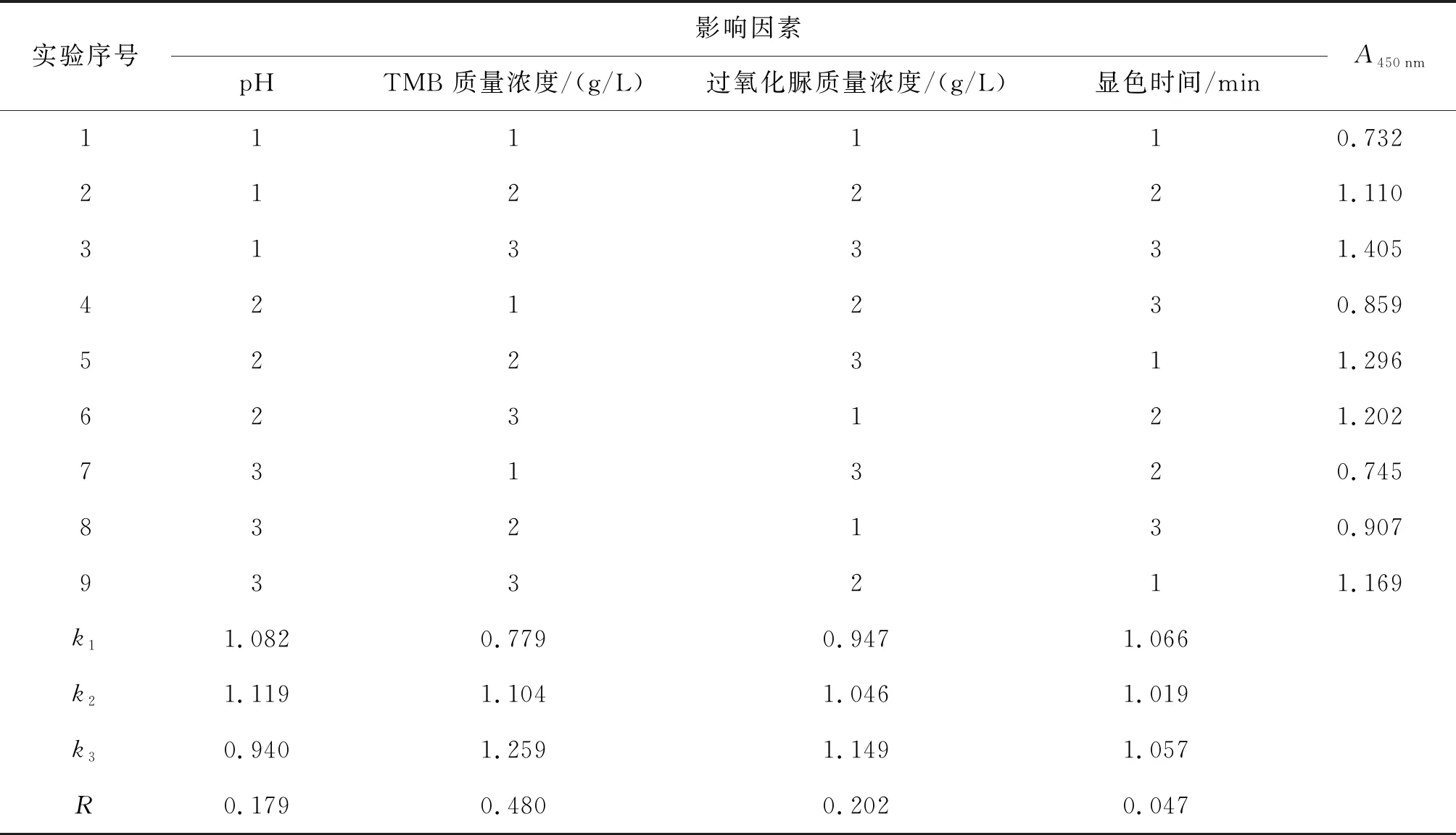
實驗序號影響因素pHTMB 質量濃度/(g/L)過氧化脲質量濃度/(g/L)顯色時間/minA450nm111110.732212221.110313331.405421230.859522311.296623121.202731320.745832130.907933211.169k11.0820.7790.9471.066k21.1191.1041.0461.019k30.9401.2591.1491.057R0.1790.4800.2020.047
注:k1、k2、k3為各因素同一水平下A450nm的平均值;R為各因素k1、k2、k3的極差.
3 結論與討論
HRP/TMB顯色過程是ELISA試驗成敗的關鍵因素. 本研究通過單因素試驗探討了pH、TMB質量濃度、過氧化脲質量濃度、DMSO體積分數、甘油體積分數和顯色時間對顯色效果的影響,并通過L9(34)正交實驗確定了影響顯色效果的主次順序為TMB質量濃度>過氧化脲質量濃度>pH>顯色時間,確定了HRP/TMB顯色體系最佳工作條件為pH為5.0,TMB質量濃度為0.4 g/L,過氧化脲質量濃度為0.4 g/L,DMSO體積分數為2%,甘油體積分數為0.5%,顯色時間為10 min. 在不添加保護劑的情況下,4 ℃儲藏,可穩定3個月左右.
與3種市售同類產品對比,自制的顯色液在靈敏度、顯色時間方面均較好,但穩定性要遠低于商品化的產品. 目前,本實驗研制的HRP/TMB雙組分顯色液能夠滿足絕大多數的實驗室ELISA研究,但尚不能滿足商品化銷售對保質期的要求. 后續,可嘗試通過添加聚乙烯吡咯烷酮、曲拉通X-405等穩定劑,進一步延長顯色液保質期,擴大其應用范圍[12-13].

