冬凌草甲素對大鼠腦出血后繼發性腦損傷的保護機制
熊靜,盧冬林2,王梓炫,邢昂
(青島大學附屬醫院,山東 青島 266100 1 老年醫學科; 2 神經外科)
腦出血(ICH)是第二常見的腦卒中類型,致死率和致殘率高[1-2]。迄今為止,ICH治療干預的重點是早期預防血腫擴張,包括止血和抗高血壓療法,但并不能夠有效減少血腫的擴張以及改善預后[3]。ICH分為原發和繼發性損傷,腦血管外滲的血液在實質中形成血腫,使局部壓力增大,導致原發性腦損傷,隨后血腫降解又會引起細胞損傷、氧化應激和炎癥反應,進而出現細胞死亡、腦水腫和神經行為缺陷等,導致繼發性損傷[4]。越來越多研究表明,血腫形成后炎癥反應和氧化應激與ICH誘發的繼發性腦損傷和神經功能障礙密切相關,針對治療腦血腫和ICH相關藥物研發一直以來都是研究的熱點[5-6]。冬凌草甲素(Ori)屬于二萜類化合物,具有抗炎、抗菌、抗腫瘤和抗氧化等多種生物學作用[7-8]。有研究表明,Ori可減輕脂多糖(LPS)誘導的小膠質細胞的炎癥反應[9]。Ori也可直接抑制核苷酸結合寡聚化結構域樣受體蛋白3(NLRP3)炎癥小體以及核因子κB(NF-κB)炎癥通路,減輕卡拉膠誘導的小鼠胸膜炎[10]。此外,Ori還可以激活Kelch樣環氧氯丙烷相關聯蛋白1(KEAP-1)/核轉錄相關因子2(Nrf2)信號通路的表達,從而發揮抗氧化的作用[10]。但是,Ori在ICH中的作用及機制尚不明確,故本研究對大鼠ICH模型進行Ori干預,觀察不同劑量Ori對ICH大鼠神經功能、神經元變性、NF-κB及Nrf2/血紅素加氧酶-1(HO-1)信號通路表達水平的影響,以探討Ori在ICH中的作用及其可能的機制。現將結果報告如下。
1 材料與方法
1.1 實驗材料
1.1.1實驗動物 SPF級雄性SD大鼠150只,體質量250~280 g,購自北京維通利華實驗動物公司。每籠6只群養于青島大學醫學部動物中心大鼠飼養室。飼養條件:環境清潔,溫度及濕度舒適,12 h晝夜交替,自由飲水和攝入食物。該動物實驗獲青島大學附屬醫院醫學倫理委員會同意。
1.1.2藥品和試劑 Ori購自上海阿拉丁生化科技股份有限公司(貨號:28957-04-2);膠原酶和Fluoro Jade-C(FJC)染料購自美國Sigma公司;腫瘤壞死因子(TNF)-α、白細胞介素(IL)-1β、IL-6酶聯免疫吸附試驗(ELISA)試劑盒購自武漢伊萊瑞特生物科技股份有限公司;NF-κB抗體購自美國Cell Signaling Technology公司;Nrf2、HO-1多克隆抗體購自美國Affinity公司。
1.2 實驗方法
1.2.1動物分組及處理 將大鼠隨機分為假手術組(Sham組,A組)、ICH組(B組)、溶劑組(ICH+Veh組,C組)、Ori低劑量組(ICH+LOri組,D組)、Ori中劑量組(ICH+MOri組,E組)、Ori高劑量組(ICH+HOri組,F組)。實驗大鼠在實驗前8 h禁止飲食。除Sham組外,其余5組大鼠使用膠原酶誘導建立ICH模型[11]。大鼠麻醉后固定在腦立體定向儀上,以前囟為原點,向右3.5 mm、向前0.2 mm作為穿刺點,進針深度5.5 mm,用10 μL微量注射泵以1 μL/min注入1 μL膠原酶Ⅳ(3 U),留針10 min,緩慢退針,用骨蠟封閉其骨孔,消毒縫合切口,將大鼠置于籠中觀察,待其麻醉復蘇。待大鼠麻醉清醒,Ori低、中、高劑量組于術后2、24和48 h分別給予Ori 5、15、25 mg/kg的腹腔注射(由于Ori可透過血-腦脊液屏障,故本次藥物注射的方式采用腹腔注射),ICH+Veh組腹腔注射等體積的生理鹽水。Sham組操作與ICH組相同,但不注射膠原酶。150只大鼠進行手術,其中114只手術成功,36只手術失敗或死亡。
1.2.2神經行為學檢測 手術或藥物處理72 h后,每組取6只大鼠,使用改良神經功能缺損程度評分(mNSS)對大鼠的神經功能進行評定,包括提尾試驗、行走試驗、感覺試驗、平衡木試驗等。對這些項目進行綜合評分,總分0~18分,評分越高,神經系統損害就越嚴重。
1.2.3腦含水量測定 神經功能評定后處死大鼠取全腦,去除嗅球和腦干,將其分為左腦、右腦、小腦等3部分,迅速稱濕質量。然后將腦組織放到烘箱,在100 ℃溫度下烘干24 h,稱干質量。腦含水量=(濕質量-干質量)/濕質量×100%。
1.2.4Western blot檢測NF-κB、Nrf2和HO-1蛋白表達 在手術和藥物處理72 h后,每組取6只大鼠,提取其腦組織置于-80 ℃冰箱里冷凍保存。取出冷凍的腦組織放在冰板上面,用刀片將ICH區域的腦組織分成5等份,取血腫周圍組織提取蛋白質(后續實驗取樣的腦組織均為血腫周圍組織),用BCA法測量蛋白質的濃度,SDS-PAGE凝膠跑膠,每孔上樣10 μg蛋白,電泳(80 V,30 min,再120 V跑到底),轉PVDF膜(250 mA,1.5 h),應用體積分數0.05牛奶封閉1.5 h,加一抗4 ℃過夜,加二抗室溫1.5 h,顯影。
1.2.5ELISA檢測TNF-α、IL-1β和IL-6表達 取Sham組、ICH組、ICH+Veh組和ICH+MOri組的大鼠腦組織,采用雙抗體夾心ELISA法檢測TNF-α、IL-1β、IL-6的表達。在酶標板中加100 μL標準品工作液或樣本,37 ℃孵育90 min,棄液,加100 μL生物素化抗體工作液,37 ℃孵育60 min,洗板3次;每孔加入100 μL HRP酶結合物工作液,37 ℃孵育30 min,棄液,洗板5次;每孔加90 μL底物溶液,37 ℃孵育15 min,每孔加50 μL終止液,立即讀取450 nm波長處的吸光度值。
1.2.6免疫熒光染色檢測Nrf2、HO-1的表達 取Sham組、ICH+Veh組和ICH+MOri組的大鼠腦組織進行免疫熒光染色。首先用40 g/L的多聚甲醛灌注取腦,蔗糖梯度沉糖后,進行冷凍切片;固定、通透、封閉切片,加Nrf2、HO-1一抗4 ℃過夜,加熒光二抗室溫1 h;用含DAPI的封片劑封片,螢光顯微鏡下觀察陽性細胞數。
1.2.7FJC染色檢測神經元損傷情況 取Sham組、ICH+Veh組和ICH+MOri組的大鼠腦組織進行FJC染色。腦組織冷凍切片室溫復溫30 min,用雙蒸水浸泡2 min,50 ℃烘干30 min,置于含10 g/L NaOH的體積分數0.80乙醇中浸泡5 min,置于體積分數0.70乙醇中浸泡2 min,以雙蒸水浸洗2 min;將切片放入0.6 g/L高錳酸鉀溶液中反應10 min,用蒸餾水浸洗2 min;將切片放入FJC溶液中反應20 min,以雙蒸水浸洗3次,每次2 min;再置50 ℃的烘箱中烘干,二甲苯透明2 min;最后用DPX封片液封片,在熒光顯微鏡下計數FJC陽性細胞并拍照。
1.3 統計學分析
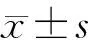
2 結 果
2.1 Ori對ICH大鼠神經功能評分的影響
手術或藥物處理72 h后,Sham組、ICH組、ICH+Veh組、ICH±LOri組、ICH+MOri組和ICH+HOri組的mNSS評分分別為0.67±0.58、10.33±1.53、10.00±1.73、8.00±1.00、6.67±0.58和6.33±0.58(n=6)。與Sham組比較,ICH組和ICH+Veh組的mNSS評分明顯升高(F=30.33,q=15.140、14.620,P<0.05),而ICH組與ICH+Veh組比較差異無顯著性(P>0.05);與ICH組和ICH+Veh組相比,Ori處理各組mNSS評分均有下降,其中ICH+MOri組、ICH+HOri組的差異具有顯著性(q=5.222~5.745,P<0.05),而ICH+MOri組和ICH+HOri組mNSS評分比較差異無統計學意義(P>0.05)。
2.2 各組腦組織含水量比較
各組大鼠左半腦和小腦含水量比較差異均無統計學意義(P>0.05)。ICH后大鼠右半腦含水量顯著增加,經過中、高劑量Ori處理后,大鼠右半腦含水量顯著降低(F=21.76,q=6.924~8.527,P<0.05),而ICH+MOri組和ICH+HOri組間腦水腫減輕的程度差異無統計學意義(P>0.05),ICH組與ICH+Veh組間相比較差異也無統計學意義(P>0.05)。見表1。
2.3 Ori對ICH大鼠腦組織中NF-κB、Nrf2以及HO-1表達的影響
ICH組和ICH+Veh組大鼠腦組織中NF-κB、Nrf2和HO-1的蛋白表達均較Sham組升高,經中、高劑量Ori處理后NF-κB表達降低,而Nrf2和HO-1的表達則進一步升高,差異均有統計學意義(F=15.17~61.18,q=6.303~10.110,P<0.05);ICH+MOri組和ICH+HOri組間各指標比較差異均無統計學意義(P>0.05)。見圖1、表2。
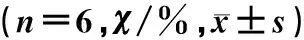

組別左半腦右半腦小腦A組78.68±0.7978.82±0.4878.73±0.54B組79.10±0.3181.83±0.7778.92±0.67C組79.21±0.5082.19±0.7679.06±0.31D組78.99±0.7881.18±0.8678.93±0.61E組79.04±0.3280.30±0.5578.83±0.77F組78.98±0.6879.86±0.4478.54±1.06
A:Sham組,B:ICH組,C:ICH+Veh組,D:ICH+LOri組,E:ICH+MOri組,F:ICH+HOri組。
圖1 各組大鼠腦組織中NF-κB、Nrf2和HO-1蛋白的表達
2.4 Ori對ICH大鼠腦組織炎癥因子表達的影響
綜合上述神經行為學、腦含水量以及Western blot的檢測結果,可知Ori在中、高劑量時均對ICH大鼠有神經保護作用,并且兩組治療效果無明顯差別,因此Ori處理各組中僅選擇ICH+MOri組進行后續實驗。
ICH后腦組織中炎癥因子TNF-α、IL-1β和IL-6的表達顯著升高,在Ori處理后各指標的表達明顯下降(F=24.53~69.26,q=6.208~17.120,P<0.05)。見表3。
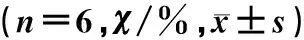

組別NF-κBNrf2HO-1A組63.34±4.1263.28±9.5830.06±9.92B組93.10±3.35106.45±10.7176.40±5.12C組95.01±9.05106.97±5.8369.29±10.55D組85.12±2.67125.02±12.3591.34±8.80E組74.84±5.12144.88±4.14122.09±6.94F組72.78±6.38144.95±5.18125.90±4.07
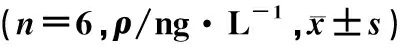

組別TNF-αIL-1βIL-6A組94.87±17.3532.83±7.0439.81±16.71B組308.99±30.53100.72±11.13106.38±15.18C組306.13±22.20106.34±17.11116.13±5.16E組180.93±12.2761.76±10.1072.62±7.30
2.5 各組腦組織中Nrf2和HO-1的熒光表達比較
ICH后抗氧化蛋白Nrf2及其下游蛋白HO-1的表達均增加,經中劑量Ori處理后,ICH+MOri組Nrf2和HO-1的表達較ICH+Veh組明顯增高,差異均具有統計學意義(F=347.30、61.14,q=4.780~18.880,P<0.05)。見圖2、表4。
2.6 各組神經元損傷情況比較
與Sham組相比,ICH+Veh組血腫周圍綠色熒光的數量明顯增多(F=97.99,q=19.970,P<0.05),而ICH+MOri組綠色熒光的數量較ICH+Veh組減少(q=13.180,P<0.05)。見圖3、表4。
3 討 論
ICH早期致死率、致殘率都很高,目前還沒有理想的治療方法[12-13]。越來越多的證據表明,氧化應激和炎癥在ICH后繼發性腦損傷中發揮著重要作用[14-16],這種繼發過程會導致ICH后病人的神經功能惡化[17]。本文的研究結果顯示,ICH+MOri組和ICH+HOri組大鼠的mNSS評分、FJC陽性神經元數量以及促炎因子表達均顯著下降,表明15和25 mg/kg的Ori均能夠改善ICH后早期腦損傷和神經功能缺陷,并且15 mg/kg為理想劑量。
小膠質細胞介導的炎癥損傷在ICH中起至關重要的作用用[18-19]。ICH發生后,小膠質細胞中的NF-kB會被激活,進而使促炎因子的釋放增加,導致早期腦損傷用[20],而這些促炎因子又作為NF-κB的激活劑,正反饋促進NF-κB的轉錄,進而加重炎癥反應[21]。NF-κB作為一個關鍵的核轉錄因子,一直被公認是炎癥反應的關鍵調節器[22],抑制NF-κB的活性可以減輕神經功能損傷[23]。已有多項研究表明,Ori在抗腫瘤、促凋亡、抗炎、抗氧化、神經調節等方面有著十分重要的作用[14-25],但其在ICH中的作用尚未見報道。ZHAO等[26]的研究結果顯示,Ori通過調節Toll樣受體4(TLR4)/NF-κB信號通路抑制促炎因子的表達,在小鼠急性肺損傷中起保護作用。有研究表明,Ori能夠抑制NF-κB通路和Aβ1-42誘導的神經炎癥[27]。本研究也證實了Ori的抗炎作用,在大鼠ICH后,15 mg/kg的Ori能夠抑制NF-κB的表達和促炎因子的釋放,減輕ICH后腦內的炎癥反應。
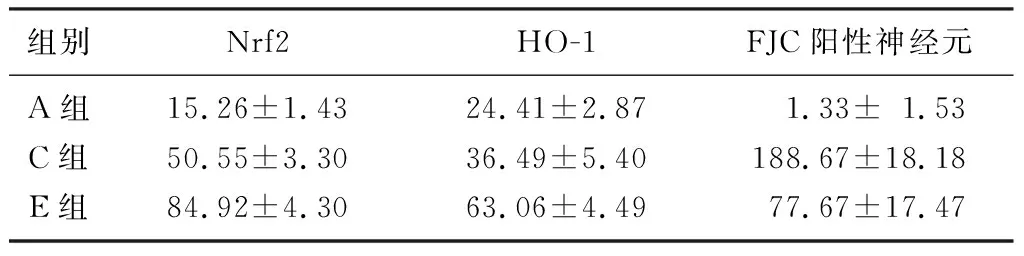
組別Nrf2HO-1FJC陽性神經元A組15.26±1.4324.41±2.87 1.33±1.53C組50.55±3.3036.49±5.40188.67±18.18E組84.92±4.3063.06±4.4977.67±17.47
此外,氧化應激是ICH后繼發性腦損傷的重要原因[28],Nrf2作為氧化應激反應中的關鍵轉錄因子和主要調節劑,在ICH后其表達逐漸增加,并誘導抗氧化基因的表達,在保護腦組織免受ICH后的氧化損傷中起重要作用[29]。研究已表明,Ori還可通過抑制NADPH氧化酶,促進KEAP-1與Nrf2解離,這樣就會使Nrf2進入細胞核中轉錄并激活下游蛋白HO-1,在疾病中發揮抗氧化作用[10]。ZENG等[30]研究表明,異黃體生成素可以加快激活Nrf2介導的抗氧化信號通路從而減少對實驗性ICH后的早期腦損傷。這與本研究結果類似,提示Ori可能通過促進Nrf2/HO-1抗氧化作用,減輕ICH大鼠的早期腦損傷,起到神經保護作用。
綜上所述,Ori對ICH模型大鼠早期腦損傷具有一定的保護作用,其機制可能為Ori通過促進Nrf2/HO-1抗氧化作用以及抑制NF-κB介導的炎癥通路,減少氧化應激和炎癥細胞浸潤,從而在ICH早期腦損傷中起到神經保護作用。

