四溴雙酚A 類阻燃劑的酶聯免疫方法的構建及應用
黃 哲,邵 杰,曾 昆,2*,張旭蕓,陳 斌,杜道林,3*
(1.江蘇大學環境與安全工程學院,江蘇 鎮江 212013;2.江蘇大學環境生態研究所,江蘇 鎮江 212013;3.江蘇大學農業工程研究院,江蘇 鎮江 212013)
四溴雙酚A(Tetrabromobisphenol A,TBBPA)由于極好的阻燃性能成為大量使用的溴代阻燃劑(Bromi?nated flame retardants,BFRs),常見于電子產品、紡織品等生活用品中[1]。2001年全球市場總需求達12萬t,2004年約17萬t[2]。正是由于TBBPA類阻燃劑的大量應用,導致其在環境樣品中廣泛檢出,在大氣[3-4]、水體、魚類[5-6]、土壤[7]、底泥[8-9]、植物[10]、鳥蛋[11]以及哺乳動物[12-13]中均有報道。研究發現TBBPA類化合物是潛在的環境內分泌干擾物,類似于持久性有機污染物,會在環境和生物體內積聚并且具有細胞毒性[14]、神經毒性[15]、內分泌干擾性[16]、免疫毒性[17]以及干擾甲狀腺激素[18]等作用。
四溴雙酚A雙(2-羥乙基)醚[TBBPA bis(2-hy?droxyethyl)ether,TBBPA-DHEE]是主要的 TBBPA 衍生物之一,在工程聚合物、環氧樹脂、熱塑性聚酯、聚氨酯等中廣泛應用。由于其具有較高的log Kow值,有研究人員認為TBBPA-DHEE具有一定持久性和生物蓄積性,并且具有較高的神經毒性。四溴雙酚A單(2-羥乙基)醚[TBBPA mono(2-hydroxyetyl)ether,TBBPA-MHEE]是TBBPAs類化合物及其衍生物在生產過程中的副產物[19]。由于結構與TBBPA-DHEE類似,TBBPA-MHEE可能與TBBPA-DHEE具有類似的毒性作用。然而,TBBPA-DHEE/TBBPA-MHEE在環境中累積、轉運以及分布的研究較為少見。因此,亟需建立TBBPA-DHEE/TBBPA-MHEE的檢測方法,為評估其環境行為提供技術手段。Liu等[19]建立了基于ESI-MS用于測定TBBPA-MHEE和TBBPA-DHEE及其他副產物或降解產物。但是TBBPA-DHEE的質子親和力低,基于ESI或APCI的離子源無法生成足夠的特定離子簇用于定量測定,必須通過AgNO3的衍生化,然而高濃度AgNO3的引入可能會增加儀器污染[20-21]。Liu等[22]應用超高效液相色譜儀-Orbitrap Fu?sion三重質譜檢測TBBPA-MHEE。但是若采用儀器方法,則需要優先獲得儀器資源并且需要在測樣品前對樣本按要求進行處理,且該方法也不能實現一次檢測多種樣品。以抗原-抗體特異性結合為基礎的免疫分析方法,由于其檢測手段簡單等優勢在環境分析領域被大量使用[21-24]。然而,應用免疫分析方法檢測TBBPA-DHEE/TBBPA-MHEE卻鮮有報道。
本研究以阻燃劑TBBPA-DHEE/TBBPA-MHEE為目標物,先通過設計半抗原結構,定期免疫小鼠;之后利用雜交瘤技術篩選出高靈敏度的單克隆抗體,并且對抗體的靈敏度等性質進行了鑒定;建立間接競爭性ELISA方法用于TBBPA-DHEE/TBBPA-MHEE的檢測;采集典型區域的環境樣本,分析其中TBBPADHEE/TBBPA-MHEE的分布情況。
1 材料與方法
1.1 材料
5~6周齡的雌性Balb/C小鼠購自揚州大學獸醫學院比較醫學中心,SP2/0骨髓瘤細胞購自武漢博士德生物工程有限公司,四溴雙酚A單(2-羥基二乙)醚標準品、四溴雙酚A雙(2-羥基二乙)醚標準品來自中科院生態環境中心,BSA、OVA、EDC·HCl、FCA、FIA、HAT(50×)、HT(50×)、50%PEG、3′-3′-5′-5′-四甲基聯苯胺(TMB)購自美國Sigma公司,HRP-IgG購自美國Jacket公司,胎牛血清(Fetal bovine serum,FBS)購自美國Gibico公司。其他常規試劑均購自國藥集團化學試劑有限公司。酶標板購于廈門怡佳美公司。多功能酶標儀(TECAN Infinite M1000 PRO)為奧地利TECAN公司生產。
1.2 TBBPA-DHEE半抗原的合成與鑒定
稱取2.86 g雙酚酸裝入圓底燒瓶內,加入甲醇20 mL,回流2 h得到2.9 g雙酚酸甲酯(a);將雙酚酸甲酯溶于40 mL冰醋酸中,然后慢慢加入10 mL含25.7 g液溴的冰醋酸,連續轉動5 h;將其倒入亞硫酸氫鈉的飽和水溶液,將上述步驟得到的物質通過快速硅膠柱色譜法獲得4,4-雙(3,5-二溴-4-羥苯基)戊酸甲酯(b);隨后利用(b)與2-溴乙醇進行相互作用,得到了化合物4,4-雙[3,5-二溴-4-(2-羥基乙氧基)苯基]戊酸甲酯(c);最后再通過化合物(c)與氫氧化鈉的相互作用后,即可得到半抗原4,4-雙[3,5-二溴-4-(2-羥基乙氧基)苯基]戊酸D3。合成路線如圖1所示。對合成TBBPA-DHEE的半抗原D3用質譜與核磁共振進行結構鑒定。
1.3 TBBPA-DHEE人工抗原的合成與鑒定
為了制備完全抗原,本研究采取了碳化二亞胺法將之前合成好的半抗原D3與載體蛋白(BSA、OVA)進行偶聯。400 mg EDC·HCl和20 mg載體蛋白溶于2 mL PBS(0.01 mol·L-1,pH 7.4)中,在室溫下搖勻 30 min。取60 mg半抗原D3溶于2 mL PBS中,和上述溶液混合均勻,反應4 h,然后在4℃冰箱條件下反應16 h。隨后將其吸出,在PBS溶液(0.01 mol·L-1,pH 7.4)中透析2 d。2 d后剩余在透析袋中的溶液,就是試驗需要的完全抗原,其中把BSA-D3用作免疫原,把OVA-D3用作包被原。將其進行分裝后,置于-20℃冰箱存放。
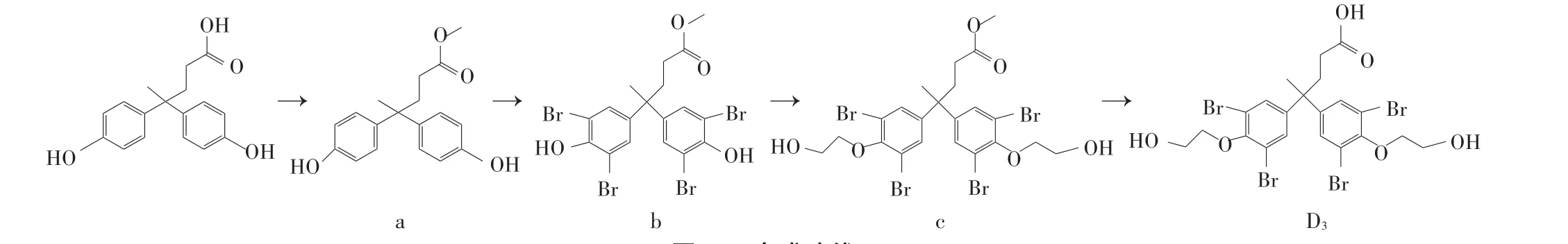
圖1 D3合成路線Figure 1 The synthetic route of the D3
人工抗原 BSA-D3、OVA-D3、BSA、OVA 和 TBB?PA-DHEE,配制濃度均為1 mg·mL-1,并用紫外分光光度計進行全波長掃描。
1.4 間接競爭ELISA方法的流程
將OVA-D3通過包被液(0.05 mol·L-1碳酸鹽緩沖液,pH 9.6)稀釋,以每孔100μL逐孔入酶標板中,4℃條件反應9 h。甩去包被液,利用洗滌液進行清洗。之后每孔加入200μL封閉液(含1%明膠的0.01 mol·L-1PBS,pH 7.4),37 ℃培養箱反應2 h。反應后,去除封閉液,拍干。用抗體稀釋液(含0.1%明膠的0.01 mol·L-1PBS,pH 7.4)將血清降低濃度,標準品用PBS降低濃度,將反應濃度的血清和標準品每孔對半各加入,每個濃度做3個平行并設空白對照和陽性對照,37℃反應2 h。競爭反應后,用洗滌液清洗,用吸水紙將板拍干后,逐孔加入適量濃度的羊抗鼠酶標二抗,37℃孵育60 min,隨后步驟和之前反應結束后步驟一致。拍干后每孔滴入100μL的TMB顯色液,在培養箱內放置20 min左右。從培養箱中取出酶標板后滴入2 mol·L-1的H2SO4,使反應結束進程。最后通過儀器酶標儀來測定其在450 nm處的吸光度。
1.5 單克隆抗體的制備與篩選
通過頸背部皮下多處注射的方法將BSA-D3與FCA進行乳化后的乳化物免疫6~8周齡Balb/C雌性小鼠;4周后換取BSA-D3與FIA乳化后的乳化物進行小鼠免疫。第5次免疫后,采用1.4的方法對抗血清進行篩查,選擇抗體效價與靈敏度滿足要求的小鼠,取出脾臟細胞,與骨髓瘤細胞SP2/0進行融合,并進一步克隆并篩選出單克隆細胞。
1.6 單克隆抗體的鑒定
1.6.1 類與亞型的鑒定
采用Thermo單克隆抗體亞型鑒定試劑盒對細胞培養液上清進行亞類鑒定。
1.6.2 抗體靈敏度的測定
通過建立的ELISA方法模擬出標準曲線,計算抗體的半數抑制率(50%Inhibition of concentration,IC50)。其中以不添加標準品OD值為B0,添加不同比例標準品的OD值為B,將B和B0的比值設為縱坐標,標準品濃度的對數值設為橫坐標。
1.6.3 抗體交叉反應率測定
選取結構類似物進行交叉反應測定,測定其特異性。公式為:交叉反應率(CR%)=IC5(0待檢測標準片濃度)/IC5(0其他衍生物濃度)×100%。
1.7 ELISA方法建立
1.7.1 抗體和包被原用于反應的最佳濃度
采用棋盤法確定抗原-抗體結合濃度。包被不同濃度的OVA-D(31∶1 000倍比稀釋到1∶32 000),不同濃度的抗體(1∶20倍比稀釋到1∶2 560),其他流程同1.4。采用酶標儀確定其在450 nm的OD值,并選取OD值在1.0左右的包被原和抗體稀釋濃度作為優化后的反應濃度。
1.7.2 確定最優pH值
按1.7.1確定的結果進行前面的步驟,之后利用不同pH值的緩沖溶液稀釋標準品,pH分別為4.0、5.0、7.4、8.0和10.0,之后步驟不變,測定450 nm處的吸光度,確定pH值。
1.7.3 確定最優蛋白濃度
標準品用不同蛋白質濃度(0、0.10%、0.50%、1%、5%、10%)的緩沖液降低濃度,完成ELISA反應,確定蛋白質濃度。
1.7.4 確定最優離子強度值
利用不同離子強度(0、0.01、0.05、0.1、0.2 mol·L-1)緩沖液降低標準品濃度,ELISA反應后,確定離子強度。
1.7.5 確定有機溶液濃度
用不同濃度的甲醇(分別為0、5%、10%、20%、30%、50%)緩沖液降低標準品濃度,ELISA反應后,通過450 nm處的吸光度,選擇甲醇濃度。
1.7.6 標準曲線的建立
基于上述優化條件,按照1.4中的操作流程,建立標準曲線,每個平行設置2組重復。用四參數方程擬合標準曲線,按照下式計算檢測限(Limit of detection,LOD)、半數抑制率(IC50)及檢測范圍(IC20~IC80)。
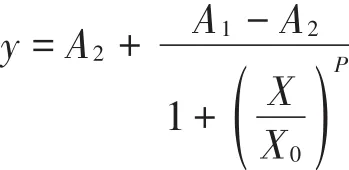
式中:y為吸光度的比值A/A0;X為已知的標準品濃度,ng·mL-1;A1為擬合成功曲線的上漸近線斜率;A2為擬合成功曲線的下漸近線斜率;X0即為IC50的值,ng·mL-1;P是IC50處點的斜率。
1.8 典型環境樣本的采集、前處理及檢測
山東省壽光市是我國主要的BFRs生產地,當地有多家TBBPA及其衍生物生產工廠。于2016年10月對山東省壽光市溴代阻燃劑加工基地附近水樣和土樣進行收集,分裝并保存在-20℃條件下。
水樣的前處理方法:用10 mL注射器吸取水樣,并使用0.22μm硝酸纖維素膜進行過濾,濾液直接用于檢測。
土壤樣本的前處理方法:將樣本凍存干燥后,使用研缽打碎研磨至粉狀;在加速溶劑萃取(Accelerat?ed solvent extraction,ASE)反應釜中加入一半量的硅藻土,稱取1 g土壤樣本加入反應釜中用玻璃棒輕輕攪勻,使得土樣樣本與硅藻土充分混勻后,用硅藻土將反應釜填滿,上機待測;加入萃取劑,萃取樣本中待檢測物;收集萃取液,旋轉蒸發,保留5 mL左右;將剩余的萃取劑用氮氣吹干,然后用含有一定濃度的甲醇進行復溶,用于檢測。
參考Tian等[25]的方法采用ESI-MS方法對樣本中的TBBPA-DHEE/TBBPA-MHEE進行檢測。其中針對TBBPA-DHEE的最低檢測限LOD為0.49 ng·mL-1,TBBPA-MHEE的LOD為0.33 ng·mL-1。
2 結果與分析
2.1 TBBPA-DHEE半抗原的鑒定
由于TBBPA-DHEE屬于小分子物質,不具備免疫原性,需要與大分子載體蛋白偶聯獲得完全抗原。然而,TBBPA-DHEE結構中沒有活性基團,無法直接偶聯,需要衍生化;同時需要考慮暴露適當結構,作為抗原識別表位[26-28]。根據目標物質的分子結構,采用兩種策略:(1)從苯環側鏈的羥基衍生,以兩個苯環及其側鏈作為表位;(2)從兩個苯環中間的支鏈進行衍生,以一側的苯環及其側鏈作為表位。前期本課題組采用前一種策略合成了半抗原M3,免疫家兔制備了TBBPA-DHEE多克隆抗體,并建立了競爭性ELISA方法,其IC50為9.868 ng·mL-1[26]。在本研究中,通過苯環中間的支鏈衍生出羧基,獲得半抗原D3。對TBB?PA-DHEE的半抗原D3用核磁共振氫譜和質譜分析法進行鑒定。質譜結果如圖2所示,核磁共振氫譜結果如圖3所示,根據對特征峰形的研究、化合物官能團中氫原子數量種類的分析以及對化學位移的分析,結果表明反應產物為目標化合物,即TBBPA-DHEE半抗原D3。
2.2 TBBPA-DHEE人工抗原的鑒定
通過紫外掃描全光譜的方法按照吸收峰位置的變化,可以判斷出半抗原與載體蛋白的偶聯情況。如圖4為BSA-D3、OVA-D3等物質的紫外吸收光譜圖。半抗原、載體蛋白和結合物的紫外吸收光譜發生了顯著變化,結合物的峰位發生了位移,說明免疫原偶聯是成功的。
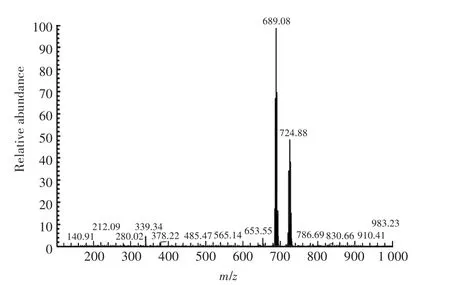
圖2 半抗原D3的電噴霧質譜圖Figure 2 ESI-MSspectrogramfor hapten D3
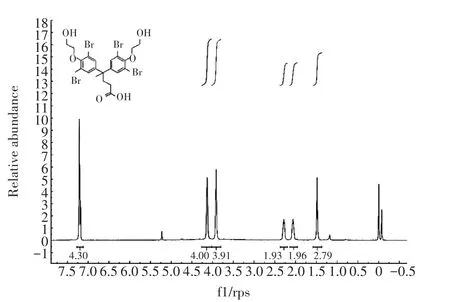
圖3 半抗原D3的核磁共振氫譜圖Figure 3 1H-NMRspectrogramfor hapten D3
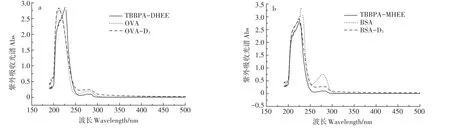
圖4 OVA、BSA及偶聯物的紫外吸收光譜Figure 4 UV absorption spectrogramof the D3 and conjugate
2.3 單克隆抗體制備與鑒定
用ELISA方法對免疫后的抗血清進行效篩選,結果見表1,其中抗血清以1∶2 000用抗體稀釋液稀釋。可以看出1、2、3號小鼠血清的效價較高,同時比較其在0.250μg·mL-1時抑制率,發現1號小鼠的抑制率最高(75.9%)。因此,最終選擇1號Balb/C小鼠進行后面細胞融合試驗。
經過多次克隆培養后,獲得5株能夠穩定分泌TBBPA-DHEE單克隆抗體的雜交流細胞株,標記為E2D2、D2D4、C2D6、D4G6、F7D5。經亞型鑒定試劑盒測定,5株單克隆抗體均為IgG1型、Kappa鏈。
同時對5株單克隆抗體的特異性進行了鑒定(表2)。結果顯示,這5株單克隆抗體與TBBPA、TBBPADAE、TBBPA-DBPE、TBBPA-MHPE、TBBPA-MBPE、TBBPA-MAE沒有交叉反應,而與TBBPA-MHEE均有不同程度的交叉反應(55.32%~83.32%)。根據TBBPA-DHEE和TBBPA-MHEE的結構,可以看出,二者結構具有較高的相似性,僅在側鏈有所不同。因此所得抗體能夠同時識別這兩種物質。鑒于D4G6株抗體與TBBPA-MHEE有較高的交叉反應,因此后續試驗中用其構建同時檢測TBBPA-DHEE與TBBPAMHEE的免疫分析方法。
2.4 ELISA條件優化結果
首先采用棋盤法確定抗原-抗體最佳反應濃度,結果見表3。選擇吸光度在1.2前后且相鄰濃度結果下吸光度區分較為明顯的位點,由此確定的濃度為包被原1∶640,抗體1∶4 000。
在ELISA反應體系中,抗原抗體的結合通過非共價鍵的結合作用,體系處于動態平衡中,故反應緩沖液對整個體系起著至關重要的作用。在反應過程中,溶液的成分、pH以及有機溶劑均能夠影響檢測方法的靈敏度。本研究選擇IC50和ODmax兩個指標來判斷最佳條件,通常認為最優條件下IC50越低而ODmax越高。試驗結果整合于圖5。從試驗結果來看,隨著pH的增加,IC50和ODmax均呈現先升高后降低的態勢,其中當pH為10時,IC50最小,而pH為7.4時,ODmax最大。綜合兩個指標的結果,選用pH 7.4作為優化參數。從圖中可以看出,溶液中含有適量的蛋白(0.5%BSA)有助于提升方法的靈敏度。緩沖液中Na+離子強度升高會導致ODmax的降低,同時使得IC50先降低后升高。最終選擇0.01 mol·L-1Na+作為最佳濃度。由于TBB?PA-DHEE和TBBPA-MHEE脂溶性較強,因此需要有機溶劑進行助溶[29],本研究選擇常用的甲醇作為助溶劑進行評估。伴著緩沖液中甲醇含量的增加,ODmax呈先減小后增加再減小的趨勢。故選擇甲醇含量為30%作為優化條件。
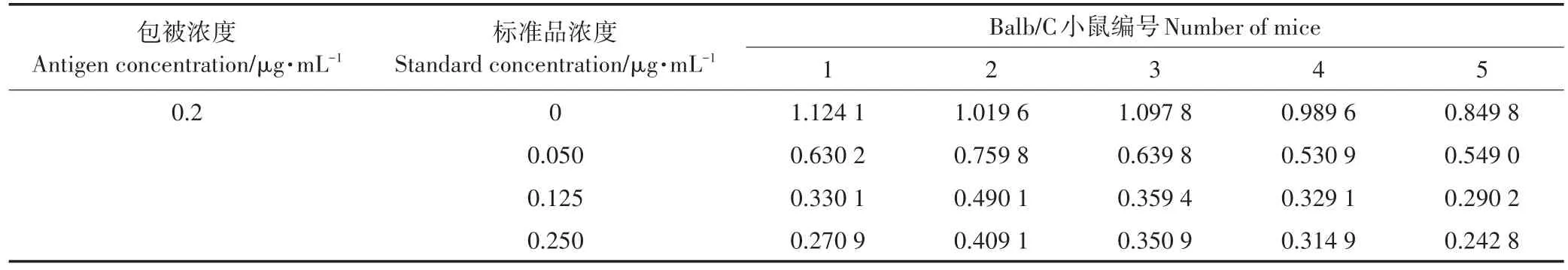
表1 抗血清的篩選Table 1 Screening of antiserum
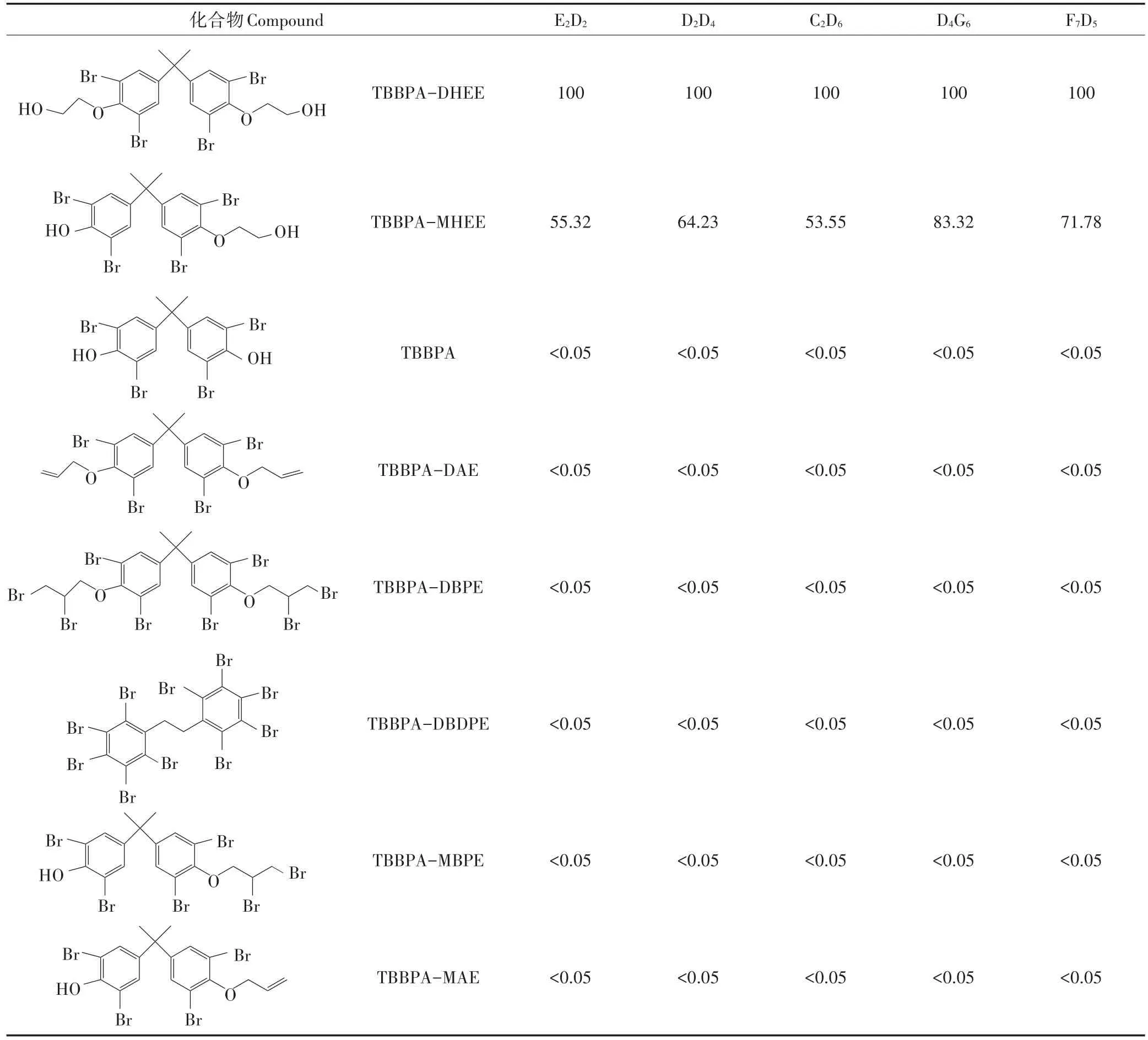
表2 單克隆抗體的交叉反應率(%)Table 2 Cross-reactivity of monoclonal antibodies(%)
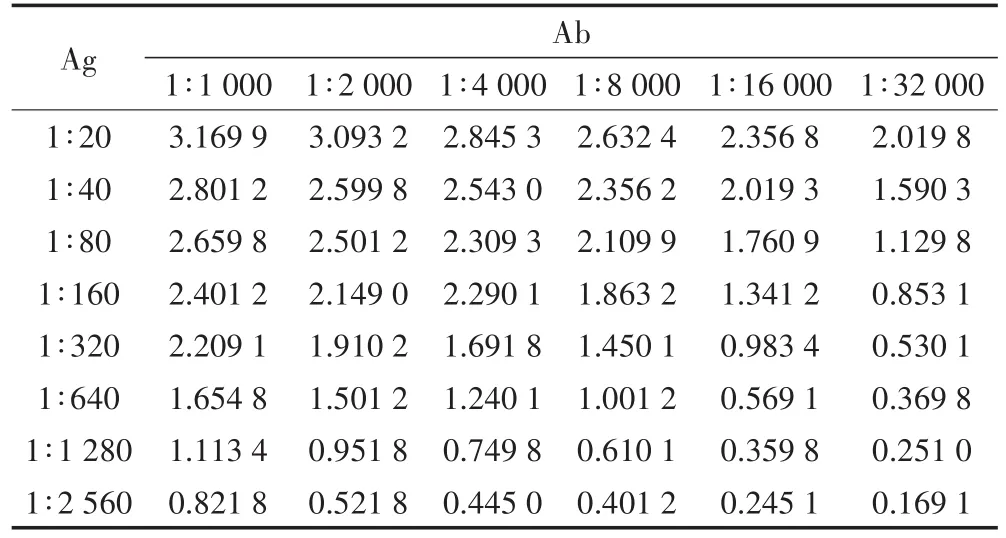
表3 棋盤法選擇包被原及抗體反應稀釋比例Table 3 Dilution rate of coating antigen and antibody by checkerboard method
2.5 同時檢測TBBPA-DHEE和TBBPA-MHEE標準曲線的建立
在上述ELISA的優化條件下,基于D4G6株單克隆抗體,按照梯度分別稀釋TBBPA-MHEE的標準品濃度(CK、0、0.1、1、3、10、30、100、1 000 ng·mL-1)和TBB?PA-DHEE的標準品濃度(CK、0、0.312 5、0.625、1.25、2.5、5、10、20 ng·mL-1)做標準曲線,每組4個平行。建立TBBPA-MHEE與TBBPA-DHEE的競爭ELISA標準曲線(圖6)。該方法檢測出TBBPA-MHEE的IC50為3.51 ng· mL-1,線性范圍是0.86~13.7 ng·mL-1,LOD為0.78 ng·mL-1,R2≥0.99。檢測TBBPA-DHEE的IC50為2.76 ng·mL-1,線性范圍在0.96~8.098 ng·mL-1,LOD為0.56 ng·mL-1,R2≥0.99。
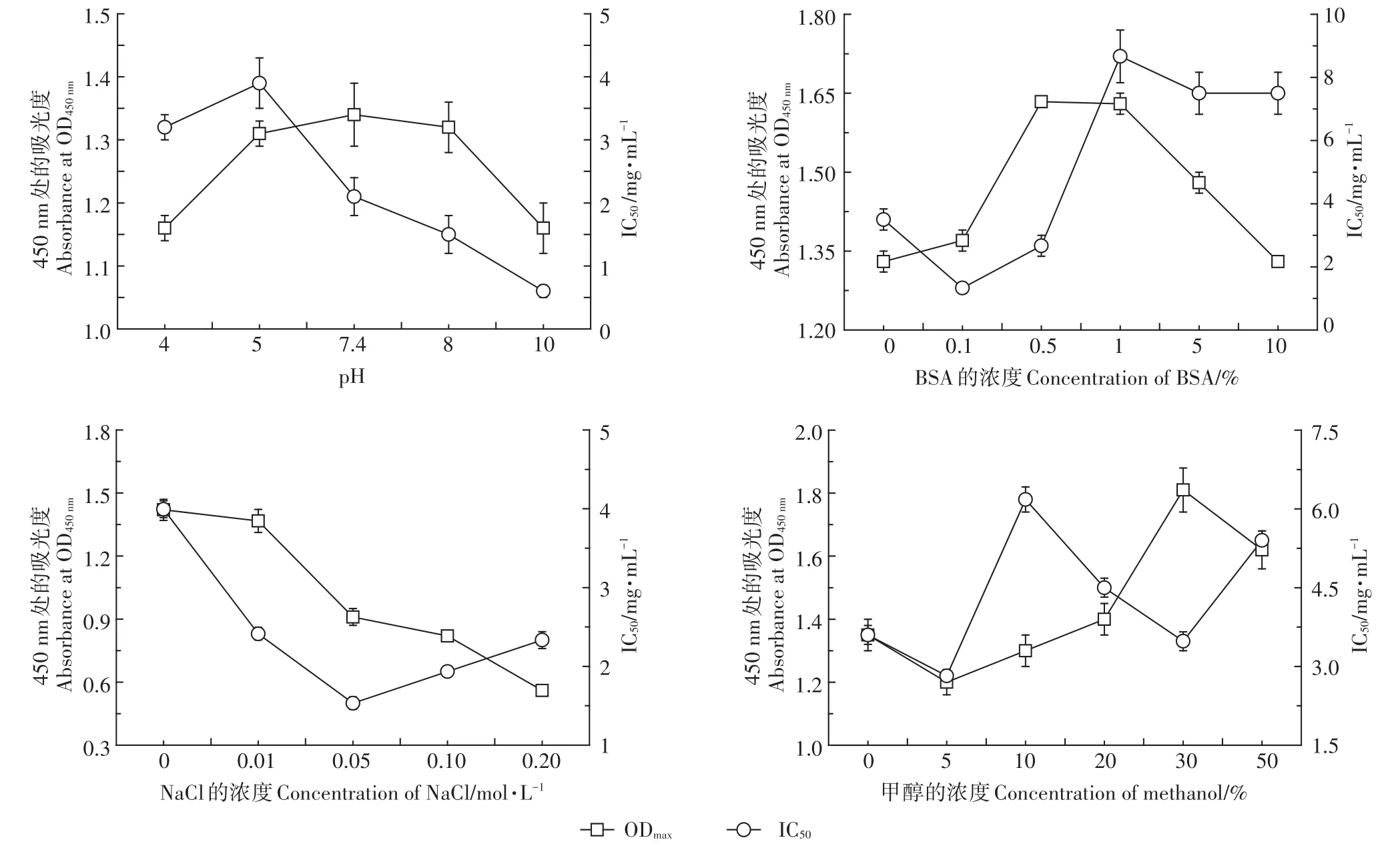
圖5 不同緩沖液條件下的ODmax和IC50值Figure 5 ODmax and IC50 value of ELISA in various buffer conditions
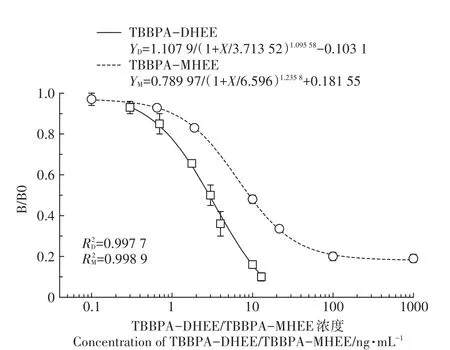
圖6 同時檢測TBBPA-DHEE和TBBPA-MHEE的ELISA標準曲線Figure 6 Calibration curve for TBBPA-DHEEand TBBPA-MHEEby ELISA
2.6 典型區域環境樣本中的TBBPA-DHEE和TBB?PA-MHEE
由于TBBPAs的廣泛應用,在多種環境樣本中均有檢出報道,然而對于TBBPA-DHEE/TBBPA-MHEE在環境中分布情況報道較少。僅有Liu等[30]在山東省一家BFR廠家周圍的土壤樣本中檢測到TBBPAMHEE,濃度在ND~13.7 ng·g-1DW;Zhang等[26]在鎮江市區域內采集了池塘水、自來水、湖水、河水和稻田水,并應用ELISA方法對環境水樣進行了檢測,發現TBBPA-DHEE/TBBPA-MHEE的含量在1.5~7.7 ng·mL-1。
山東省壽光市是我國主要的BFRs生產地,當地有多家TBBPA及其衍生物生產工廠。于2016年8月對山東省壽光市某生產BFRs工業區域周邊環境采樣,對樣本采用1.8中提到的處理流程及方法,并應用建立的ELISA方法檢測樣本中TBBPA-DHEE和TBBPA-MHEE。在表4中發現TBBPA-DHEE/TBB?PA-MHEE在水樣中檢出率為80%,檢出濃度在1.759~15.45 ng·mL-1,土壤樣本中檢出率為100%,檢出濃度在1.12~6.75 ng·g-1。同時,采用ESI-MS對采集的樣本進行了檢測,結果與ELISA具有較好的一致性。但是,由于所獲得的抗體對TBBPA-DHEE和TBBPA-MHEE均有較好的識別能力,因此建立的ELI?SA方法檢測的是TBBPA-DHEE和TBBPA-MHEE的總量。在后續試驗中,篩選特異性識別這兩種靶物質的抗體,建立特異性的檢測方法,則是筆者的研究重點。
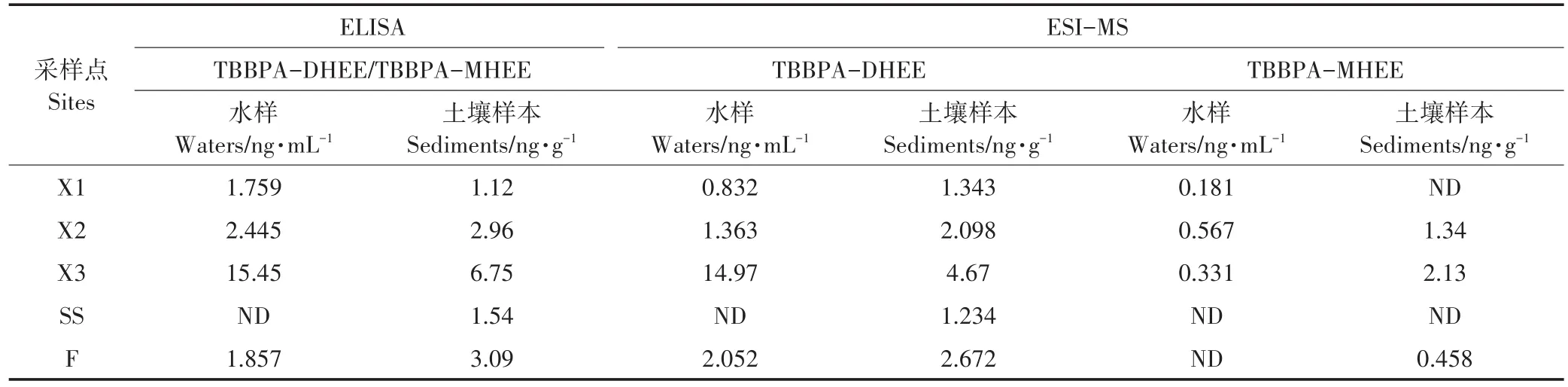
表4 環境樣本中TBBPA-DHEE和TBBPA-MHEE濃度Table 4 Occurrence of TBBPA-DHEEand TBBPA-MHEEin samples
3 結論
(1)設計并合成制備TBBPA-DHEE半抗原D3,并將D3與載體蛋白BSA、OVA偶聯結合;免疫小鼠并篩選血清后,采用雜交瘤技術制備抗TBBPA-DHEE單克隆抗體5株,經鑒定這5株抗體均能同時識別TBB?PA-MHEE和TBBPA-DHEE,并與其他TBBPA類似物沒有交叉反應;基于單克隆抗體D4G6,建立了ELI?SA方法,優化條件后,其針對TBBPA-DHEE的IC50和LOD分別為2.76 ng·mL-1和0.56 ng·mL-1,針對TBB?PA-MHEE的IC50和LOD分別為3.51 ng·mL-1和0.78 ng·mL-1。
(2)以建立的ELISA方法檢測了山東省壽光市一家BFR工廠周邊的水樣和土壤樣本,發現TBBPADHEE/TBBPA-MHEE在水樣中檢出濃度在1.759~15.45 ng·mL-1,土壤樣本中檢出濃度在1.12~6.75 ng·g-1。酶聯免疫分析方法的建立為環境中污染物的分布調查,繼而進行風險評估提供了有效的技術手段。

