黃菊對油茶林2種雜草萌發和幼苗生長的化感作用
古 龍,夏翩翩,李建安
(中南林業科技大學 a.經濟林育種與栽培國家林業局重點實驗室; b.經濟林培育與保護省部共建教育部重點實驗室;c.經濟林培育與利用湖南省2011 協同創新中心; d.南方丘陵山地生態經濟林產業工程技術研究中心,湖南 長沙 410004)
黃菊是菊科菊花Chrysanthemum morifolium的藥用品種,其花為干燥頭狀花序,為我國常用中藥,具有清熱、疏風、解毒、明目等功效,可治療頭痛、眩暈、目赤、心胸煩熱、疔瘡、腫毒等癥[1]。現代醫學研究結果表明,菊花還具有降血壓、改善冠心病[2]、抗病毒、抗菌、抗炎、預防高血脂、抗衰老[3]等作用。目前,中國市場上有八大主流藥用菊花種類,分別為杭菊、濟菊、亳菊、滁菊、貢菊、祁菊、懷菊和黃菊[4]。菊科中至少有39 個屬存在化感作用[5],即植物之間(包括微生物)相互的化學關系對植物的生長產生抑制或促進的作用[6]。已鑒定出的化感物質多為萜類、聚乙炔類、酚類、有機酸類等,這些化感物質對多種受體植物表現出程度不同的抑制或促進效應[5]。
雜草是指對人類活動沒有用處或有害于生產場地的一切植物。由于雜草生長迅猛可消耗大量水分,且和油茶爭奪土壤養分、CO2等,同時可加重油茶病蟲害,并增加了農事操作難度,其已成為影響油茶生長、產量、品質的關鍵因素[7]。由于地形原因,進行油茶林下雜草防治的機械除草技術尚未成熟,使用化學藥劑或人工除草仍是主要的除草方式。化學除草會對生態環境產生多種綜合危害[8],還可能對茶油生產造成安全隱患;人工除草不但費時費力,而且防治周期短。研發天然的化學除草劑——化感物質來控制雜草,對農林生態生產有著重要意義,越來越受關注[9]。熊利等[10]研究了花生、大豆和黃菊3 種經濟作物間作對油茶幼林樹體生長的影響,發現黃菊能促進油茶幼樹的營養生長。已有研究表明,經濟作物菊芋Helianthus tuberosus的莖葉混合基質能顯著降低雜草密度[11]。王麗等[12]研究了腫柄菊莖葉提取物的除草活性,并證實活性物質為腫柄菊內酯A。陳業兵[13]通過試驗發現,銀膠菊花葉浸提液可以抑制稗和苘麻的種子萌發和幼苗生長。化感物質進入環境的方式較多,降雨是唯一可以將物質淋溶出來的方式[14]。
基于黃菊的生態經濟價值及潛在化感效應,筆者通過水浸提模擬自然的方式,研究黃菊地上部分莖葉和地下部分根際土的浸提液對油茶林下雜草白茅和狗尾草的種子萌發及幼苗生長的影響,探討黃菊對雜草的化感作用,旨在為油茶林下間作黃菊提供參考。
1 材料與方法
1.1 受體材料
白茅Imperata cylindrica種子和狗尾草Setaria viridis種子購買于江蘇新泰種業批發公司。
1.2 試驗方法
1.2.1 黃菊莖葉和根際土的采集與保存
2019年8月20 日,在湖南省常德長嶺農業科技發展有限公司基地,選擇長勢一致且無病蟲害的黃菊植株連根挖出。將靠近根系的土壤用細毛刷刷至自封袋中,然后將根部剪斷,取地上部分裝于自封袋中,帶回實驗室。將取回的黃菊地上部分去除枯葉雜質,用清水沖洗3 次,再用純水沖洗2 次,置于通風處陰干48 h,剪成2 ~3 cm碎段混合物備用。將根際土自然風干1 周后,采用高速萬能粉碎機(浙江屹立工貿有限公司)粉碎,過100 目篩,裝進自封袋,于干燥陰涼處保存備用。
1.2.2 黃菊莖葉與根際土浸提液的制備
稱取50 g 黃菊莖葉碎段混合物,放入1 L 錐形瓶中,加入500 mL 蒸餾水,封口后放在恒溫搖床24 h(25 ℃、100 r/min)。結束后,用紗布過濾掉殘渣,再用雙層濾紙過濾1 次,最后用 0.45 μm 濾膜抽濾,即得0.1 g/mL 母液。根際土浸提液制備方法與莖葉浸提液相同。將得到的浸提液母液保存在4 ℃冰箱備用。
1.2.3 受體植物種子萌發和幼苗生長指標的測定
將受體種子用2%次氯酸鈉溶液浸泡10 min后,用清水沖洗5 min,再用蒸餾水清洗3 次,用濾紙擦干備用。在已滅菌的一次性塑料培養皿(直徑9 cm)中,平鋪2 張直徑90 mm 的濾紙,分別選取籽粒飽滿且大小一致的50 粒種子均勻放置其中。用蒸餾水將浸提液母液分別稀釋至0.02、0.06和0.10 g/mL,以蒸餾水為對照,每個處理重復3 次。每只培養皿首次添加5 mL 浸提液,之后每天補充等量浸提液,保持濾紙濕潤。萌發環境為25 ℃且每日光照16 h 的人工氣候室。每隔24 h 統計每皿的發芽數,突破種皮1 mm 視為發芽,連續統計 7 d。第10 天,從每個培養皿中隨機挑選10 株幼苗,測量幼苗的高和根長,由于幼苗質量較小,以10株幼苗干鮮質量的總和進行比較,不足10 株的根據平均值換算成10 株的干質量和鮮質量,再進行比較。
1.3 數據分析
發芽率(germination rate)為第7 天發芽的種子數占每皿種子總數的百分比;發芽勢(germination energy)為第5 天發芽的種子數占每皿種子總數的百分比。發芽指數(germination index,Ig)和活力指數(vigor index,Iv)的計算公式如下。
Ig=ΣGt/Dt。
式中:Gt為第t天對應的發芽種子數,Dt為第t天對應的發芽日數。
Iv=Ig×S。
式中:S為第10 天的幼苗高[15]。
參照Williamson 等[16]的方法計算化感作用效應指數(allelopathic response index,Ir)。
Ir=VT/VC-1。
式中:VC為對照值;VT為處理值。Ir>0 為促進,Ir<0 為抑制,絕對值的大小與作用強度一致。
化感綜合效應指數(synthetical effect index of allelopathy,Ise)可以反映化感效應的強度,是指同一處理下同一受體各測試項目化感效應指數(Ir)的算術平均值[15]。
Ise=(Ir發芽率+Ir發芽勢+Ir發芽指數+Ir活力指數+Ir鮮質量+Ir干質量+Ir根長+Ir苗高)/8。
用Microsoft Excel 2010 軟件處理數據;用SPSS 22.0 軟件進行單因素方差分析,用Duncan氏檢驗法進行多重比較;用Origin 2017 軟件作圖。
2 結果與分析
2.1 黃菊莖葉及其根際土浸提液對雜草種子萌發的影響
2.1.1 黃菊莖葉及其根際土浸提液對雜草種子萌發率的影響
黃菊根際土浸提液對雜草種子萌發率的影響如圖1A所示。由圖1A可見,黃菊根際土浸提液處理下,2 種雜草種子的發芽率均受到了影響,僅白茅在 0.02 g/mL 處理組中的發芽率與對照組持平。在0.06、0.10 g/mL 根際土浸提液處理下白茅種子的發芽率受到抑制,且在0.06 g/mL 根際土浸提液的抑制效果最大,發芽率比對照顯著降低了12.67 百分點 (P<0.05),在0.10 g/mL 處理組中發芽率比對照降低了6.67 百分點。在各質量濃度根際土浸提液處理下,狗尾草種子的發芽率分別降低了13.67、13.67、10.33 百分點,但與對照的差異均不顯著。
黃菊莖葉浸提液對雜草種子萌發率的影響如圖1B 所示。由圖1B 可見,黃菊莖葉浸提液對2種雜草種子發芽率的抑制效果,均表現為質量濃度越高抑制效果越強。在0.02、0.06 和0.10 g/mL莖葉浸提液處理中,白茅種子的發芽率分別降低了22.67、83.33 和100.00 百分點,且各處理間的差異達到顯著水平(P<0.05)。在0.02、0.06 和0.10 g/mL 莖葉浸提液處理中,狗尾草種子的發芽率分別比對照顯著降低了15.00、71.67 和78.33 百分點(P<0.05)。

圖1 黃菊莖葉及其根際土浸提液對雜草種子發芽率的影響Fig.1 Effect of leaching solutions from C.morifolium stem-leaf and its rhizosphere soil on germination rate of weed seeds
2.1.2 黃菊莖葉及其根際土浸提液對雜草種子發芽勢的影響
霧霾天氣是我國粗放經濟發展的結果之一,我國必須實施綠色GDP的核算才能有效地轉變經濟增長模式,促進我國社會經濟的可持續發展。綠色GDP的實施是一項非常復雜的工程,需要政府、企業以及整個社會的共同努力。
黃菊根際土浸提液對雜草種子發芽勢的影響如圖2A 所示。由圖2A 可見,黃菊根際土浸提液處理下,白茅種子發芽勢在低質量濃度(0.02 g/mL) 處理組中比對照提高了2.67 百分點,在0.06、 0.10 g/mL 處理組中比對照分別降低了10.00 和2.67百分點,且在0.06 g/mL 處理組與對照的差異達到顯著水平(P<0.05)。0.02、0.06 和0.10 g/mL根際土浸提液對狗尾草種子發芽勢均產生了抑制效果,發芽勢分別比對照降低了11.00、17.00 和11.00 百分點,且在0.06 g/mL 處理組與對照的差異達到顯著水平(P<0.05)。
黃菊莖葉浸提液對雜草種子發芽勢的影響如圖2B 所示。由圖2B 可見,黃菊莖葉浸提液對2種雜草種子發芽勢的抑制效果,均表現為質量濃度越高抑制效果越強。在0.02、0.06 和0.10 g/mL莖葉浸提液處理中,白茅種子的發芽勢分別比對照降低了34.00、88.00、94.00 百分點,且3 種處理均與對照差異顯著(P<0.05)。在0.02、0.06和0.10 g/mL 莖葉浸提液處理中,狗尾草種子的發芽勢分別比對照顯著降低了23.67、71.67、75.00百分點(P<0.05),在莖葉浸提液的抑制作用下2 種雜草在第5 天的發芽勢均為0。
2.1.3 黃菊莖葉及其根際土浸提液對雜草種子發芽指數的影響
黃菊根際土浸提液對雜草種子發芽指數的影響如圖3A 所示。由圖3A 可見,低質量濃度根際土浸提液促進白茅種子的發芽指數提高,高質量濃度根際土浸提液抑制其發芽指數。在0.02 g/mL處理組中,白茅種子的發芽指數比對照高出6.94%,在0.06 g/mL 處理組中其發芽指數顯著較對照降低8.32%(P<0.05),在0.10 g/mL 處理組中較對照降低3.16%。在各質量濃度根際土浸提液處理組中,狗尾草種子的發芽指數均低于對照組,在0.06 g/mL 處理組中其發芽指數較對照組顯著降低24.98%(P<0.05),在0.02 和0.10 g/mL 處理組中分別比對照降低14.1%和23.28%。
黃菊莖葉浸提液對雜草種子發芽指數的影響如圖3B 所示。由圖3B 可見,莖葉浸提液對2 種雜草種子發芽指數的影響,均表現為質量濃度越高抑制效果越強。在0.02、0.06 和0.10 g/mL 莖葉浸提液處理中,白茅種子的發芽指數分別比對照組顯著降低了39.96%、77.39%和100%(P<0.05),狗尾草種子的發芽指數分別比對照組顯著降低了39.18%、64.63%和66.96%(P<0.05)。

圖2 黃菊莖葉及其根際土浸提液對雜草種子發芽勢的影響Fig.2 Effect of leaching solutions from C.morifolium stem-leaf and its rhizosphere soil on germination energy of weed seeds
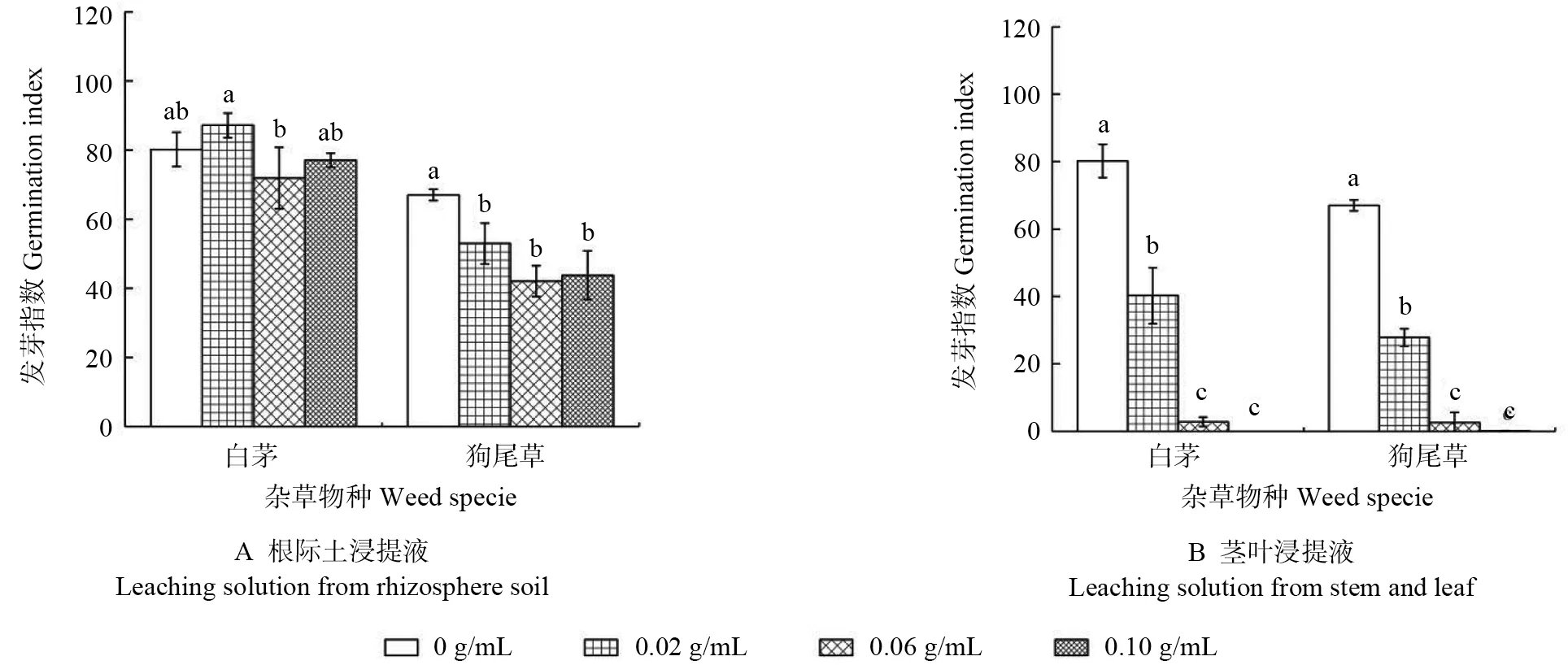
圖3 黃菊莖葉及其根際土浸提液對雜草種子發芽指數的影響Fig.3 Effect of leaching solutions from C.morifolium stem-leaf and its rhizosphere soil on germination index of weed seeds
2.2 黃菊莖葉及其根際土浸提液對雜草幼苗生長的影響
2.2.1 黃菊莖葉及其根際土浸提液對雜草苗高的影響
黃菊根際土浸提液對雜草苗高的影響如圖4A所示。由圖4A 可見,在根際土浸提液處理下,2種雜草苗高呈現出不同的化感效果。在0.02、0.06和0.10 g/mL 處理組,根際土浸提液質量濃度越高,對白茅苗高的促進效果越弱,白茅苗高分別比對照組高了13.88%、11.44%和5.25%,但與對照組差異均不顯著。0.02 和0.06 g/mL 處理組對狗尾草苗高表現出抑制效果,但與對照差異不顯著,分別低于對照4.31%和8.63%;在0.10 g/mL 處理組中,狗尾草苗高高于對照12.23%,并與0.06 g/mL處理組有顯著差異(P<0.05)。
黃菊莖葉浸提液對雜草苗高的影響如圖4B 所示。由圖4B 可見,各質量濃度莖葉浸提液對白茅苗高呈現“低促高抑”的現象,在0.02 g/mL 處理組白茅苗高顯著高于對照26.27%(P<0.05),在0.06 g/mL處理組其苗高顯著低于對照30.02%(P< 0.05),在0.10 g/mL 處理組其苗高完全被抑制。莖葉浸提液對狗尾草苗高表現為質量濃度越高抑制效果越強,在0.02、0.06 和0.10 g/mL 處理組中,其苗高分別低于對照組4.32%、9.71%和78.78%,且在0.10 g/mL 處理組中與對照差異顯著(P<0.05)。

圖4 黃菊莖葉及其根際土浸提液對雜草苗高的影響Fig.4 Effect of leaching solutions from C.morifolium stem-leaf and its rhizosphere soil on seedling height of weeds
2.2.2 黃菊莖葉及其根際土浸提液對雜草根長的影響
黃菊莖葉浸提液對雜草根長的影響如圖5B 所示。由圖5B 可見,莖葉浸提液對2 種雜草根長的影響均表現為質量濃度越高抑制效果越強。在 0.02 g/mL 處理組中,白茅根長低于對照6.12%,0.06 g/mL 處理組對其根長的抑制效果顯著,低于對照96.43%(P<0.05);在0.02、0.06 和0.10 g/mL 處理組中,狗尾草根長均存在顯著差異,分別比對照降低了46.70%、79.81%和99.06%(P<0.05)。
2.2.3 黃菊莖葉及其根際土浸提液對雜草鮮質量的影響
黃菊根際土浸提液對雜草鮮質量的影響如圖6A 所示。由圖6A 可見,隨質量濃度升高,根際土浸提液對白茅幼苗鮮質量的促進效果呈現出先升后降的趨勢,且各處理均與對照差異顯著,且在0.06 g/mL 處理組中白茅幼苗鮮質量達到最大。在0.02、0.06 和0.10 g/mL 處理組中,白茅幼苗鮮質量分別比對照高出45.43%、80.11%和57.62% (P<0.05)。狗尾草幼苗鮮質量在0.02 g/mL 處理組比對照組低了5.96%,在0.06 和0.10 g/mL 處理組分別高于對照3.58%和9.72%,但3 種處理與對照的差異均不顯著。
黃菊莖葉浸提液對雜草鮮質量的影響如圖6B所示。由圖6B 可見,隨質量濃度升高,莖葉浸提液對2 種雜草幼苗鮮質量的影響均呈現出“低促高抑”的現象。白茅幼苗鮮質量在0.02 g/mL處理組顯著高于對照78.23%(P<0.05),在 0.06 g/mL處理組顯著低于對照37.19%(P<0.05),在0.10 g/mL 處理組則完全被抑制。狗尾草幼苗鮮質量在0.02 g/mL 處理組高于對照22.29%,在0.06 和0.10 g/mL 處理組分別低于對照17.80%和89.45%,并且各處理間存在顯著差異(P<0.05)。
2.2.4 黃菊莖葉及其根際土浸提液對雜草干質量的影響
黃菊根際土浸提液對雜草干質量的影響如圖7A 所示。由圖7A 可見,隨質量濃度升高,根際土浸提液對2 種雜草干質量的影響均呈現出促進效果增強的現象。在0.06、0.10 g/mL 處理組中,白茅干質量比對照顯著增加,分別增加了21.02%和29.94%(P<0.05);在0.02、0.06 和0.10 g/mL 處理組中,狗尾草干質量分別增加了6.98%、37.21%和47.67%,在0.10 g/mL 處理組中其干質量最大且與對照顯著差異(P<0.05)。
黃菊莖葉浸提液對雜草干質量的影響如圖7B所示。由圖7B 可見,隨質量濃度升高,莖葉浸提液對2 種雜草干質量的影響均表現為“低促高抑”。白茅干質量在0.02 g/mL 處理組高出對照9.55%,在0.06 g/mL 處理組低于對照52.87%,且與對照顯著差異(P<0.05);狗尾草干質量在0.02、0.06 g/mL 處理組分別高于對照23.26%和36.05%,在0.10 g/mL 處理組顯著低于對照75.57%(P<0.05)。

圖6 黃菊莖葉及其根際土浸提液對雜草鮮質量的影響Fig.6 Effect of leaching solutions from C.morifolium stem-leaf and its rhizosphere soil on fresh mass of weeds
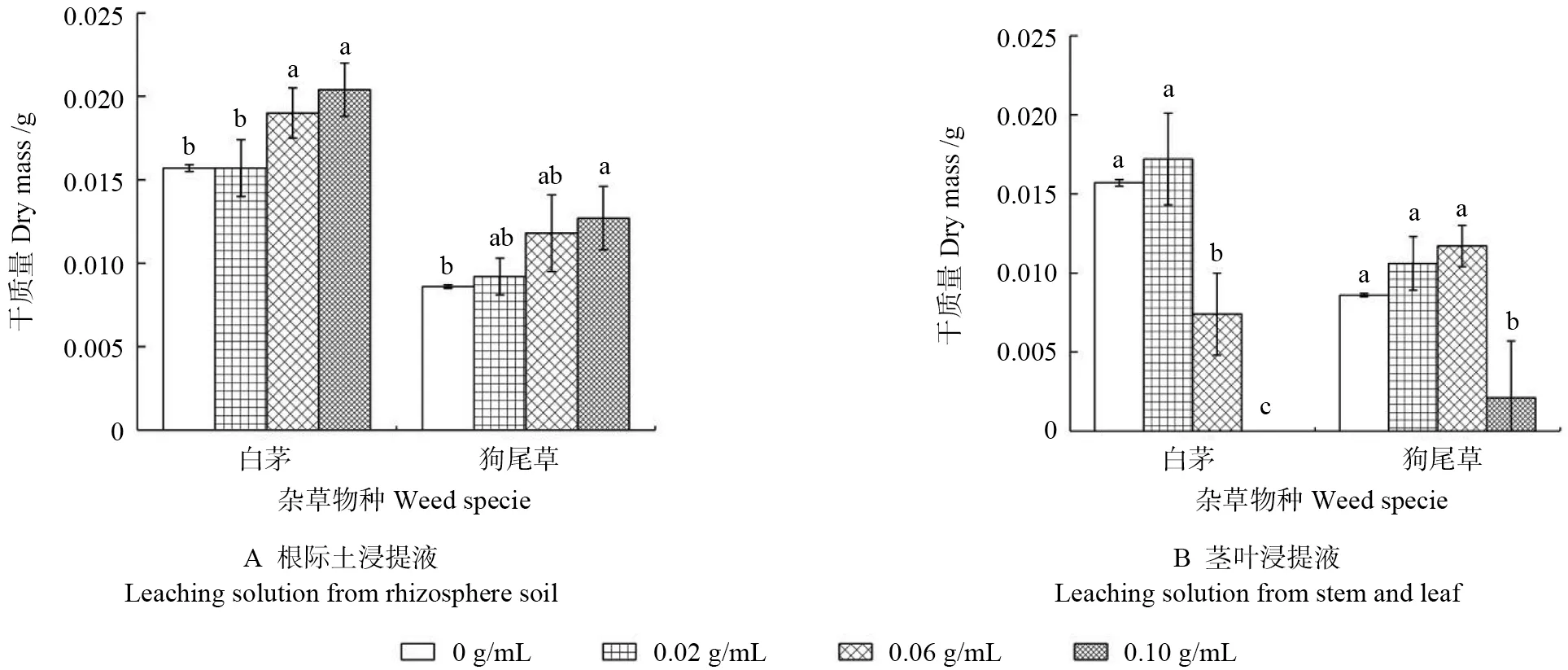
圖7 黃菊莖葉及其根際土浸提液對雜草干質量的影響Fig.7 Effect of leaching solutions from C.morifolium stem-leaf and its rhizosphere soil on dry mass of weeds
2.2.5 黃菊莖葉及其根際土浸提液對雜草活力指數的影響
活力指數較發芽率能夠更確切地反映種子在當前處理下的萌發整齊度和速度以及幼苗生長的健壯潛勢[17]。黃菊根際土浸提液對雜草活力指數的影響如圖8A 所示。由圖8A 可見,根際土浸提液對白茅活力指數表現為促進作用,在0.10 g/mL處理組中活力指數最大;對狗尾草活力指數表現為抑制作用,在0.06 g/mL 處理組中活力指數下降到最低,并與對照組差異顯著。黃菊莖葉浸提液對雜草活力指數的影響如圖8B所示。由圖8B可見,莖葉浸提液對2 種雜草均表現出強烈的抑制效果,隨著莖葉浸提液質量濃度升高到0.10 g/mL,白茅和狗尾草已無法萌發生長。

圖8 黃菊莖葉及其根際土浸提液對雜草活力指數的影響Fig.8 Effect of leaching solutions from C.morifolium stem-leaf and its rhizosphere soil on vigor index of weeds
2.3 黃菊莖葉及其根際土浸提液對雜草的化感效應評價
2.3.1 黃菊莖葉及其根際土浸提液對雜草化感效應指數的影響
化感效應指數(Ir)可以用來衡量化感作用強度,正值為促進作用,負值為抑制作用[16]。黃菊莖葉及其根際土浸提液對雜草的化感效應指數見表1。由表1 可知,根際土浸提液處理下,在 0.02 g/mL 處理組中白茅發芽率、發芽勢和發芽指數的Ir值大于或等于0,而在0.06、0.10 g/mL 處理組中3 個種子發芽指標的Ir值均小于0,表現出抑制作用。根際土浸提液處理下,在各質量濃度處理組中,狗尾草3 個種子發芽指標Ir值均小于0,均表現為抑制作用。根據各處理組中各發芽指標的Ir值可知,在種子萌發上,狗尾草受到的抑制作用比白茅強。在幼苗生長指標上,各質量濃度根際土浸提液對白茅均表現為促進效果。白茅鮮質量的Ir值隨根際土浸提液質量濃度上升先升后降;根長和干質量的Ir值隨根際土浸提液質量濃度上升呈升高趨勢,并在0.10 g/mL 處理組達到最大,分別為0.54、0.30;苗高的Ir值隨根際土浸提液質量濃度上升逐漸降低。在根際土浸提液處理下,隨根際土浸提液質量濃度上升,狗尾草根長和干質量的Ir值變化趨勢與白茅相同,在0.10 g/mL 處理組達到最大,分別為0.07 和0.49。可以看出,根際土浸提液對狗尾草干質量促進效果更強,對白茅的根長促進效果更強。各質量濃度根際土浸提液對2 種雜草活力指數的Ir值的影響不同,對白茅表現為促進作用,并且活力指數的Ir值在 0.10 g/mL 處理組達到最大(0.28),對狗尾草表現為抑制作用。
黃菊莖葉浸提液對2 種雜草種子的發芽指標均表現出隨其質量濃度升高抑制效果越強的現象,并在0.10 g/mL 處理組中完全抑制了白茅和狗尾草種子的萌發,發芽率的Ir值分別為-1.00、-0.97。各質量濃度黃菊莖葉浸提液對2 種雜草幼苗的鮮質量和干質量均表現出“低促高抑”的現象。在 0.02 g/mL 處理組中,白茅鮮質量和干質量的Ir值分別為0.78、0.10,狗尾草鮮質量和干質量的Ir值分別為0.22、0.24,可以看出低質量濃度的黃菊莖葉浸提液對白茅鮮質量的促進作用更強,對狗尾草干質量的促進作用更強。各質量濃度黃菊莖葉浸提液對白茅苗高表現為“低促高抑”,對狗尾草苗高全部表現為抑制作用。在0.06 g/mL 處理組中,白茅和狗尾草苗高的|Ir|分別為0.30、0.10,說明對白茅苗高的抑制效果更強。在0.02 g/mL 處理組中,白茅和狗尾草活力指數的Ir值分別為-0.06、-0.47,說明低質量濃度的黃菊莖葉浸提液對狗尾草幼苗活力指數的影響更大。但在 0.06 g/mL 處理組中,白茅和狗尾草活力指數的Ir值分別為-0.96、-0.80,說明隨著黃菊莖葉浸提液質量濃度升高,白茅幼苗更加敏感。

表1 黃菊莖葉及其根際土浸提液對雜草的化感效應指數Table 1 Allelopathic effect indexes of leaching solutions from C.morifolium stem-leaf and its rhizosphere soil on weeds
2.3.2 黃菊莖葉及其根際土浸提液對雜草化感綜合效應
為了綜合分析黃菊莖葉及其根際土浸提液對2 種雜草種子萌發和幼苗生長的化感效應,根據發芽率、發芽勢、發芽指數、活力指數、鮮質量、干質量、根長和苗高8 個指標的化感效應指數,得出化感綜合效應指數(表2)。隨著質量濃度升高,根際土浸提液對白茅的促進作用增強,在0.10 g/mL 處理組中達到最大值。而狗尾草在0.02 和0.06 g/mL 處理組中的化感綜合效應指數相等,均表現為抑制。黃菊莖葉浸提液對白茅和狗尾草的化感綜合效應均表現為隨其質量濃度增加抑制增強。比較各質量濃度處理中化感綜合效應指數平均值的絕對值,可以看出莖葉浸提液對2 種雜草的化感強度均大于根際土浸提液,且整體表現為抑制作用。在各質量濃度范圍內,2 種浸提液對白茅的影響強度均大于對狗尾草的影響強度。

表2 黃菊莖葉及其根際土浸提液對雜草的化感綜合效應指數Table 2 Comprehensive allelopathic effect indexes of leaching solutions from C.morifolium stem-leaf and its rhizosphere soil on weeds
3 結論與討論
黃菊根際土和莖葉浸提液對白茅及狗尾草種子萌發均存在化感作用。低質量濃度(≤ 0.02 g/mL)根際土浸提液對白茅種子的發芽勢和發芽指數表現為促進作用,高質量濃度(≥ 0.06 g/mL)根際土浸提液對其發芽率、發芽勢和發芽指數表現為抑制作用;各質量濃度根際土浸提液(≥0.02 g/mL)處理對狗尾草種子的發芽率、發芽勢和發芽指數均表現為抑制作用。黃菊莖葉浸提液對2 種雜草種子的萌發均表現為質量濃度越高抑制作用越強,在0.10 g/mL 處理對白茅種子萌發的抑制率達到100%,狗尾草種子的萌發率較對照組顯著降低了78.33 百分點(P<0.05)。
黃菊根際土和莖葉浸提液對白茅及狗尾草幼苗生長均存在化感作用。各質量濃度(0.02、0.06、0.10 g/mL)根際土浸提液對白茅幼苗的鮮質量、干質量、株高和根長均表現出促進作用。但白茅幼苗的鮮質量隨根際土浸提液質量濃度升高表現為先升后降的趨勢,并在0.06 g/mL 處理組中達到最大值,顯著高出對照80.11%(P<0.05)。隨根際土浸提液質量濃度增加,其對白茅幼苗的干質量和根長的促進效果越強,在0.10 g/mL 處理組中干質量和根長達到最大值,分別顯著高出對照29.94%和53.74%(P<0.05)。根際土浸提液對白茅苗高的影響表現為隨其質量濃度增加促進作用減弱,在0.02 g/mL 處理組中達到最大,高出對照13.88%。各質量濃度(0.02、0.06、0.10 g/mL) 根際土浸提液對狗尾草的干質量和根長的作用表現為隨其質量濃度增大促進作用越強,在0.10 g/mL 處理組達到最大,狗尾草的干質量和根長分別高出對照47.67%(P<0.05)和6.59%,而其對狗尾草的鮮質量和苗高的作用表現為低質量濃度抑制、高質量濃度促進。黃菊莖葉浸提液對白茅幼苗的鮮質量、干質量和苗高均表現為低質量濃度(≤ 0.02 g/mL)促進、高質量濃度(≥0.06 g/mL)抑制,白茅幼苗的鮮質量、干質量和苗高在0.02 g/mL 處理組分別高出對照78.23%(P<0.05)、9.55%和26.27%(P<0.05),但其對白茅根長的影響表現為質量濃度越高抑制作用越強,并在0.10 g/mL 處理組中完全抑制其生長。黃菊浸提液對狗尾草幼苗鮮質量的影響表現為低質量濃度(≤ 0.02 g/mL)促進、高質量濃度(≥0.06 g/mL)抑制,并在0.02 g/mL 處理組高出對照22.29%,其對狗尾草幼苗的干質量的影響表現為低質量濃度(≤ 0.06 g/mL)促進、高質量濃度(≥0.10 g/mL) 抑制,并在0.06 g/mL 處理組中高出對照36.05%,其對狗尾草苗高和根長的影響均表現為質量濃度越高抑制作用越強,分別較對照顯著降低了78.78%和99.06%(P<0.05)。黃菊莖葉浸提液的化感強度大于根際土浸提液,二者的化感綜合效應均表現為抑制效果。
近年來,隨著人們生態文明意識的提高,更加注重農林業的生態經營理念。油茶為我國特有的木本油料生態經濟樹種,其產業被賦予了新的活力。但由于種植環境的影響,油茶林經營管理中耗費的經濟、人力成本高,附加產值低,普遍存在粗放式管理。為解決此類問題,目前有較多有關油茶林下間作的研究報道,如間作花生、大豆、馬鈴薯、金銀花、迷迭香等[18-19],以及有關油茶林生草栽培的研究報道,如百喜草、黑麥草、鼠茅草等[20-21]。間作黃菊有以下優點:一是具有經濟價值和藥用價值;二是控制雜草密度,降低與栽培樹種的競爭強度;三是花期與油茶相近,吸引昆蟲,存在提高授粉率的可能。在油茶幼林林下間作黃菊不僅可以降低雜草密度,提高土地資源利用率,節省人工管理,減少化學藥劑的使用,還能提高經濟效益產出。
本試驗中,黃菊莖葉浸提液(0.02、0.06、 0.10 g/mL)對白茅和狗尾草的種子萌發及根長呈現出其質量濃度越高抑制效果越強的趨勢,與代磊等[22]研究黃頂菊浸提液(0.02 ~0.08 g/mL) 對生菜、春菜和芥蘭種子萌發和幼苗生長的影響得出的結論一致,0.08 g/mL 黃頂菊浸提液對3 種植物根長的抑制率達到95%以上。本試驗結果表明,2 種雜草的種子活力指數隨黃菊莖葉浸提液質量濃度升高而不斷降低,與田學軍等[23]研究腫柄菊對三葉鬼針草的化感作用的所得結論一致。本試驗中,0.1 ~0.2 g/mL 黃菊莖葉浸提液完全抑制雜草根系的生長,與陳業兵[13]用銀膠菊葉浸提液處理馬唐和稗草所得結論一致,同時黃菊莖葉浸提液對狗尾草苗高的影響也與銀膠菊葉浸提液對苗高的影響一致。各質量濃度黃菊莖葉浸提液對白茅苗高的影響表現為“低促高抑”,與陳瑞等[24]用菊芋浸提液處理稗草得到的結果一致,胡凱茜等[25]經研究發現一定濃度的菊科紫莖澤蘭浸提液可以對一些植物的生長表現出促進作用。浸提液對根和芽表現出不同的影響,可能是因為根系直接接觸浸提液,所以表現更加敏感,隨著浸提液濃度增加,根系受到強烈抑制,無法供給芽苗充分的營養[26]。幼苗的成活及生長發育與種群的生存及空間分布密切相關[27]。從黃菊莖葉對雜草的化感效應強度可以看出,黃菊可以對雜草群落產生影響。根際土本身包含著復雜的成分,可能包含腐解的細根、根系分泌物、莖葉淋溶物質、微生物分泌物等。根際土浸提液對2 種雜草幼苗及根系生長均表現出促進作用,與黃翔杰等[28]得出的低濃度 0.05 mmol/L 野菊根系分泌物對油菜鮮質量、根長和苗高均有極顯著促進作用的結果一致,但該濃度下其對生菜、萵苣表現出抑制效果,說明化感是一個復雜的過程,與化感部位、濃度和受體均有較大關系。本試驗結果表明,0.06 g/mL 根際土浸提液對狗尾草和白茅萌發的抑制作用達到最大。
在自然條件下,有些化感物質可以直接對受體產生影響,而有些化感成分須積累才能逐漸起到效果。所以,在無參考指標的情況下直接進行大田試驗,對間作密度及與樹體的距離難以把控,無法起到抑制雜草、促進樹體的雙重效果。當然,大田試驗結果與理論還存在較多不同,例如在少雨干燥的地方,需雨水淋溶的化感物質進入自然界的量就會減少。因此,應當繼續探究黃菊在油茶林下間作的最適密度。另外,由于黃菊和油茶處于不同生態位,其揮發性化感作用也有待研究。

