草魚呼腸孤病毒GCRV 096 VP7蛋白的表達及免疫原性
楊 碩,陳靜妮,胡海浩,王 雅,閆秀英,簡紀常
草魚呼腸孤病毒GCRV 096 VP7蛋白的表達及免疫原性
楊 碩,陳靜妮,胡海浩,王 雅,閆秀英,簡紀常
(廣東海洋大學水產學院 // 廣東省水產經濟動物病原生物學及流行病學重點實驗室 // 水產經濟動物病害防控廣東普通高校重點實驗室,廣東 湛江 524088)
【目的】研究草魚呼腸孤病毒(grass carp reovirus, GCRV)096基因的原核和真核表達及其編碼蛋白的免疫原性。【方法】應用RT-PCR技術獲得GCRV 096基因,構建GCRV 096基因原核表達載體pET-VP7,用原核表達的GCRV 096 VP7蛋白免疫草魚()15 d后,用GCRV 096和GCRV GD108分離株對其攻毒,檢測GCRV 096 VP7的免疫原性。構建GCRV 096基因真核表達載體pEGFP-N3-VP7,分析其在草魚CIK細胞中的表達。【結果與結論】GCRV 096基因的開放閱讀框ORF (GenBank登錄號為JN206665)為831 bp,編碼276個氨基酸。成功構建GCRV 096基因原核表達載體pET-VP7,并在大腸桿菌BL21中誘導表達成功;最優表達條件是0.2 mm/L IPTG、28 ℃下表達5 h,通過HisTrap HP柱純化融合蛋白,Western blot分析結果表明,所表達的蛋白為目的蛋白。經免疫及GCRV攻毒后,GCRV 096(Ⅰ型)免疫組基因的表達水平降低(< 0.05),而GCRV GD108(Ⅱ型)免疫組基因的表達無顯著差異,表明GCRV 096 VP7蛋白對GCRV 096具有良好的免疫效果,但對GCRV GD108無明顯的免疫效果。成功構建GCRV 096基因真核表達載體pEGFP-N3-VP7,Western blot分析結果表明,GCRV 096 VP7蛋白在草魚腎(CIK)細胞中成功表達。
草魚呼腸孤病毒;基因;表達;免疫原性
草魚呼腸孤病毒(grass carp reovirus, GCRV)引起的草魚出血病給我國草魚()養殖業造成了嚴重損失。目前,草魚出血病及GCRV研究已取得較大進展。已發現GCRV 4個基因型中的多株GCRV分離株[1-2],且不斷有新分離株的報道。在我國分布的GCRV可分為基因型Ⅰ型、Ⅱ型和Ⅲ型。研究表明,不同GCRV基因型分離株間差異較大[3, 4-6],不同基因型與草魚出血病不同癥狀間是否存在一定關系有待進一步研究。因此,GCRV的多樣性增加了草魚出血病的防治難度,給草魚出血病的防治帶來新的問題[3,7],GCRV多樣性及草魚出血病防治均有待深入研究。
預防草魚出血病的最有效途徑是疫苗接種,目前對草魚出血病疫苗的研制和應用已取得一定進展,一定程度上降低了草魚出血病的發生率和草魚死亡率。對草魚出血病疫苗來說,影響疫苗免疫效果的主要因素是疫苗靶位的選擇[8-9]。
VP7蛋白是GCRV的結構蛋白,由S10片段編碼,在GCRV感染及致病過程中可能起重要作用[10-11]。VP7蛋白的多克隆抗體具有中和活性,可能是GCRV主要的保護性抗原[12]。研究表明,GCRV VP7蛋白具有良好的免疫原性[13-14],人工合成的GCRV基因的表達產物與鼠抗GCRV血清有良好的反應原性[15]。基于大腸桿菌()表面展示表達GCRV 873 VP7蛋白的疫苗具有良好的免疫效果[16]。GCRV VP7蛋白和基因是良好的候選疫苗靶位,這在基于GCRV 873的相關研究中得以證明。GCRV 873 VP7蛋白特性分析、GCRV VP7蛋白基因人工合成等研究[11,15,17]以及基于GCRV 873基因構建的核酸疫苗載體均表明GCRV 873 VP7蛋白有較好的免疫保護效果[11,17]。
VP7蛋白的免疫原性在不同GCRV基因型間是否存在差異有待研究。對GCRV不同基因型分離株間的差異進行研究和解析,可為草魚出血病疫苗的研制提供重要理論依據。本課題組亦對GCRV 096進行了相關研究[18-20],發現GCRV 096 VP7蛋白含有信號肽和潛在的抗原表位[21]。GCRV 096與GCRV 873屬于我國GCRV基因型Ⅰ型,GCRV GD108屬于Ⅱ型,筆者研究GCRV 096 VP7蛋白的原核表達,并分析其在不同GCRV基因型間的免疫效果差異,同時在草魚腎臟(CIK)細胞系中實現GCRV 096 VP7蛋白的真核表達,為GCRV疫苗研發和草魚出血病的防治研究奠定基礎。
1 材料和方法
1.1 材料
pMD18-T載體、pET-28a原核表達載體、真核表達載體pEGFP-N3、大腸桿菌DH5α和BL21 (DE3) 均購自TaKaRa公司,CIK細胞購自深圳檢驗檢疫局。
1.2 GCRV 096和GCRV GD108的分離和純化
取患出血病草魚腎臟,粉碎,均漿,以250、500、1 000、3 000、6 000梯度離心,每個梯度離心2 min,最后取上清液至另一離心管,以35 000離心2.5 h,沉淀用pH 7.4的磷酸鹽緩沖液(PBS)溶解,分裝,于?80 ℃下保存備用。GCRV 096和GCRV GD108分別屬于分布于我國的GCRV基因型Ⅰ型和Ⅱ型[20]。
1.3 GCRVs RNA的提取和反轉錄
應用TaKaRa公司的MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0試劑盒,按照說明書進行GCRVs基因組總RNA提取。用EasyScript First-Strand cDNA Synthesis SuperMix試劑盒反轉錄合成cDNA。
1.4 原核重組融合蛋白GCRV 096 VP7的表達與純化
根據本課題組前期已獲得的GCRV 096基因序列(GenBank登錄號JN206665)[21],設計用于擴增基因開放閱讀框(ORF)含酶切位點的引物是-ORF-F (5′-CTAATGCCACTTCA CATGATTCC-3′,下劃線為酶切位點I )和-ORF-R (5′-CCGTTAATCGGATGGC TCCAC-3′, 下劃線為酶切位點I )。
PCR擴增體系25 μL,含cDNA模板2 μL、引物(10 μmol/L) 各1 μL、dNTPs (2.5 mmol/L) 各2 μL、10×ExTaq Buffer 2.5 μL、ExTaq (1 U/μL) 0.25 μL、ddH2O 16.25 μL。PCR擴增條件:95 ℃ 5 min;95 ℃ 1 min、61 ℃ 1 min、72 ℃ 2 min,30個循環;于72 ℃下延伸10 min,4 ℃條件下保存。
將GCRV 096基因ORF正確插入pET-28a(+),用菌落PCR擴增、雙酶切(I和I)和測序確定正確構建原核表達質粒pET-VP7。
將重組表達質粒pET-VP7轉入大腸桿菌BL21,挑取生長良好的單一菌落接種到含Kan (50 μg/mL)的LB液體培養基中,以37 ℃、200 r/min條件振蕩培養12 h,按體積比1∶100的比例接種到新配制的含Kan (50 μg/mL) 的液體培養基中,于37 ℃下培養至OD600 nm達0.4 ~ 0.6,加異丙基-β--硫代半乳糖苷(IPTG)至終濃度為1 mmol/L,于37 ℃下繼續振蕩培養4 h,以10 000 r/min離心2 min,收集菌體,以聚丙烯酰胺凝膠電泳(SDS-PAGE)檢測蛋白表達情況。進一步優化重組融合蛋白GCRV 096 VP7的表達條件。
將含有重組質粒的BL21菌接種于200 mL含有卡那霉素的LB液體培養基中,經優化的誘導條件誘導后,離心,收集菌體并進行裂解。經過多重離心、懸浮沉淀,表達的重組蛋白用8 mol/L尿素于4 ℃條件下完全溶解。將獲得的重組蛋白用HisTrap HP柱按常規方法進行純化,分別用50、70、90、110、150、200、250、300 mmol/L咪唑洗脫緩沖液進行洗脫,逐步收集重組表達的融合蛋白,進行SDS-PAGE電泳,并按常規方法進行蛋白轉膜,用含50 g/L脫脂牛奶和質量分數0.1%吐溫的PBS在室溫下阻斷1 h,用抗-His鼠抗(1∶1 000,Invitrogen)4 ℃下孵育16 h,再用辣根過氧化物酶標記的羊抗鼠抗體(1∶3 000,Takara)孵育2 h,最后曝光顯影。
1.5 GCRV 096 VP7蛋白免疫原性分析
對草魚(約30 g)腹腔注射0.1 g/L純化蛋白與PBS、弗氏完全佐劑制備的免疫制劑200 μL,對照組注射200 μL PBS與弗氏完全佐劑 (pH = 7.4),每組草魚6尾,免疫15 d后,注射100 μL GCRV 096或GCRV GD108 (約2 130 μg/mL,以GCRV 096在CIK細胞的滴度為對照,依定量PCR結果和GCRV基因組質量估算而得) 進行攻毒,于攻毒后的12、24、48、72、96 h剖取實驗組草魚腎臟,每組各取樣時間點的草魚腎臟分別混合成定量PCR樣品,定量分析草魚腎臟中GCRV 096基因的表達量。定量PCR用內參基因為和,引物為βF (5′-GTGAATCGGATACTCTCG G-3′ )、βR (5′ -GCA GACATAACGCAAGGCA-3′)、GF (5′-GGCTGTGCT GTCCCTGTA-3′)和GR(5′-GGGCATAACCCTCGT AGAT-3′ )。基因定量PCR的引物為096F (5′-GGCAGCGAGTCAGCACCTTGTC-3′)、096R (5′-CTACCGCTTGCGTCCGAAATCAC-3′)、108F (5′-TTCGCTTCGGCTATAACAT-3′)和108R(5′-ACAGACAGGCTCTTCCAA-3′)。定量PCR體系(25 μL):水9.5 μL,每條引物0.5 μL (10 pmol/L),SYBR?Premix ExTM12.5 μL,cDNA 2 μL。反應條件:95 °C下預變性3 min;95 °C 10 s、55 °C 30 s,40個循環。定量PCR重復3次。
1.6 統計分析
所得定量PCR數據采用2-??Ct法處理[22],進行配對t檢驗,應用SPSS15.0統計軟件對所得數據進行統計學處理,顯著性水平= 0.05。
1.7 GCRV 096 VP7真核表達載體的構建及其在CIK細胞中的表達
將GCRV 096基因的ORF正確插入至真核表達載體pEGFP-N3,進行菌落PCR擴增、雙酶切(I和I)和測序,以正確構建真核表達質粒pEGFP-N3-VP7。
將CIK細胞傳代至6孔細胞培養板,待細胞覆蓋率約85%時,取4 μL無內毒素質粒DNA和10 μL脂質體(Lipofectamin 2000)置于不同離心管,分別用無血清、無抗生素的M199培養基稀釋至總體積為250 μL,室溫靜置5 min,輕輕混合兩種液體,室溫下靜置20 min,兩者最終混合體積為500 μL。
混合液靜置期間,清除培養板孔中的培養基,用1 mL無血清、無抗生素的M199培養基洗滌細胞3次,清除洗滌液。加入質粒和Lipofectamin 2000的混合液,輕搖,使混合液與細胞充分接觸。于25 ℃的恒溫培養箱中培養6 h,吸去混合液,改換含體積分數10%胎牛血清的M199培養基培養。轉染24 h后用熒光顯微鏡觀察細胞內的熒光分布情況。
轉染24 h后,分別將對照正常、已轉染pEGFP-N3和已轉染pEGFP-N3-VP7的CIK細胞培養皿置于冰上,分別用冰預冷的PBS漂洗兩次,加入150 μL細胞裂解液,刮取細胞移入1.5 mL EP管中,以3 000 r/min離心5 min,收集上清,進行SDS-PAGE電泳,并按常規方法進行蛋白轉膜,用含50 g/L脫脂牛奶和質量分數0.1%吐溫的PBS在室溫下阻斷1 h,在4 ℃下用鼠抗GFP抗體(1∶1 000,Invitrogen)孵育16 h,再用辣根過氧化物酶標記的羊抗鼠抗體(1∶3 000,Takara)孵育2 h,最后曝光顯影。
2 結果與分析
2.1 GCRV 096與GCRV GD108 vp7基因同源性分析及GCRV 096 VP7重組蛋白的原核表達
GCRV 096開放閱讀框(ORF) 為831 bp,編碼276個氨基酸,預測分子質量約為29.85 ku;而GCRV GD108基因編碼356個氨基酸,二者基因間相似率為21%,二者VP7蛋白間相似率為12%。
經菌落PCR、雙酶切及測序驗證,pET-VP7質粒構建成功。將原核重組質粒pET-VP7轉化至大腸桿菌BL21 (DE3) 感受態細胞,其最優的表達條件是以28 ℃、0.2 mmol/L IPTG誘導5 h,誘導表達的蛋白以包涵體形式存在(圖1)。Western blot分析表明,純化后蛋白是融合表達的GCRV 096 VP7蛋白(圖2)。
2.2 GCRV 096 VP7蛋白的免疫原性分析
腹腔注射原核表達重組蛋白15 d后,腹腔注射GCRV 096或GCRV GD108進行感染。感染72 h時,GCRV 096免疫組比對照組中基因的表達水平低,96 h時組間差異顯著(< 0.05),可見,相對于對照組,免疫組中GCRV 096的病毒復制量減少,復制速度減慢,GCRV 096 VP7蛋白表現出良好的免疫原性;而GCRV GD108免疫組和對照組中基因的表達水平無顯著差異(> 0.05),GCRV 096 VP7蛋白可能對GCRV GD108無免疫保護作用(圖3)。
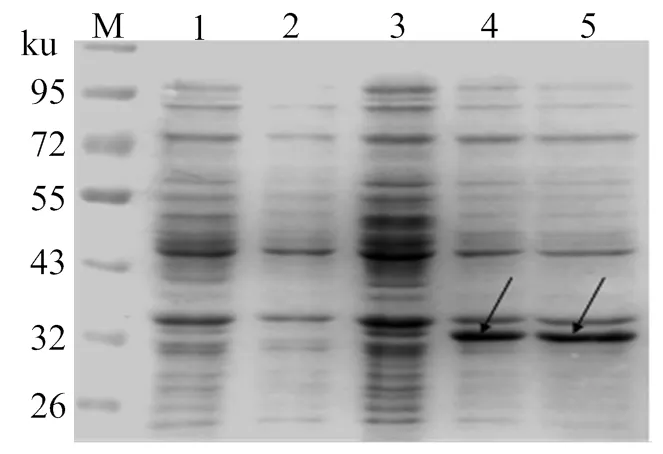
M,蛋白質分子質量標準;1,未誘導pET28a;2,誘導pET28a;3,未誘導pET-VP7;4-5,誘導pET-VP7

M,蛋白質分子質量標準;1-8,50、70、90、110、150、200、250和300 mmol/L 咪唑洗脫純化后的融合表達VP7蛋白的western blot
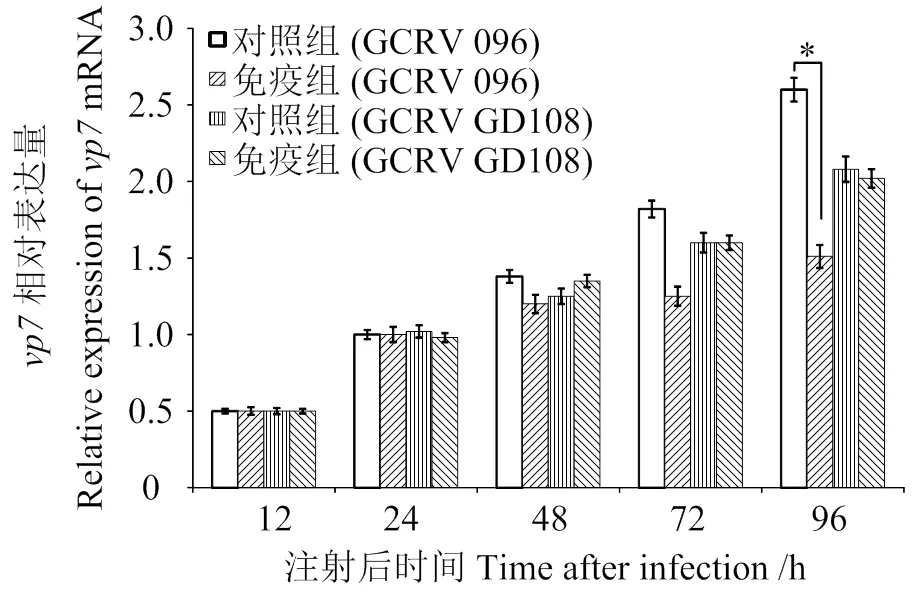
*表示差異有統計學意義(P < 0.05)
2.3 GCRV 096 VP7蛋白在CIK細胞中的表達
經菌落PCR (圖4A )、酶切鑒定(圖4B) 及測序驗證,重組質粒pEGFP-VP7構建成功。pEGFP-N3和pEGFP-VP7質粒轉染CIK細胞后24 h,僅轉染脂質體的CIK細胞無熒光(圖5A),轉染空載體pEGFP-N3 (圖5B) 和轉染pEGFP-VP7質粒的CIK細胞中有綠色熒光(圖5C)。在轉染pEGFP-VP7質粒的CIK細胞裂解液中,呈現有特異性蛋白條帶,而僅轉染脂質體和空載體pEGFP-N3的CIK細胞裂解液中無相應的蛋白條帶(圖6),說明GFP融合重組蛋白VP7在真核CIK細胞中得以表達。
M1,DL2000 DNA分子標準; 1-4,pEGFP-VP7陽性克隆子;M2,1 kb DNA 分子標準;5,pEGFP-VP7雙酶切產物
M1, DL-2000 DNA maker; 1-4, Positive clones of pEGFP-VP7; M2: 1 kb DNA marker; 5, double enzymatic digestion product of pEGFP-VP7 plasmid
圖4 重組質粒pEGFP-VP7菌落PCR及雙酶切
Fig. 4 Identification of the recombinant plasmid pEGFP-VP7 by colony PCR and double enzymatic digestion
A,正常的CIK細胞(40×);B,pEGFP-N3轉染CIK細胞(40×);C,pEGFP-VP7轉染CIK細胞(40×)
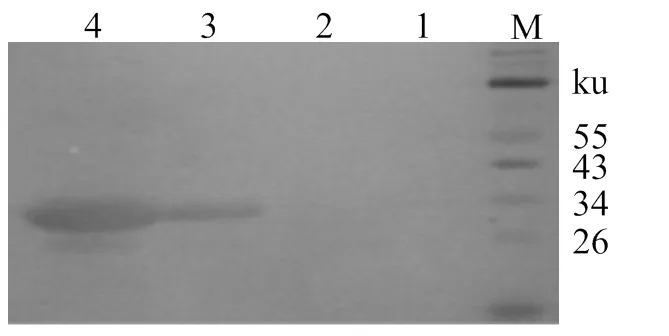
M,蛋白質分子質量標準;1,僅轉染脂質體CIK細胞裂解液;2,轉染pEGFP-N3 CIK細胞裂解液;3-4,轉染pEGFP-VP7 CIK細胞裂解液
3 討論
研究表明,不同基因型分離株間在基因序列、基因組電泳帶型、致細胞病變效應和疾病發展等方面存在差異,不同基因型分離株間不產生交叉保護作用[5-6,20,23-24]。對多樣性GCRV而言,研究免疫原性強的蛋白和多肽等對聯合免疫疫苗的研制至關重要[25]。VP7蛋白可引起草魚產生明顯的免疫反應,對草魚出血病疫苗來說VP7蛋白有良好的免疫原性[26]。基因I型GCRV VP7蛋白合成肽抗體可特異性識別基因I型GCRV,而不識別其他基因型毒株[27]。本研究中,GCRV 096和GCRV GD108的VP7蛋白之間的相似率極低。用Ⅰ型基因型GCRV 096的VP7蛋白免疫草魚后,對GCRV 096有明顯的免疫作用,但對Ⅱ型基因型GCRV GD108無明顯影響。說明VP7蛋白有良好的免疫原性,其在GCRV不同基因型間可能不發生交叉保護作用。通過比較GCRV不同基因型各分離株免疫原性的差異,找出不同分離株抗原蛋白或基因之間的差異,可為下一步亞單位疫苗和基因工程疫苗的研制提供依據,從而制備出對所有GCRV基因型分離株免疫效果良好的疫苗[25]。目前對于不同基因型GCRV疫苗交叉保護的報道極少,對草魚出血病疫苗來說,確定GCRV不同基因型間是否發生交叉免疫極為重要,但有待進一步研究。已有研究應用多重shRNA表達系統產生抵抗GCRV不同基因型的交叉抗病毒制劑[28]。草魚出血病的有效防控必須考慮GCRV的多樣性,對草魚出血病來說聯合疫苗可能是最優選擇之一。
綜上,本研究純化了原核表達的GCRV 096 VP7蛋白,研究其免疫原性,并通過不同GCRV基因型免疫效果比較,發現可能在GCRV I、II型間不存在交叉保護。此外,在CIK細胞中成功表達了GCRV 096 VP7蛋白,實現了GCRV 096 VP7蛋白在真核細胞中的表達,表明Lipofectamin 2000脂質體可將重組質粒成功轉入目的細胞,實現目的蛋白在宿主細胞中的表達,為進一步動物實驗及草魚出血病DNA疫苗的研發奠定基礎。
[1] YE X, TIAN Y Y, DENG G C, et al.Complete genomic sequence of a reovirus isolated from grass carp in China[J]. Virus Research, 2012,163(1): 275-283.
[2] YAN X Y, WANG Y, XIONG L F, et al. Phylogenetic analysis of newly isolated grass carp reovirus[J]. SpringerPlus, 2014, 3(4): 190-199.
[3] WANG Q, ZENG W W, LIU C, et al. Complete genome sequence of a reovirus isolated from grass carp, indicating different genotypes of GCRV in China[J]. Journal of Virology, 2012, 86(22): 12466.
[4] 黃毅昌, 雷燕, 楊玉滔, 等. 草魚出血病分子流行病學及GCRV多樣性研究[J].安徽農業科學, 2016, 44(11): 120-125.
[5] TANG Y F, ZENG W W, WANG Y Y, et al. Comparison of the blood parameters and histopathology between grass carp infected with a virulent and avirulent isolates of genotype II grass carp reovirus[J]. Microb Pathog, 2020. doi:10.1016/j.micpath.2019.103859.
[6] FAN Y D, RAO S J, ZENG L B, et al. Identification and genomic characterization of a novel fish reovirus, Hubei grass carp disease reovirus, isolated in 2009 in China [J]. Journal of General Virology, 2013, 94(Pt 10): 2266-2277.
[7] 李永剛, 曾偉偉, 王慶, 等. 草魚呼腸孤病毒分子生物學研究進展[J]. 動物醫學進展, 2013, 3(4): 97-103.
[8] 張盛權. 注射草魚出血病疫苗免疫效果的觀察報告[J]. 中國水產, 2006(7): 85-86.
[9] JIANG Y L. Hemorrhagic disease of grass carp: Status of outbreaks, diagnosis, surveillance, and research[J]. The Israeli Journal of Aquaculture-Bamidgeh, 2009, 61(3): 188-192.
[10] FANG Q, SENG E K, DING Q Q, et al. Characterization of infectious particles of grass carp reovirus by treatment with proteases[J]. Arch Virology, 2008, 153(2): 675-682.
[11] 徐詩英, 劉林, 李婧慧, 等. 草魚呼腸孤病毒基因核酸疫苗的構建及免疫效果[J]. 水產學報, 2011, 35(11): 1694-1700.
[12] HE Y, YANG Q, XU H X, et al. Prokaryotic expression and purification of grass carp reovirus capsid protein VP7 and its vaccine potential[J]. African Journal of Microbiology Research, 2011, 5(13): 1643-1648.
[13] LUO S X, YAN L M, ZHANG X H, et al. Yeast surface display of capsid protein VP7 of grass carp reovirus: Fundamental investigation for the development of vaccine against hemorrhagic disease[J]. J Microbiol Biotechnol, 2015, 25(12): 2135-2145.
[14] ZHU B, LIU G L, GONG Y X, et al. Protective immunity of grass carp immunized with DNA vaccine encoding thegene of grass carp reovirus using carbon nanotubes as a carrier molecule[J]. Fish Shellfish Immunol, 2015, 42(2):325-34.
[15] 韋先超, 楊澤曉, 王印, 等.草魚出血病病毒VP7蛋白基因的人工合成與原核表達[J]. 海洋與湖沼, 2013, 44(3): 645-650.
[16] HAO K, CHEN X H, QI XZ, et al. Display of GCRV vp7 protein on the surface ofand its immunoprotective effects in grass carp ()[J].Fish Shellfish Immunology, 2018,72:199-209.
[17] 郝貴杰, 潘曉藝, 姚嘉赟, 等. 草魚呼腸孤病毒衣殼蛋白VP7基因真核表達載體pCI-VP7的構建及鑒定[J]. 水產學報, 2010, 34(5): 807-813.
[18] 閆秀英, 郭定利, 鄭樹城, 等. 草魚呼腸孤病毒096基因生物信息學分析及其在腎細胞中的表達[J]. 廣東海洋大學學報, 2015, 35(4): 56-62.
[19] YAN X Y, XIE J G, LI J, et al. Screening and analysis on the protein interaction of the protein VP7 in grass carp reovirus[J]. Virus Genes, 2015, 50(3):425-33.
[20] YAN X Y, XIONG L F, LI J, et al. GCRV 096 VP6 protein and its impacts on GCRV replication with different genotypes in CIK cells[J]. Aquaculture and Fisheries, 2018, 3(5):184-190.
[21] 鄭樹城, 謝吉國, 王雅, 等. 草魚呼腸孤病毒096基因生物信息學分析及其酵母表達載體的構建[J]. 廣東海洋大學學報, 2014, 34(6): 31-37.
[22] KULESHOV M V, JONES M R, ROUILLARD A D, et al. Enrichr: a comprehensive gene set enrichment analysis web server 2016 update[J]. Nucleic Acids Research, 2016, 44(W1): W90-97.
[23] WANG T, LI J L, LV L Q. Quantitative in vivo and in vitro characterization of co-infection by two genetically distant grass carp reoviruses[J]. Journal of General Virology, 2013, 94(Pt 6): 1301-1309.
[24] HE L B, ZHANG A D, PEI Y Y, et al. Differences in responses of grass carp to different types of grass carp reovirus (GCRV) and the mechanism of hemorrhage revealed by transcriptome sequencing[J]. BMC Genomics, 2017, 18(1):452.
[25] 王方華, 李安興. 草魚病毒性出血病研究進展[J]. 南方水產, 2006, 2(3): 67-71.
[26] 陳叢琳, 孫小云, 廖蘭杰, 等. 利用抗草魚IgM的單鏈抗體分析草魚呼腸孤病毒的免疫原性[J]. 中國科學:生命科學, 2012, 42(12): 986-992.
[27] 劉世旭, 王慶, 常藕琴, 等. 基因Ⅰ型草魚呼腸孤病毒VP7蛋白合成肽抗體的制備及應用[J]. 南方農業學報, 2018, 49(9): 1849-1857.
[28] MA J, ZENG L B, FAN Y D, et al. Significant inhibition of two different genotypes of grass carp reovirus in vitro using multiole shRNAs expression vectors[J]. Virus Research, 2014, 189: 47-55.
楊碩,陳靜妮,胡海浩,等. 草魚呼腸孤病毒GCRV 096 VP7蛋白的表達及免疫原性[J]. 廣東海洋大學學報,2020,40(4):1-7.
Expression and Immunogenicity of VP7 Protein in Grass Carp Reovirus (GCRV) 096 Strain
YANG Shuo, CHEN Jing-ni, HU Hai-hao, WANG Ya, YAN Xiu-ying, JIAN Ji-chang
(,,,,524088,)
【Objective】To study the prokaryotic and eukaryotic expression of thegene of grass carp reovirus (GCRV) 096 strain, and the coded protein’s immunogenicity. 【Method】The Open Reading Frame (ORF) of GCRV 096gene was acquired by RT-PCR. The prokaryotic expression vector pET-VP7 of GCRV 096gene was structured. Grass carp () was challenged with GCRV 096 or GCRV GD108 after 15 days immunization with the expressed fusion GCRV 096 VP7 protein, and the immunogenicity of GCRV 096 VP7 protein was analyzed. Furthermore, the eukaryotic expression vector pEGFP-N3-VP7 of GCRV 096gene was structured, and the expression of GCRV 096gene in CIK cells was analyzed.【Result and Conclusion】The ORF of GCRV 096gene (GenBank accession number: JN206665) was 831 bp encoding for a protein with 276 amino acid residues. The prokaryotic expression vector pET-VP7 of the GCRV 096gene was constructed successfully, and the GCRV 096 VP7 protein was expressed successfully transformed intoBL21. The optimal expression condition was 0.2 mmol/L IPTG at 28 ℃ for 5 hours. Then the expressed fusion GCRV 096 VP7 protein was purified with the HisTrap HP purification column. Western blot result showed that the recombinant VP7 was of expected size. After the grass carp was immunized and challenged, the expression level of GCRV 096gene decreased (< 0.05) in the immunized group (GCRV 096, genotype I) compared to the control group; but the expression level of GCRV GD108gene had no significant difference between the immunization group (GCRV GD108, genotype Ⅱ) and the control group. The results indicated that the recombinant protein had good immunogenicity for GCRV 096 but with no obvious immune effect for GCRV GD108. Moreover, eukaryotic expression vector pEGFP-N3-VP7 of GCRV 096gene was structured successfully. The results of western blot showed that GCRV 096 VP7 protein was expressed successfully in CIK cells.
Grass carp reovirus;gene; expression; immunogenicity
Q78;Q959.46+8
A
1673-9159(2020)04-0001-07
10.3969/j.issn.1673-9159.2020.04.001
2020-01-20
國家自然科學基金(31602199);廣東省自然科學基金(2015A030313622);湛江市科技計劃項目(2015A03027);廣東海洋大學校級項目(K15246)和973項目(2009CB118704)
楊碩(1994-),女,碩士生,主要從事水生動物病害防控。Email: 1079761052@qq.com
閆秀英(1978-),女,副教授,主要從事水生動物病害防控。Email: yanxiuying1201@126.com
(責任編輯:劉慶穎)

