冬凌草甲素對大鼠腦出血后繼發性腦損傷的保護機制
熊靜 盧冬林 王梓炫 邢昂
[摘要] 目的 探討冬凌草甲素(Ori)對大鼠腦出血(ICH)后繼發性腦損傷的神經保護作用及其機制。
方法 將大鼠隨機分為假手術組、ICH組、溶劑組以及Ori低、中、高劑量組,其中后5組大鼠采用右側基底核區注射膠原酶的方法制備ICH模型。Ori低、中、高劑量組分別給予5、15、25 mg/kg的Ori腹腔注射,溶劑組腹腔注射等體積的生理鹽水。手術或藥物處理72 h后進行神經行為學檢測,之后處死大鼠提取腦組織,通過測量腦含水量評價腦水腫情況,采用Fluoro Jade-C染色檢測神經元損傷情況,采用Western blot檢測核因子κB(NF-κB)、紅系衍生的核轉錄相關因子2(Nrf2)和血紅素加氧酶-1(HO-1)的表達,采用酶聯免疫吸附試驗檢測促炎因子腫瘤壞死因子(TNF)-α、白細胞介素(IL)-1β和IL-6的表達,采用免疫熒光染色檢測Nrf2和HO-1的表達。
結果 Ori中、高劑量組神經行為學評分、變性神經元的數量、腦含水量均較ICH組和溶劑組明顯下降。ICH組和溶劑組大鼠腦組織NF-κB、Nrf2和HO-1的蛋白表達均較假手術組升高,經中、高劑量Ori處理后NF-κB表達降低,而Nrf2和HO-1表達進一步升高,差異均有顯著性(F=15.17~61.18,P<0.05)。經中劑量Ori處理后ICH大鼠腦內TNF-α、IL-1β和IL-6的表達下降(F=24.53~69.26,P<0.05)。
結論 Ori可減輕ICH后神經元的損傷和腦水腫程度,促進神經功能的恢復,具有神經保護作用,其機制可能是通過促進Nrf2/HO-1抗氧化信號通路和抑制NF-κB炎癥通路來減輕ICH后腦損傷。
[關鍵詞] 冬凌草素;腦出血;氧化性應激;炎癥;神經保護;大鼠
[中圖分類號] R743.3
[文獻標志碼] A
[文章編號] 2096-5532(2020)03-0275-06
doi:10.11712/jms.2096-5532.2020.56.116
[開放科學(資源服務)標識碼(OSID)]
[網絡出版] https://kns.cnki.net/kcms/detail/37.1517.R.20200611.1338.002.html;2020-06-11 13:42
PROTECTIVE MECHANISM OF ORIDONIN IN SECONDARY BRAIN INJURY AFTER INTRACEREBRAL HEMORRHAGE IN RATS
\ XIONG Jing, LU Donglin, WANG Zixuan, XING Ang
\ (Departments of Geriatrics Medicine, The Affiliated Hospital of Qingdao University, Qingdao 266100, China)
[ABSTRACT]\ Objective\ To investigate the neuroprotective effect and mechanism of action of oridonin (Ori) in secondary brain injury after intracerebral hemorrhage (ICH) in rats.
\ Methods\ All rats were randomly divided into sham group, ICH group, solvent group (intraperitoneal injection of an equal volume of normal saline to Ori), low-dose Ori group (intraperitoneal injection of Ori at 5 mg/kg), medium-dose Ori group (intraperitoneal injection of Ori at 15 mg/kg), and high-dose Ori group (intraperitoneal injection of Ori at 25 mg/kg). A rat model of ICH was established by injection of collagenase into the right basal ganglia in the last five groups. The neurobehavioral performance of the rats was observed 72 h after treatment. Then the rats were sacrificed to obtain the brain tissue; brain water content was determined to evaluate brain edema, and Fluoro-Jade C staining was used to detect neuronal damage. Western blot was applied to measure the expression of nuclear factor kappa B (NF-κB), nuclear factor erythroid 2-related factor 2 (Nrf2), and heme oxygenase-1 (HO-1). Enzyme-linked immunosorbent assay was performed to determine the expression of the pro-inflammatory factors tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β), and interleukin-6 (IL-6). Immunofluorescent staining was used to measure the expression of Nrf2 and HO-1.
\ Results\ The medium-dose and high-dose Ori groups had significantly reduced neurobehavioral score, number of degenerative neurons, and brain water content than the ICH group and solvent group. Compared with the sham group, the expression of NF-κB, Nrf2, and HO-1 in the brain tissue was significantly increased in the ICH group and solvent group; either medium-dose or high-dose Ori significantly decreased the up-regulated expression of NF-κB, and further significantly increased the expression of Nrf2 and HO-1 (F=15.17-61.18,P<0.05). Medium-dose Ori significantly reduced the expression of TNF-α, IL-1β, and IL-6 in the brain tissue of the ICH rats (F=24.53-69.26,P<0.05).
\ Conclusion\ Ori can alleviate neuronal damage and cerebral edema following ICH, and contribute to recovery of neurological function and exert a neuroprotective effect, possibly through promoting the Nrf2/HO-1 antioxidant pathway and inhibiting the NF-κB inflammatory pathway.
[KEY WORDS]\ RUBESCENSINE; cerebral hemorrhage; oxidative stress; inflammation; neuroprotection; rats
腦出血(ICH)是第二常見的腦卒中類型,致死率和致殘率高[1-2]。迄今為止,ICH治療干預的重點是早期預防血腫擴張,包括止血和抗高血壓療法,但并不能夠有效減少血腫的擴張以及改善預后[3]。ICH分為原發和繼發性損傷,腦血管外滲的血液在實質中形成血腫,使局部壓力增大,導致原發性腦損傷,隨后血腫降解又會引起細胞損傷、氧化應激和炎癥反應,進而出現細胞死亡、腦水腫和神經行為缺陷等,導致繼發性損傷[4]。越來越多研究表明,血腫形成后炎癥反應和氧化應激與ICH誘發的繼發性腦損傷和神經功能障礙密切相關,針對治療腦血腫和ICH相關藥物研發一直以來都是研究的熱點[5-6]。冬凌草甲素(Ori)屬于二萜類化合物,具有抗炎、抗菌、抗腫瘤和抗氧化等多種生物學作用[7-8]。有研究表明,Ori可減輕脂多糖(LPS)誘導的小膠質細胞的炎癥反應[9]。Ori也可直接抑制核苷酸結合寡聚化結構域樣受體蛋白3(NLRP3)炎癥小體以及核因子κB(NF-κB)炎癥通路,減輕卡拉膠誘導的小鼠胸膜炎[10]。此外,Ori還可以激活Kelch樣環氧氯丙烷相關聯蛋白1(KEAP-1)/核轉錄相關因子2(Nrf2)信號通路的表達,從而發揮抗氧化的作用[10]。但是,Ori在ICH中的作用及機制尚不明確,故本研究對大鼠ICH模型進行Ori干預,觀察不同劑量Ori對ICH大鼠神經功能、神經元變性、NF-κB及Nrf2/血紅素加氧酶-1(HO-1)信號通路表達水平的影響,以探討Ori在ICH中的作用及其可能的機制。現將結果報告如下。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物 SPF級雄性SD大鼠150只,體質量250~280 g,購自北京維通利華實驗動物公司。每籠6只群養于青島大學醫學部動物中心大鼠飼養室。飼養條件:環境清潔,溫度及濕度舒適,12 h晝夜交替,自由飲水和攝入食物。該動物實驗獲青島大學附屬醫院醫學倫理委員會同意。
1.1.2 藥品和試劑 Ori購自上海阿拉丁生化科技股份有限公司(貨號:28957-04-2);膠原酶和Fluoro Jade-C(FJC)染料購自美國Sigma公司;腫瘤壞死因子(TNF)-α、白細胞介素(IL)-1β、IL-6酶聯免疫吸附試驗(ELISA)試劑盒購自武漢伊萊瑞特生物科技股份有限公司;NF-κB抗體購自美國Cell Signaling Technology公司;Nrf2、HO-1多克隆抗體購自美國Affinity公司。
1.2 實驗方法
1.2.1 動物分組及處理 將大鼠隨機分為假手術組(Sham組,A組)、ICH組(B組)、溶劑組(ICH+Veh組,C組)、Ori低劑量組(ICH+LOri組,D組)、Ori中劑量組(ICH+MOri組,E組)、Ori高劑量組(ICH+HOri組,F組)。實驗大鼠在實驗前8 h禁止飲食。除Sham組外,其余5組大鼠使用膠原酶誘導建立ICH模型[11]。大鼠麻醉后固定在腦立體定向儀上,以前囟為原點,向右3.5 mm、向前0.2 mm作為穿刺點,進針深度5.5 mm,用10 μL微量注射泵以1 μL/min注入1 μL膠原酶Ⅳ(3 U),留針10 min,緩慢退針,用骨蠟封閉其骨孔,消毒縫合切口,將大鼠置于籠中觀察,待其麻醉復蘇。待大鼠麻醉清醒,Ori低、中、高劑量組于術后2、24和48 h分別給予Ori 5、15、25 mg/kg的腹腔注射(由于Ori可透過血-腦脊液屏障,故本次藥物注射的方式采用腹腔注射),ICH+Veh組腹腔注射等體積的生理鹽水。Sham組操作與ICH組相同,但不注射膠原酶。150只大鼠進行手術,其中114只手術成功,36只手術失敗或死亡。
1.2.2 神經行為學檢測 手術或藥物處理72 h后,每組取6只大鼠,使用改良神經功能缺損程度評分(mNSS)對大鼠的神經功能進行評定,包括提尾試驗、行走試驗、感覺試驗、平衡木試驗等。對這些項目進行綜合評分,總分0~18分,評分越高,神經系統損害就越嚴重。
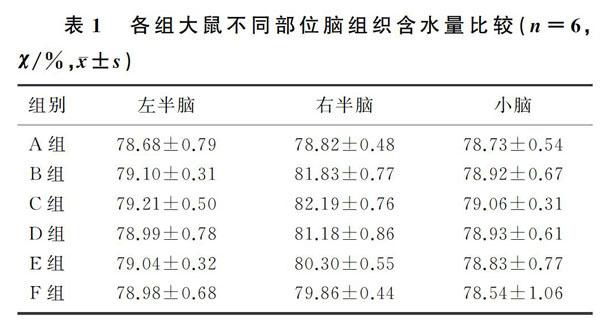
1.2.3 腦含水量測定 神經功能評定后處死大鼠取全腦,去除嗅球和腦干,將其分為左腦、右腦、小腦等3部分,迅速稱濕質量。然后將腦組織放到烘箱,在100 ℃溫度下烘干24 h,稱干質量。腦含水量=(濕質量-干質量)/濕質量×100%。
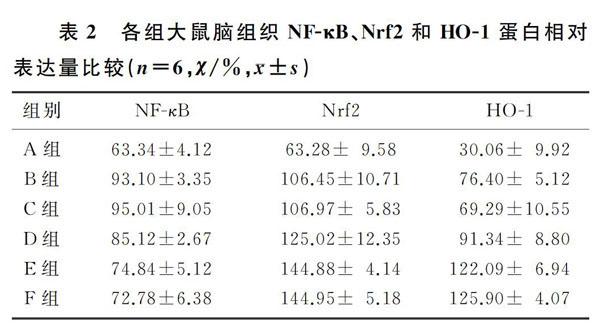
1.2.4 Western blot檢測NF-κB、Nrf2和HO-1蛋白表達 在手術和藥物處理72 h后,每組取6只大鼠,提取其腦組織置于-80 ℃冰箱里冷凍保存。取出冷凍的腦組織放在冰板上面,用刀片將ICH區域的腦組織分成5等份,取血腫周圍組織提取蛋白質(后續實驗取樣的腦組織均為血腫周圍組織),用BCA法測量蛋白質的濃度,SDS-PAGE凝膠跑膠,每孔上樣10 μg蛋白,電泳(80 V,30 min,再120 V跑到底),轉PVDF膜(250 mA,1.5 h),應用體積分數0.05牛奶封閉1.5 h,加一抗4 ℃過夜,加二抗室溫1.5 h,顯影。
1.2.5 ELISA檢測TNF-α、IL-1β和IL-6表達 取Sham組、ICH組、ICH+Veh組和ICH+MOri組的大鼠腦組織,采用雙抗體夾心ELISA法檢測TNF-α、IL-1β、IL-6的表達。在酶標板中加100 μL標準品工作液或樣本,37 ℃孵育90 min,棄液,加100 μL生物素化抗體工作液,37 ℃孵育60 min,洗板3次;每孔加入100 μL HRP酶結合物工作液,37 ℃孵育30 min,棄液,洗板5次;每孔加90 μL底物溶液,37 ℃孵育15 min,每孔加50 μL終止液,立即讀取450 nm波長處的吸光度值。
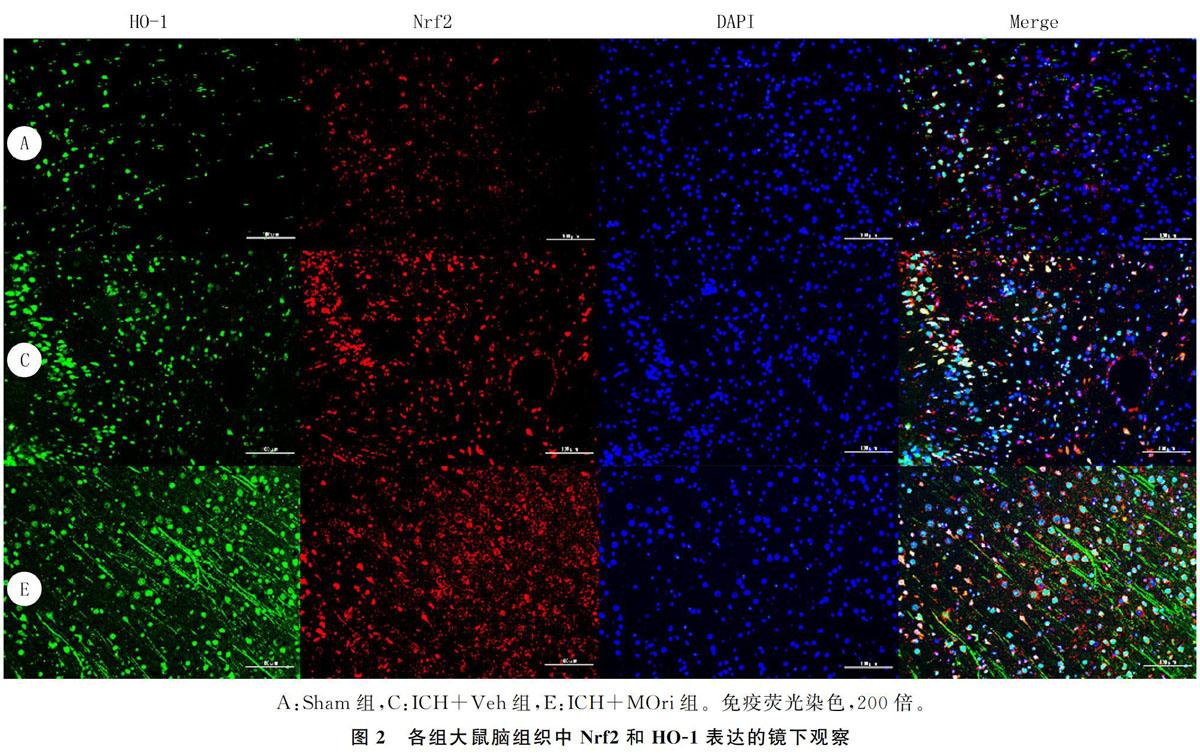
1.2.6 免疫熒光染色檢測Nrf2、HO-1的表達 取Sham組、ICH+Veh組和ICH+MOri組的大鼠腦組織進行免疫熒光染色。首先用40 g/L的多聚甲醛灌注取腦,蔗糖梯度沉糖后,進行冷凍切片;固定、通透、封閉切片,加Nrf2、HO-1一抗4 ℃過夜,加熒光二抗室溫1 h;用含DAPI的封片劑封片,螢光顯微鏡下觀察陽性細胞數。
1.2.7 FJC染色檢測神經元損傷情況 取Sham組、ICH+Veh組和ICH+MOri組的大鼠腦組織進行FJC染色。腦組織冷凍切片室溫復溫30 min,用雙蒸水浸泡2 min,50 ℃烘干30 min,置于含10 g/L NaOH的體積分數0.80乙醇中浸泡5 min,置于體積分數0.70乙醇中浸泡2 min,以雙蒸水浸洗2 min;將切片放入0.6 g/L高錳酸鉀溶液中反應10 min,用蒸餾水浸洗2 min;將切片放入FJC溶液中反應20 min,以雙蒸水浸洗3次,每次2 min;再置50 ℃的烘箱中烘干,二甲苯透明2 min;最后用DPX封片液封片,在熒光顯微鏡下計數FJC陽性細胞并拍照。
1.3 統計學分析
應用Graph Pad Prism 5.0軟件進行統計學分析,計量數據以±s形式表示,采用單因素方差分析(ANOVA)進行多組比較,然后用Tukey法進行組間兩兩比較。以P<0.05為差異有顯著性。
2 結果
2.1 Ori對ICH大鼠神經功能評分的影響
手術或藥物處理72 h后,Sham組、ICH組、ICH+Veh組、ICH±LOri組、ICH+MOri組和ICH+HOri組的mNSS評分分別為0.67±0.58、10.33±1.53、10.00±1.73、8.00±1.00、6.67±0.58和6.33±0.58(n=6)。與Sham組比較,ICH組和
ICH+Veh組的mNSS評分明顯升高(F=30.33,
q=15.140、14.620,P<0.05),而ICH組與ICH+Veh組比較差異無顯著性(P>0.05);與ICH組和ICH+Veh組相比,Ori處理各組mNSS評分均有下降,其中ICH+MOri組、ICH+HOri組的差異具有顯著性(q=5.222~5.745,P<0.05),而ICH+MOri組和ICH+HOri組mNSS評分比較差異無統計學意義(P>0.05)。
2.2 各組腦組織含水量比較
各組大鼠左半腦和小腦含水量比較差異均無統計學意義(P>0.05)。ICH后大鼠右半腦含水量顯著增加,經過中、高劑量Ori處理后,大鼠右半腦含水量顯著降低(F=21.76,q=6.924~8.527,P<0.05),而ICH+MOri組和ICH+HOri組間腦水腫減輕的程度差異無統計學意義(P>0.05),ICH組與ICH+Veh組間相比較差異也無統計學意義(P>0.05)。見表1。
2.3 Ori對ICH大鼠腦組織中NF-κB、Nrf2以及HO-1表達的影響
ICH組和ICH+Veh組大鼠腦組織中NF-κB、Nrf2和HO-1的蛋白表達均較Sham組升高,經中、高劑量Ori處理后NF-κB表達降低,而Nrf2和HO-1的表達則進一步升高,差異均有統計學意義(F=15.17~61.18,q=6.303~10.110,P<0.05);ICH+MOri組和ICH+HOri組間各指標比較差異均無統計學意義(P>0.05)。見圖1、表2。
2.4 Ori對ICH大鼠腦組織炎癥因子表達的影響
綜合上述神經行為學、腦含水量以及Western blot的檢測結果,可知Ori在中、高劑量時均對ICH大鼠有神經保護作用,并且兩組治療效果無明顯差別,因此Ori處理各組中僅選擇ICH+MOri組進行后續實驗。
ICH后腦組織中炎癥因子TNF-α、IL-1β和IL-6的表達顯著升高,在Ori處理后各指標的表達明顯下降(F=24.53~69.26,q=6.208~17.120,P<0.05)。見表3。
2.5 各組腦組織中Nrf2和HO-1的熒光表達比較
ICH后抗氧化蛋白Nrf2及其下游蛋白HO-1的表達均增加,經中劑量Ori處理后,ICH+MOri組Nrf2和HO-1的表達較ICH+Veh組明顯增高,差異均具有統計學意義(F=347.30、61.14,q=4.780~18.880,P<0.05)。見圖2、表4。
2.6 各組神經元損傷情況比較
與Sham組相比,ICH+Veh組血腫周圍綠色熒光的數量明顯增多(F=97.99,q=19.970,P<0.05),而ICH+MOri組綠色熒光的數量較ICH+Veh組減少(q=13.180,P<0.05)。見圖3、表4。
3 討論
ICH早期致死率、致殘率都很高,目前還沒有理想的治療方法[12-13]。越來越多的證據表明,氧化應激和炎癥在ICH后繼發性腦損傷中發揮著重要作用[14-16],這種繼發過程會導致ICH后病人的神經功能惡化[17]。本文的研究結果顯示,ICH+MOri組和ICH+HOri組大鼠的mNSS評分、FJC陽性神經元數量以及促炎因子表達均顯著下降,表明15和25 mg/kg的Ori均能夠改善ICH后早期腦損傷和神經功能缺陷,并且15 mg/kg為理想劑量。
小膠質細胞介導的炎癥損傷在ICH中起至關重要的作用用[18-19]。ICH發生后,小膠質細胞中的
NF-kB會被激活,進而使促炎因子的釋放增加,導致
早期腦損傷用[20],而這些促炎因子又作為NF-κB的激活劑,正反饋促進NF-κB的轉錄,進而加重炎癥反應[21]。NF-κB作為一個關鍵的核轉錄因子,一直被公認是炎癥反應的關鍵調節器[22],抑制NF-κB的活性可以減輕神經功能損傷[23]。已有多項研究表明,Ori在抗腫瘤、促凋亡、抗炎、抗氧化、神經調節等方面有著十分重要的作用[14-25],但其在ICH中的作用尚未見報道。ZHAO等[26]的研究結果顯示,Ori通過調節Toll樣受體4(TLR4)/NF-κB信號通路抑制促炎因子的表達,在小鼠急性肺損傷中起保護作用。有研究表明,Ori能夠抑制NF-κB通路和Aβ1-42誘導的神經炎癥[27]。本研究也證實了Ori的抗炎作用,在大鼠ICH后,15 mg/kg的Ori能夠抑制NF-κB的表達和促炎因子的釋放,減輕ICH后腦內的炎癥反應。
此外,氧化應激是ICH后繼發性腦損傷的重要原因[28],Nrf2作為氧化應激反應中的關鍵轉錄因子和主要調節劑,在ICH后其表達逐漸增加,并誘導抗氧化基因的表達,在保護腦組織免受ICH后的氧化損傷中起重要作用[29]。研究已表明,Ori還可通過抑制NADPH氧化酶,促進KEAP-1與Nrf2解離,這樣就會使Nrf2進入細胞核中轉錄并激活下游
蛋白HO-1,在疾病中發揮抗氧化作用[10]。ZENG等[30]研究表明,異黃體生成素可以加快激活Nrf2介導的抗氧化信號通路從而減少對實驗性ICH后的早期腦損傷。這與本研究結果類似,提示Ori可能通過促進Nrf2/HO-1抗氧化作用,減輕ICH大鼠的早期腦損傷,起到神經保護作用。
綜上所述,Ori對ICH模型大鼠早期腦損傷具有一定的保護作用,其機制可能為Ori通過促進Nrf2/HO-1抗氧化作用以及抑制NF-κB介導的炎癥通路,減少氧化應激和炎癥細胞浸潤,從而在ICH早期腦損傷中起到神經保護作用。
[參考文獻]
[1]MORGENSTERN L B, HEMPHILL I J, ANDERSON C, et al. Guidelines for the management of spontaneous intracerebral hemorrhage a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J].? Stroke, 2010,41(9):2108-2129.
[2]STEINER T, AL-SHAHI SALMAN R, BEER R, et al. European stroke organisation (ESO) guidelines for the management of spontaneous intracerebral hemorrhage[J].? International Journal of Stroke: Official Journal of the International Stroke Society, 2014,9(7):840-855.
[3]LEI Chunyan, CHEN Tao, CHEN Chun, et al. Pre-intracerebral hemorrhage and in-hospital statin use in intracerebral hemorrhage: a systematic review and meta-analysis[J].? World Neurosurgery, 2018,111:47-54.
[4]RICHARD F K, ZHOU N N, XIANG J M, et al. Vascular disruption and blood-brain barrier dysfunction in intracerebral hemorrhage[J].? Fluids and Barriers of the CNS, 2014,11(1):18.
[5]WANG Jian. Preclinical and clinical research on inflammation after intracerebral hemorrhage[J].? Progress in Neurobiology, 2010,92(4):463-477.
[6]CHEN Sheng, YANG Qingwu, CHEN Gang, et al. An update on inflammation in the acute phase of intracerebral he-
morrhage[J].? Translational Stroke Research, 2015,6(1):4-8.
[7]LUO H, VONG C T, CHEN H B, et al. Naturally occurring anti-cancer compounds: shining from Chinese herbal medicine[J].? Chinese Medicine, 2019,14(1):48.
[8]LI Dahong, HAN Tong, LISO Jie, et al. Oridonin, a promi-
sing ent-Kaurane diterpenoid lead compound[J].? International Journal of Molecular Sciences, 2016,17(9):1395.
[9]XU Yan, XUE Yang, WANG Ying, et al. Multiple-modulation effects of Oridonin on the production of proinflammatory cytokines and neurotrophic factors in LPS-activated microglia[J].? International Immunopharmacology, 2009,9(3):360-365.
[10]YANG Huahong, HUANG Jingbo, GAO Yanli, et al. Oridonin attenuates carrageenan-induced pleurisy via activation of the KEAP-1/Nrf2 pathway and inhibition of the TXNIP/NLRP3 and NF-κB pathway in mice[J].? Inflammopharmacology, 2020,28(2):513-523.
[11]CHEN Chunli, ZHOU Fang, ZENG Liuwang, et al. Methy-
lene blue offers neuroprotection after intracerebral hemorrhage in rats through the PI3K/Akt/GSK3β signaling pathway[J].? Journal of Cellular Physiology, 2019,234(4):5304-5318.
[12]KEEP R F, HUA Y, XI G. Intracerebral haemorrhage: mechanisms of injury and therapeutic targets[J].?? Lancet Neurol,? 2012,11(8):720-731.
[13]VANASCH C J, LUITSE M J, RINKEL G J, et al. Incidence, case fatality, and functional outcome of intracerebral haemorrhage over time, according to age, sex, and ethnic origin: a systematic review and meta-analysis[J].? Lancet Neurol,? 2010,9(2):167-176.
[14]白威,楊薛康,楊國棟. 鈉氫交換蛋白1抑制劑對膿毒癥大鼠心臟損傷保護作用的實驗研究[J].? 陜西醫學雜志, 2015,44(6):643-645.
[15]XI G H, KEEP R F, HOFF J T. Mechanisms of brain injury after intracerebral haemorrhage[J].? The Lancet Neurology, 2006,5(1):53-63.
[16]DUAN X, WEN Z, SHEN H, et al. Intracerebral hemorrhage, oxidative stress, and antioxidant therapy[J].? Oxid Med Cell Longev,? 2016,2016:1203285.
[17]WANG J, DORE S. Inflammation after intracerebral he-
morrhage[J].? Journal of Cerebral Blood Flow and Metabolism: Official Journal of the International Society of Cerebral Blood Flow and Metabolism, 2007,27(5):894-908.
[18]ZHAO Yang, YU Anyong, LIU Yongping, et al. Regulatory T cells inhibit microglia activation and protect against inflammatory injury in intracerebral hemorrhage[J].? International Immunopharmacology, 2014,22(2):522-525.
[19]HARRY G J, KRAFT A D. Microglia in the developing brain: a potential target with lifetime effects[J].? Neurotoxicology, 2012,33(2):191-206.
[20]FRAKES A E, FERRAIUOLO L, HAIDET-PHILLIPS A M, et al. Microglia induce motor neuron death via the classical NF-kappaB pathway in amyotrophic lateral sclerosis[J].? Neuron, 2014,81(5):1009-1023.
[21]HANG Chunhua, SHI Jixin, LI Jieshou, et al. Expressions of intestinal NF-κB, TNF-α, and IL-6 following traumatic brain injury in rats[J].? Journal of Surgical Research, 2005,123(2):188-193.
[22]BAHAR M, MATTHEW C C. Nuclear factor-kappaB in autoimmunity: man and mouse[J].? Frontiers in Immunology, 2018,9:613.
[23]LIN Sen, YIN Qing, ZHONG Qi, et al. Heme activates TLR4-mediated inflammatory injury via MyD88/TRIF signaling pathway in intracerebral hemorrhage[J].? Journal of Neuroinflammation, 2012,9(1):46.
[24]WANG Yanyan, LV Yanfang, LU Lu, et al. Oridonin inhibits mTOR signaling and the growth of lung cancer tumors[J].? Anti-Cancer Drugs, 2014,25(10):1192-1200.
[25]XU J M, ERIC W, YE D, et al. Therapeutic potential of oridonin and its analogs: from anticancer and antiinflammation to neuroprotection[J].? Molecules, 2018,23(2):474.
[26]ZHAO Gan, ZHANG Tao, MA Xiaofei, et al. Oridonin atte-
nuates the release of pro-inflammatory cytokines in lipopolysaccharide-induced RAW264.7 cells and acute lung injury[J].? Oncotarget, 2017,8(40):68153-68164.
[27]WANG Sulei, YANG Hui, YU Linjie, et al. Oridonin attenuates Aβ1-42-induced neuroinflammation and inhibits NF-κB pathway[J].? PLoS One, 2014,9(8):e104745.
[28]HU X, TAO C, GAN Q, et al. Oxidative stress in intracerebral hemorrhage: sources, mechanisms, and therapeutic targets[J].? Oxid Med Cell Longev, 2016,2016:3215391.
[29]SHANG H, YANG D, ZHANG W, et al. Time course of Keap1-Nrf2 pathway expression after experimental intracerebral haemorrhage: correlation with brain oedema and neurological deficit[J].? Free Radic Res, 2013,47(5):368-375.
[30]ZENG Jun, CHEN Yizhao, DING Rui, et al. Isoliquiritigenin alleviates early brain injury after experimental intracerebral hemorrhage via suppressing ROS-and/or NF-κB-mediated NLRP3 inflammasome activation by promoting Nrf2 antioxidant pathway[J].? Journal of Neuroinflammation, 2017,14(1):119.
(本文編輯 馬偉平)

