百香果皮果膠的理化及凝膠特性
黎英,周榮池,劉夏蕾,梁月霜,羅正成,汪美珍
(龍巖學院, 福建 龍巖, 364012)
百香果又名西番蓮、雞蛋果,為半木質藤本攀緣或多年生常綠草質植物,在我國臺灣、海南、廣東、福建等地種植歷史較長,并產生了一定的商業規模。整個百香果鮮果中,果皮約占50%~55%,百香果皮不僅含有膳食纖維、維生素、花色苷及果膠等有益成份,還含有大量的水分[1-2]。現階段國內加工企業對于百香果的產品開發主要集中在果肉飲料加工,利用百香果皮所生產的制品受限于技術等原因,主要是初加工產品,如果脯、果醬及蜜餞類等食品,產品種類單一,生產總量少,加工水平較低,附加值也不高。同時因百香果皮水分含量高,造成其貯藏困難、易腐爛變質,污染環境。因此,合理開發和利用百香果皮,增加百香果皮附加值,減少環境污染,很有現實意義。
果膠是一種親水性植物多糖,主要由α-1,4-糖苷鍵連接的聚半乳糖醛酸長鏈聚合而成,分子質量大多為10 000~40 000 Da,具有多種藥學特性,如降血脂、降血糖、預防肥胖、保護胃黏膜等功效,作為一種凝膠劑、增稠劑、乳化劑和穩定劑在食品、化工等各領域被廣泛應用[3-5]。
百香果皮果膠含量較高,目前,關于西番蓮果膠或百香果果膠的研究多為提取工藝、純化、組成和抗氧化等方面研究,如劉運花等[6],陳穎珊等[7-8],黎英等[9],彭雅玲等[10]對這相關方面進行了探究。而對百香果皮果膠理化性質、傅里葉紅外光譜、質構特性及凝膠特性研究甚少,所以對百香果皮果膠進行理化指標、紅外光譜分析、質構和凝膠特性的深入研究具有實際意義。本研究將百香果皮果膠作為原料,根據GB2553—2010/QB2484—2000中的方法研究了其理化特性,利用傅里葉紅外光譜分析了果膠中主要的官能團結構.并研究了果膠質量濃度、蔗糖添加量、溫度、pH、金屬離子類型對百香果皮果凝膠特性和持水性的影響,以期為百香果皮作為一種新型原材料用于提取商品化果膠奠定基礎。
1 材料與方法
1.1 實驗材料
1.1.1 材料與試劑
百香果鮮果皮(紫香1號)由龍巖道心農業發展有限公司提供,將百香果皮清洗,烘干,粉碎過80目篩后備用;咔唑、D-(+)-半乳糖醛酸、考馬斯亮藍G-250、牛血清蛋白,北京博奧拓科技有限公司;卡拉膠、商品果膠(柑橘)、黃原膠,中盛生物科技有限公司;檸檬酸,河南譽信生物科技;C2H5OH、KBr、H2SO4、FeCl3、、CaCl2、MgCl2、ACl2等,均為國產分析純。
1.1.2 儀器與設備
ST16R高速冷凍離心機,美國Thermo;CW-2000超聲-微波協同萃取/反應儀,上海新拓分析儀器科技有限公司;EYELA N-1300旋轉蒸發儀,日本東京理化公司;SX2-4-10箱式電阻爐,上海躍進醫療器械廠;UV-9100紫外可見分光光度計,北京萊伯泰科儀器有限公司;UB-7 PH,計美國丹佛;ZD-2自動電位滴定儀,上海精密科學儀器有限公司;FDV超細微粉碎機,燕山正德;IS10型傅立葉紅外光譜儀,美國Nicolet儀器公司;NH310全自動色差儀,深圳市三恩馳科技有限公司。
1.2 實驗方法
1.2.1 百香果皮果膠的制備
稱取5.0 g粉末,按照液料比30∶1(mL∶g)加入蒸餾水,檸檬酸調節pH至2.0,50 ℃水浴60 min后,協同萃取(50 W超聲、600 W微波)8.0 min,抽濾,濃縮后用4倍體積的體積分數為95%的乙醇過夜,濾餅(用乙醇反復洗滌2次)真空冷凍干燥,即得百香果皮果膠。
1.2.2 百香果皮果膠理化性質的測定
1.2.2.1 含水量測定
參照國標GB5009.3—2010[11],取1~2 g(精確至0.01 g,下同)百香果皮果膠于105 ℃干燥2 h后,放入干燥器中冷卻稱量,多次重復至正負誤差小于0.002 g,按公式(1)計算百香果皮果膠含水量:
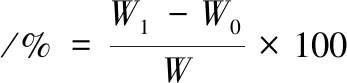
(1)
式中:W1,百香果皮果膠和干燥前稱量瓶的質量,g;W0,百香果皮果膠和干燥后稱量瓶的質量,g;W,百香果皮果膠質量,g。
1.2.2.2 灰分含量測定
參照企標QB2484—2000[12],取1~5 g百香果皮果膠于馬弗爐中,以3.5 ℃/min的升溫速度至580 ℃,灼燒至恒重,按公式(2)計算百香果皮果膠灰分含量:
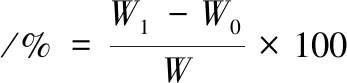
(2)
式中:W1,瓷坩堝和百香果皮果膠灰分的質量,g;W0,瓷坩堝的質量,g;W,百香果皮果膠質量,g。
1.2.2.3 酸不溶性灰分測定
稱取上述灰分,按照GB25533—2010直接稱重法[13],加入20 mL HCl煮沸5 min,過濾(恒重砂芯漏斗),洗滌(熱蒸餾水)至濾液不含Cl-,于(105±2)℃烘至恒重,百香果皮果膠的酸不溶揮發含量按公式(3)計算:
(3)
式中:W1,百香果皮果膠不溶灰分和砂芯漏斗的質量,g;W0,砂芯漏斗的質量,g;W,百香果皮果膠的質量,g。
1.2.2.4 溶解度測定
參照李加興等[14]文獻略作修改,稱取0.2~0.5 g百香果皮果膠,加入50 mL蒸餾水并用HCl(0.1mol/L)調pH至4.0,水浴(40 ℃,0.5 h),過濾(砂芯漏斗),濾液先蒸干(90 ℃水浴鍋),再烘至恒重(105 ℃烘箱),百香果皮果膠的溶解度按公式(4)計算:

(4)
式中:W1,濾液恒重時的質量,g;W,百香果皮果膠質量,g。
1.2.2.5 半乳糖醛酸含量測定
參考黎英等[9]文獻采用硫酸咔唑法進行測定:精確吸取1.0 mL百香果皮果膠提取液,用蒸餾水稀釋到適當質量濃度后取稀釋液1.0 mL,注入6 mL濃H2SO4,混勻加熱20 min(沸水浴),冰浴降至室溫。最后加入質量濃度為1.5 g/L咔唑-乙醇溶液0.5 mL,混勻靜放暗處1 h,于528 nm波長處測其吸光度,由標準線性方程A=0.005C-0.005 2(R2=0.998 9)計算得到半乳糖醛酸含量。
1.2.2.6 酯化度測定
采用滴定法測定,稱取0.5~1 g百香果皮果膠粉末,加少量無水乙醇潤濕后加50 mL蒸餾水,置于磁力恒溫攪拌器上攪拌至溶解,加入酚酞1滴, NaOH(0.1 mol/L)滴定至剛變色并記錄消耗體積(V1),繼續加入NaOH(0.1 mol/L)10 mL 混勻,靜置2.0h(室溫),再加入HCl(0.1 mol/L)10 mL,最后用NaOH(0.1 mol/L)滴定至剛變色并記錄消耗體積(V2)。按公式(5)計算果膠的酯化度:

(5)
式中:V2,NaOH終點消耗體積,mL;V1,NaOH初始消耗體積,mL。
1.2.2.7 蛋白質含量測定
參考黎英等[15]文獻采用考馬斯亮藍法測定:于試管中精確移取稀釋后的百香果果膠樣品1.0 mL,按標準曲線制作方法操作加入考馬斯亮藍G-250溶液 4.0 mL,反應5.0 min后于595 nm波長處測其吸光度,由標準線性方程A=0.008 2C+0.030 6(R2=0.995 3)計算得到蛋白質含量:
1.2.3 百香果皮果膠色差測定
按趙興等[16]文獻中所述方法,采用全自動色差儀在自然光下進行測定,白板校準后測定L*、a*、b*,ΔE(色差值)按公式(6)計算。
(6)
式中:L*(0~100):“0” 代表黑色,“100” 代表白色;a*(-80~100):“+” 代表偏紅,“-” 代表偏綠;b*(-80~70):“+”代表偏黃,“-”代表偏藍。值越大或越小表示偏向趨勢越嚴重。ΔE(0~1.5):人眼感覺不到差異;ΔE(1.5~3.0):人眼感覺稍有差異;ΔE(3.00~6.0):人眼感覺到差異;ΔE(6.0~12.0):人眼感覺很明顯差異;ΔE(>12.0):人眼感覺不同顏色。
1.2.4 百香果皮果膠質構特性測定
參照文獻[17]方法略作改動,配制100 mL混合液(含0.1%黃原膠、0.1%百香果皮果膠、30% 蔗糖、0.9%卡拉膠、0.1%檸檬酸),拌勻,水浴殺菌(85 ℃,15 min),密封,冷藏(4 ℃,18 h)。按上述操作制備加入0.1%商品柑橘果膠和未添加果膠樣品,進行對照試驗。
用CT3質構儀[18],使用TA11(Φ25.4 mm,L35.0 mm)探頭,在TPA測試模式,2.0 mm/s預測速度,1.0 mm/s測試和返回速度,5 g觸發點負載,10 points/s數據頻率,50%目標形變,2次壓縮,10 s間隔時間條件下對樣品(Φ60 mm×50 mm)進行測試,獲得硬度、彈性、黏著性、回復性和咀嚼性等指標,對每組樣品平行測定3次,每次測試完成將探頭擦拭干凈。
1.2.5 百香果皮果膠傅立葉紅外光譜測定
取所提取的百香果皮果膠粉末5.0 mg與0.500 g KBr在紅外燈下用瑪瑙研缽研勻,KBr做對照,干燥1 h(60 ℃),制成薄片,在500~4 000 cm-1范圍內掃描[19]。
1.2.6 百香果皮果膠的凝膠特性分析
1.2.6.1 百香果皮果膠凝膠強度和持水性測定
參照洪亞男的方法[20]制備凝膠體系:于2份50 mL檸檬酸-磷酸氫二鈉緩沖溶液中,分別加入一定質量的百香果皮果膠粉末和蔗糖,水浴(80 ℃)攪拌溶解,恒溫后將添加蔗糖的溶液緩慢混入,10 min后取出,冷藏(4 ℃,24 h),備用。
采用TA10(Φ12.7 mm,L35.0 mm)探頭,TPA測試模式,4.5 g觸發點負載,10 mm下壓距離,10 points/s數據頻率,1次壓縮,1.0 mm/s預測速度,0.5 mm/s測試和返回速度條件下測定果膠的硬度(使果膠凝膠形變到一定程度時所出現的最大力),形變與硬度的乘積即為凝膠強度[21]。
持水性測定參照洪亞男[20]、劉賀等[22]的方法略做修改,于底部有脫脂棉離心管中稱取一定量凝膠,離心(4 000 r/min,15 min),倒出上層凝膠,按公式(7)計算持水率:
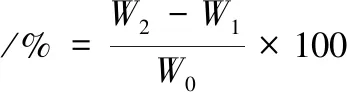
(7)
式中:W0,凝膠質量,g;W1,離心前脫脂棉和離心管質量,g;W2,離心后離心管和脫脂棉質量。
1.2.6.2 各因素對百香果皮果膠凝膠特性的影響
按1.2.6.1制備凝膠體系,設定50%蔗糖添加量、1%百香果皮果膠添加量、80 ℃水浴溫度、pH 3.0、未添加金屬離子為常規量,以百香果果皮果膠質量濃度(4、8、12、16、20、24 g/L)、蔗糖質量濃度(300、400、500、600、700、800 g/L)、溫度(40、50、60、70、80、90 ℃)、pH(2.0、2.4、2.8、3.2、3.6、4.0)、金屬離子(空白、Fe3+、Mg2+、Ca2+、Cu2+、Al3+)中的6個單因素變量替換相應的常規量進行考察,測定其持水性和凝膠強度。
1.3 數據處理
數據測試均重復3次并以X±SD表示,統計分析運用 SPSS 20.0 軟件。
2 結果與分析
2.1 百香果皮果膠的理化性質
由表1可知,提取的百香果皮果膠均符合國標規定食品安全果膠標準。其中干燥失重、灰分和酸不溶性灰分指標均低于國標規定,溶解度為(85.95±0.70)%,半乳糖醛酸含量為(81.99±1.54)%,酯化度為(66.46±0.41)%,三者都高于商品柑橘果膠,且蛋白質含量較低,綜上可知百香果皮果膠是一種純度較高、溶解性好的高酯優質果膠。
2.2 百香果皮果膠色度分析
由表2可知,百香果皮果膠較商品柑橘果膠樣品相比L*值偏小,即百香果皮的顏色較商品柑橘果偏暗。a*值偏大即百香果皮果膠較商品柑橘果膠樣品偏紅,b*小于商品果膠表明顏色偏淡黃,綜合分析百香果皮果膠色差值,表明其色澤為黃褐色,與肉眼觀察結果相符。出現這一顏色的原因可能與百香果皮果膠未純化含有部分色素和雜質有關[16]。
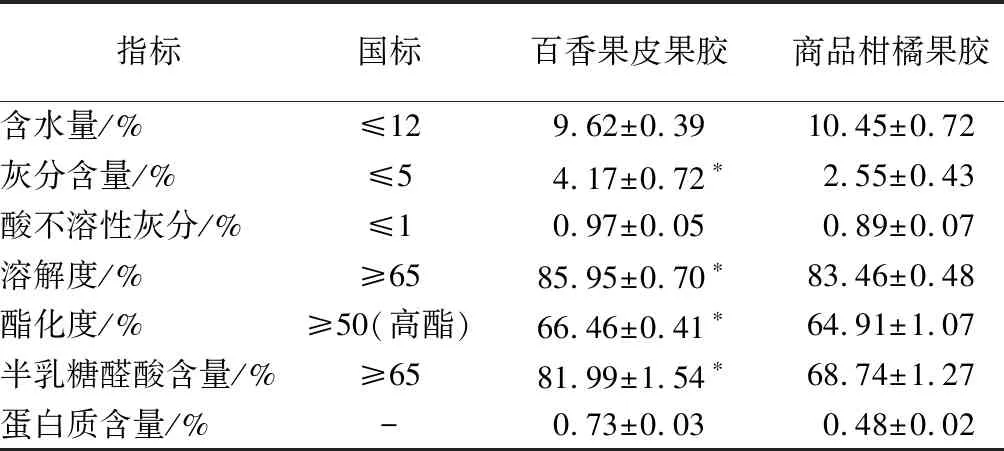
表1 百香果皮果膠的理化性質Table 1 Physicochemical properties of passion fruit peel pectin
注:*表示同一行的差異顯著(P<0.05)(下同)

表2 果膠色差的測定Table 2 Color and aberration anlusis of the pectin
2.3 百香果皮果膠的凝膠質構分析
由表3可知,相同條件下,加入1 g/L百香果皮果膠和添加1 g/L商品柑橘果膠的凝膠樣品內聚性相差不大,百香果果膠凝膠體系的膠著性較商品柑橘果膠樣品低,但其硬度、彈性和咀嚼性均比商品柑橘果膠樣品高。實驗表明凝膠質地在添加百香果皮果膠后變得較堅硬,彈性較好,爽口而耐咀嚼。

表3 百香果皮果膠的質構特性Table 3 Texture properties of pectin from passion fruit peel
注:同行不同小寫字母表示差異顯著(P<0.05)
2.4 百香果皮果膠的傅立葉紅外光譜分析

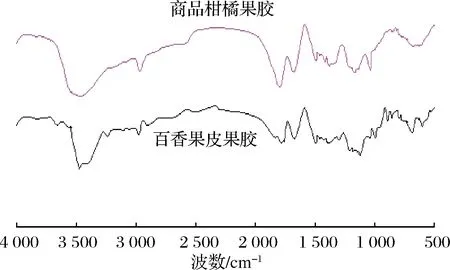
圖1 百香果皮果膠的紅外光譜圖
Fig.1 Infrared spectrum of pectin in passion fruit peel
2.5 百香果皮果膠凝膠特性
2.5.1 百香果皮果膠質量濃度對百香果皮果膠凝膠特性的影響
由圖2可知,百香果皮果膠質量濃度與果膠凝膠的形成密切相關。百香果皮果膠添加量為24 g/L時,樣品的持水性和凝膠強度分別達到了85.6%和921 g·mm,是質量濃度為4 g/L時的6.5倍和15倍。這可能由于低質量濃度時溶于水的果膠分子過于分散,形成的氫鍵作用力弱,因而形成的凝膠不穩定,凝膠性能較差。隨著質量濃度增大溶液中的羧基相應增多,從而增加三維晶型網狀結點數,增強氫鍵與疏水作用力,造成結構越致密及截留在網絡結構中水分子越多,故凝膠強度增大,持水性増強[25]。此外,試驗過程中發現當果膠質量濃度大于24 g/L后,凝膠變硬并出現輕微龜裂。
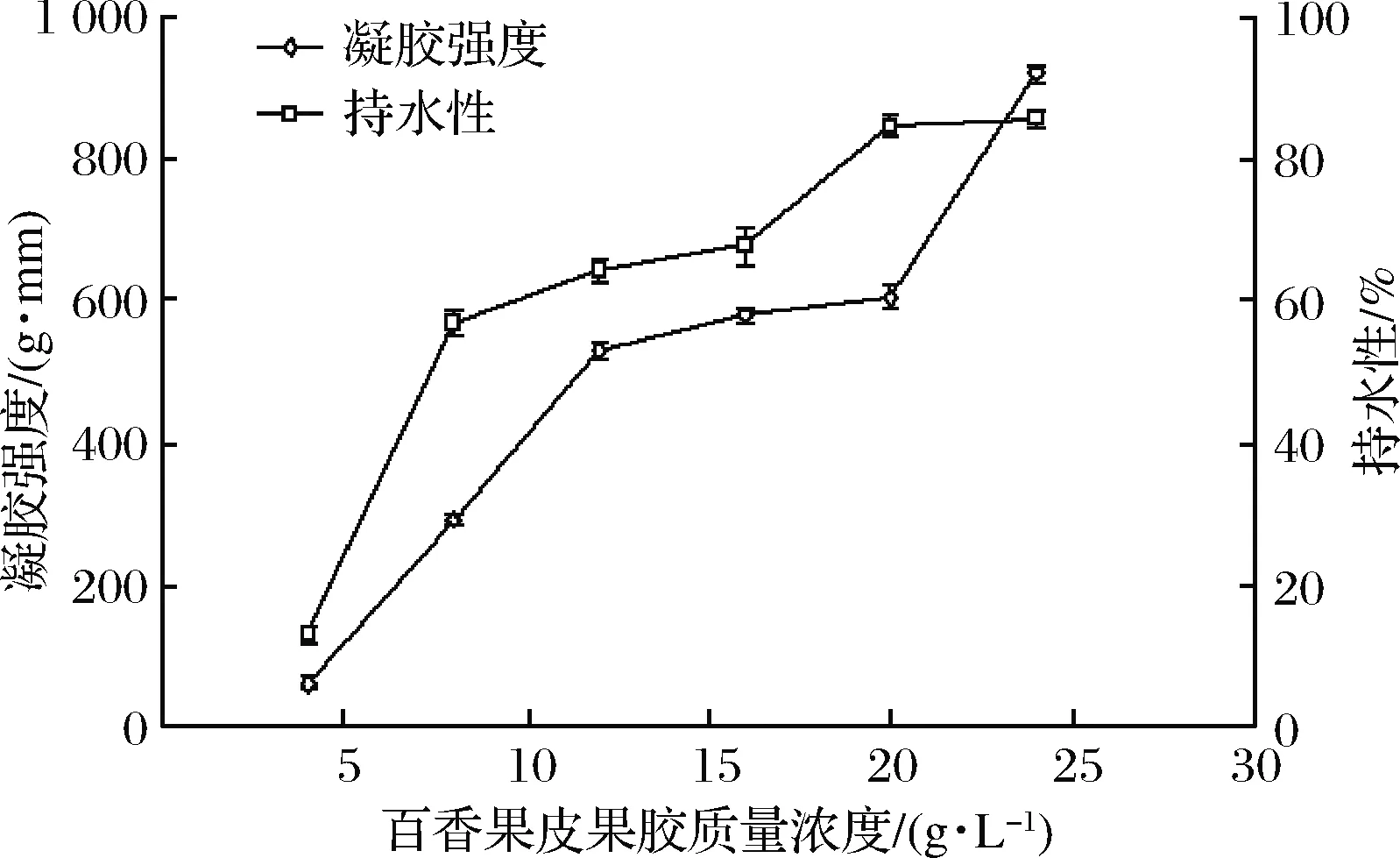
圖2 百香果皮果膠質量濃度對凝膠特性的影響
Fig.2 Influence of passion peel pectin concentration on gel properties
2.5.2 蔗糖質量濃度對百香果皮果膠凝膠特性的影響
如圖3所示,當蔗糖質量濃度小于600 g/L時,百香果皮果膠的凝膠強度和持水性都隨蔗糖的添加以較大幅度上升,當蔗糖質量濃度達到600 g/L時,百香果皮果膠的凝膠強度和持水性分別達到了838 g·mm和77.7%,是200 g/L時的5.5倍和3.9倍。這可能在蔗糖添加量小于600 g/L時,隨著質量濃度增大,蔗糖的醇羥基通過氫鍵和果膠分子鏈競爭結合水,使果膠分子之間彼此靠近聚集成長鏈膠束,形成三維結合區,故百香果皮果膠的凝膠強度和持水性增強。當蔗糖添加量大于600 g/L后,強度迅速降低至436 g·mm,其原因可能是因為蔗糖過量會增強蔗糖分子上的醇羥基通過氫鍵與果膠半乳糖醛酸殘基的甲氧基及未解離羧基作用,從而改變果膠分子的立體空間結構,最終導致凝膠變軟。同時由于蔗糖有親水作用會進一步爭奪果膠分子間的水分,且在離心力的作用下失去部分水分[26]。

圖3 蔗糖質量濃度對凝膠特性的影響
Fig.3 Influence of sucrose concentration on gel properties
2.5.3 溫度對百香果皮果膠凝膠特性的影響
由圖4可以看出在溫度小于70 ℃時隨著溫度的升高,百香果皮果膠的凝膠性能逐漸上升,分析可能是溫度升高果膠分子在溶劑中熱運動加劇,擴散速度加快,加速凝膠形成。70 ℃時百香果皮果膠的持水性和凝膠強度均達到最大,即為79.4%和852 g·mm。隨后降至41.6%和237 g·mm,其原因可能是在較高溫度下,果膠會發生β-脫酯作用,導致凝膠性能降低[5,27]。

圖4 溫度對果膠凝膠特性的影響
Fig.4 Influence of temperature on pectin gel properties
2.5.4 pH對百香果皮果膠凝膠特性的影響
由圖5可以看出,在pH低于2.0時,凝膠性能弱,可能是由于在強酸條件下,百香果皮果膠中酯鍵和蔗糖中糖苷鍵發生水解造成。當pH達到3.2時,百香果皮果膠的凝膠強度和持水性達到最大,分別是pH為2.0時的9倍和5倍,可能是由于pH在靠近等電點時可有效抑制體系中帶電荷的半乳糖醛酸羧基的電離,分子間靜電排斥力變小,使果膠分子相互纏繞形成一個穩定的三維晶型網絡結構并截留部分水所造成。當pH大于3.2后,可能是由于此時H+質量濃度下降,導致氫鍵減少,與游離羧基結合下降,羧基過多使分子間排斥力增大,從而造成凝膠性能下降[25,27]。
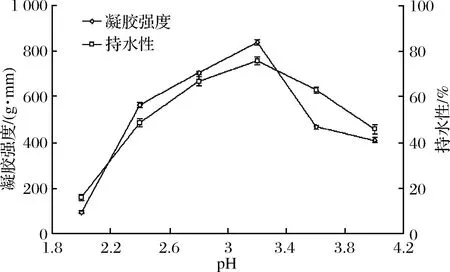
圖5 pH對果膠凝膠特性的影響
Fig.5 Influence of pH on pectin gel properties
2.5.5 金屬離子對百香果皮果膠凝膠特性的影響
金屬離子對百香果皮果膠的凝膠強度和持水性造成的影響如圖6所示。由圖6可以看出,添加Fe3+和Al3+對兩者所造成的影響差異不顯著,當添加Mg2+時,與空白組相比減弱了百香果皮果膠的凝膠性能。添加Ca2+時,百香果皮果膠的凝膠強度和持水性分別為768 g·mm和63.7%,是空白組(未添加金屬離子)的2.3倍和1.3倍。Cu2+的添加同樣對凝膠強度有顯著提高為空白組時的2.1倍,持水性為空白組時的1.4倍。其原因可能是果膠凝膠的形成對金屬離子類型存在一定的選擇性,Ca2+和Cu2+與游離羧基螯合更充分,減少了果膠分子周圍的負電荷,改變果膠分子的聚集狀態,從而使百香果皮果膠的凝膠特性變好。而Mg2+可能是因為其離子半徑過小,不能與果膠形成穩定的橋梁,故減弱了果膠凝膠特性[28]。

圖6 金屬離子對果膠凝膠特性的影響
Fig.6 Influence of metalions on pectin gel properties
3 結論
果膠特性是評價果膠用途的一個重要指標,而酯化程度決定其凝膠強度,高酯果膠和低酯果膠因酯化度不同造成凝膠形成機制完全不同。高酯果膠的凝膠過程也叫氫鍵凝膠形成,主要通過甲酯基團和氫鍵之間的疏水鍵相互作用,其凝膠條件為高糖低酸即蔗糖質量濃度為(580~750) g/L和pH值為2.8~3.5,冷卻后形成非可逆性凝膠[29]。本實驗對百香果皮果膠的干燥失重、灰分含量、酸不溶性灰分等理化指標進行測定,并結合傅里葉紅外光譜、質構特性和凝膠特性進行直觀說明。主要結論如下:
(1)百香果皮果膠各項理化指標:干燥失重(9.62±0.39)%、灰分含量(4.17±0.72)%、酸不溶性灰分(0.97±0.05)%、溶解度(85.95±0.70)%、半乳糖醛酸含量(81.99±1.54)%、酯化度(66.46±0.41)%,均符合國家標準要求。與商品柑橘果膠相比,顏色較深,呈黃褐色。
(2)百香果皮果膠的傅里葉紅外光譜:表明具有糖類的特征吸收峰,即果膠吸收峰,也證實其為高酯果膠。
(3)百香果皮果膠的質構特性:添加百香果皮果膠后膠著性有所下降,硬度、彈性和咀嚼性均有明顯的提高。
(4)百香果皮果膠的凝膠特性:與百香果皮果膠質量濃度成正相關,隨溫度升高,蔗糖質量濃度和pH值的增大其凝膠強度和持水性均呈現先增大后減小的趨勢,當果膠質量濃度為24 g/L、蔗糖添加量為60%、溫度70 ℃、pH 3.2時,果膠的凝膠性能最佳。在凝膠過程中添加二價Ca2+、Cu2+可提高百香果皮果膠的凝膠特性。
本文對百香果皮果膠的相關理化和凝膠特性進行了一定程度的研究,但由于本研究所用果膠為粗品,可能會對果膠的質量和理化性質等造成一定程度影響,后續可進一步對果膠進行純化并采用高效液相色譜、流變儀、掃描電鏡和低場核磁等儀器測定和觀察其分子量、單糖組成、流變模型及內部微觀結構,為凝膠特性的機理提供理論依據。

