肉雞和藏雞肺動脈平滑肌中CaSR的表達
李善政 郭銳 陳永旭 鮑鈺瑩 王佳杰 常振宇
摘要:肉雞肺動脈高壓是以肺動脈壓血管重構為特征的一種疾病,眾多研究揭示肺血管重構是其中心環節之一。細胞內鈣離子([Ca2+])濃度的升高是誘發并導致血管重構的重要機制,鈣敏感受體(CaSR)在肺動脈平滑肌細胞內鈣離子穩態失調及低氧性肺血管收縮和肺血管重構中起著重要的作用。應用免疫組化和Western blot方法研究了缺氧條件下CaSR在AA肉雞和藏雞肺動脈平滑肌組織中的表達情況,為肉雞腹水綜合征(PAH)的肺動脈重構提供新的證據。結果表明,肉雞組有肺水腫發生,藏雞組無肺水腫發生,缺氧條件下飼養的肉雞肺動脈平滑肌CaSR表達明顯高于藏雞組(P<0.05)。通過探討CaSR在AA肉雞和藏雞肺動脈平滑肌組織中的表達情況,從新的角度闡明了肉雞腹水綜合征發生的分子機制。
關鍵詞:肉雞;藏雞;肺動脈平滑肌;鈣敏感受體(CaSR)
中圖分類號:S858.31? ? ? ? 文獻標識碼:A? ? ? ? 文章編號:1007-273X(2020)04-0005-03
肉雞肺動脈高壓(PAH) 綜合征,也稱肉雞腹水綜合征,是家禽發生的以一種缺氧、不愿運動、腹部膨大和肺動脈壓力升高及右心衰竭為特點的疾病或綜合征。目前公認發病機制為缺氧—血管重構—PAH—右心衰竭—右心容量負荷增加直至腹水死亡[1,2]。王建琳等[3]證實血管重構及PAH的形成是其發病的中心環節。肉雞PAH綜合征形成過程中具有血管重構這一特征,即血管壁厚度、管腔直徑的比值增加,血管內徑、外徑減小,而血管壁的橫截面積不變[4,5]。有證據表明鈣敏感受體(CaSR)介導了肺血管收縮和重構以及肉雞腹水綜合征發生的分子機制[6]。
鈣敏感受體(Calcium-sensing receptor,CaSR)是G蛋白耦聯受體的C家族成員。1993年,Brown等首次由牛甲狀旁腺克隆出CaSR。CaSR主要由胞內羧基尾部、氨基胞外域以及7個跨膜螺旋的跨膜域所組成[7]。CaSR主要分布在骨組織、血管、胃腸道、參與鈣穩態調節的甲狀旁腺及腎組織等。其功能主要是維持鈣離子和其他金屬離子的穩定狀態,并且能夠調節細胞增殖分化,控制離子通道的開啟和激素分泌等[8]。本研究通過比較肉雞和藏雞在高原缺氧條件下肺水腫發生率、CaSR表達差異兩個方面來闡述腹水綜合征發生的分子機制。
1? 材料與方法
1.1? 實驗動物分組
7 日齡健康白羽肉仔雞50只購于宜昌某正大孵化廠(由飛機運往林芝);7日齡健康藏仔雞50只購于拉薩某商業孵化廠。白羽肉仔雞和藏雞在西藏農牧學院畜牧場按常規飼養條件進行飼養。
1.2? 主要儀器與試劑
高速冷凍離心機(3K15,Sigma);RM-2245型萊卡組織切片機;Olympus光學顯微鏡;CaSR抗體;TBS濃縮緩沖液、中性樹膠、水楊酸甲酯、二甲苯、福爾馬林、PVDF 膜、顯影定影試劑、轉移緩沖液、電泳緩沖液。
1.3? 免疫組化檢測CaSR
肉雞和藏雞肺動脈平滑肌組織經包埋切片后,3%H2O2溶液避光室溫條件下作用30 min,修復緩沖液進行抗原修復,3%TBST封閉,分別滴加兔抗鼠CaSR 抗體(1∶100,一抗)、山羊抗兔 HRP-IgG(二抗),孵育,按說明書進行二氨基聯苯胺法顯色操作,蘇木素染液復染2 min、梯度乙醇脫水、透明和封片(用PBS緩沖液替代一抗作陰性對照),用Olympus光學顯微鏡進行觀察并拍照。
1.4? Western blot檢測CaSR蛋白的表達
將肉雞和藏雞肺動脈平滑肌組織裂解,勻漿并提取肺動脈平滑肌總蛋白,用BCA試劑盒測定其蛋白濃度和含量。SDS-PAGE、考馬斯亮蘭染色確定各樣品總蛋白含量,將蛋白轉印至聚偏二氟乙烯膜上,5%脫脂牛奶封閉1 h。加兔抗鼠CaSR抗體(1∶500,一抗),4 ℃孵育過夜,室溫下TBST脫色搖床上洗3次,每次5 min;山羊抗兔HRP-IgG(二抗)用TBST稀釋3 000 倍,室溫下孵育30 min,用TBST在室溫下脫色、搖床上洗3次,每次5 min。內參是GAPDH(1∶10 000),顯色后凝膠成像系統拍攝。應用光密度法測定目標蛋白豐度。使用SPSS 17.0軟件對所得灰度值進行分析,并用Graph pad prism 5.0軟件作圖。
2? 結果與分析
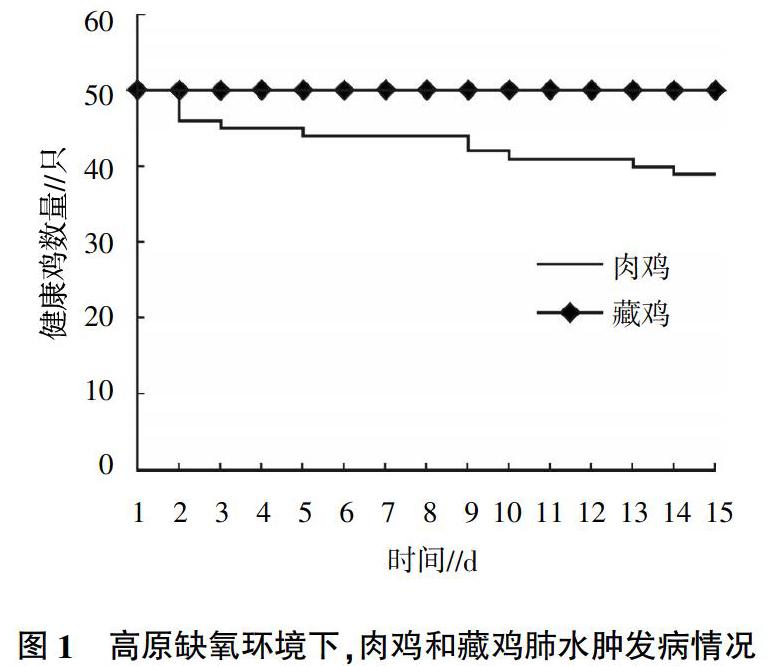
2.1? 肉雞和藏雞肺水腫發病情況
由圖1可知,在高原缺氧環境下,從第2天起,肉雞開始出現肺水腫,并呈現增高的趨勢,截至第15天,共有11只肉雞出現肺水腫情況,其發病率為22%。藏雞從飼養開始到結束無肺水腫發生,發病率為0。
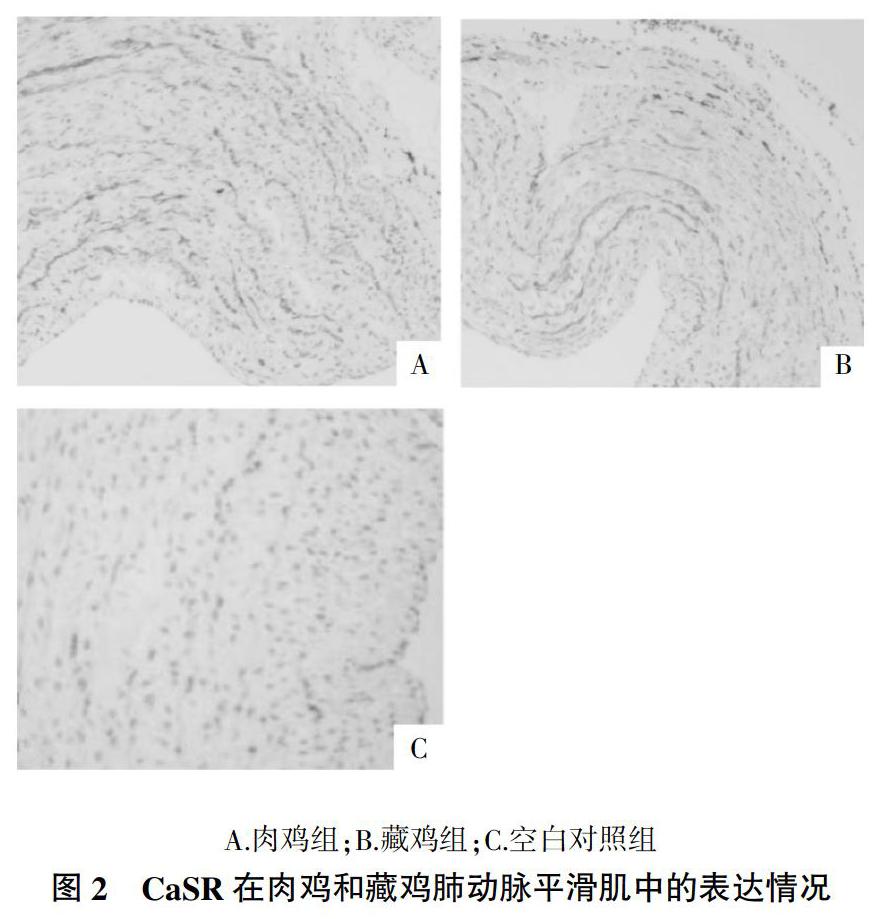
2.2? CaSR免疫組化結果
免疫組化結果(圖2)表明,與肉雞組(圖2A)肺動脈平滑肌組織比較,藏雞組肺動脈平滑肌組織有弱陽性表達,顏色較淺(圖2B)。陰性對照組(不加一抗)則無陽性反應顯色(圖2C)。
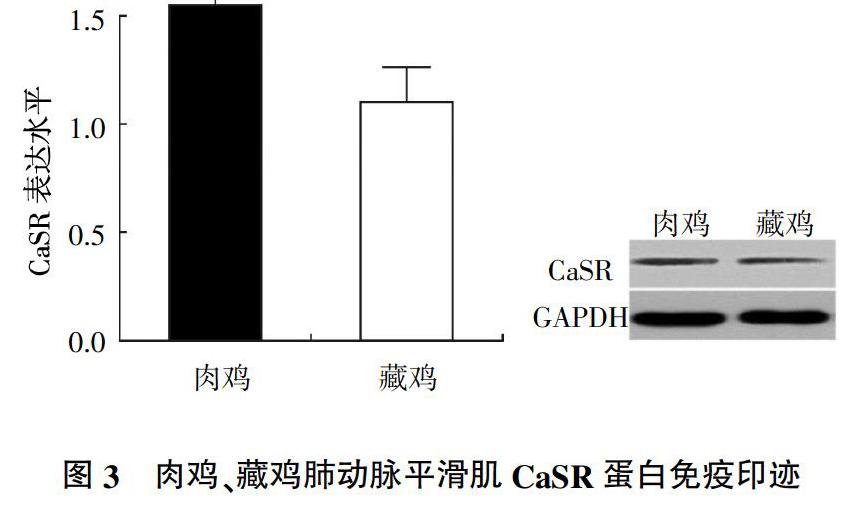
2.3? Western blot 檢測CaSR蛋白的表達
免疫印跡結果(圖3)表明,與肉雞組比較,藏雞組肺動脈平滑肌組織CaSR蛋白水平顯著降低(P<0.05)。
3? 討論
肉雞肺動脈高壓是以肺動脈壓血管重構為特征的一組疾病,且眾多研究揭示肺血管重構是其中心環節之一。研究證實,CaSR在肺血管重構和低氧性肺血管收縮以及維持肺動脈平滑肌細胞內鈣離子穩定狀態均發揮著至關重要的作用[9]。Tfelt-Hansen等[10]發現CaSR 在新生大鼠心室肌細胞有功能性表達。試驗表明,CaSR在血管重構的內皮細胞和平滑肌也有功能性表達。有研究發現,鈣離子超載主要是由于CaSR激活G蛋白-PLC-IP3途徑,從而導致細胞內鈣離子增多;在慢性缺氧期間由瞬時受體電位基因編碼的鈣庫操縱的陽離子通道和受體操縱的陽離子通道在肺動脈平滑肌中上調,從而認為這可能是導致肉雞腹水綜合征發生的新途徑[11]。Molostvov等[12]、Li等[13]發現大鼠肺動脈平滑肌缺氧時有CaSR 的功能表達,并可調節血管內皮細胞增殖和血管緊張度。Ziegelstein等[14]在培養的人主動脈內皮細胞(Human aortic endothelial cell)時運用蛋白質印跡法(Western blot)和熒光免疫法證明了CaSR的存在,通過RT-PCR方法獲得了CaSR的預期產物。Ohanian等[15]證實,大鼠皮下動脈存在CaSR的功能表達,后者參與肌張力調節,進而參與外周血管阻力的調節。研究表明,CaSR激動劑可導致細胞內鈣離子增加,主動脈內皮細胞轉染特異性靶向CaSR的siRNA、NO及細胞內鈣離子濃度產生均會缺失或減少,但是細胞內鈣離子濃度的增高為誘發血管重構的重要機制之一,在缺氧條件下其增高機制尚未了解。王關嵩等[16]認為慢性缺氧時細胞內靜息鈣離子濃度顯著增加,這可能與缺氧誘導的膜靜息電位變化有關,從而引起電壓門控鈣離子通道活性的改變、鈣通道開放和鈣離子內流。膜靜息電位在細胞內鈣離子濃度的調節中發揮著至關重要的作用,如果細胞內鈣離子濃度增高,則可以導致細胞增殖、收縮和基因表達等變化。
對于低氧性肺動脈高壓導致的肉雞腹水綜合征發病機制,肺血管重構、收縮被普遍認為是導致肉雞腹水綜合征發病的病理學和生理學基礎[17]。試驗結果表明,CaSR可調節細胞增殖、分化、離子通道開啟等,缺氧激活血管CaSR表達增加,CaSR表達增加是血管重構的啟始階段,因而是肺動脈高壓形成和血管平滑肌增殖的上游調控因子。盡管肉雞肺動脈高壓綜合征的發病原因各不相同,動物機體的器官形態功能和體內生化指標改變多樣,但都具有呼吸困難和肺動脈高壓的臨床特征和血管重構等病理學特征,由此我們有理由假設其發病機制:肉雞快速增長—心肺發育滯后—心肺功能不全—缺氧—激活血管CaSR表達—啟動血管重構—血管壁增厚—進一步缺氧—右心衰竭—腹水形成,Julian等[18]在1987年首次提出此假說。CaSR介導了血管重構并促進PAH的形成,亦證實低氧條件下培養可誘導細胞增殖反應,研究表明低氧是導致肺血管重構和PAH發生的重要原因。本假說如果成立,研究CaSR在PAH肉雞血管重構中的作用將具有重要意義[19]。
4? 結論
本研究首次證明了藏雞和肉雞肺動脈平滑肌組織中有CaSR的表達。通過本試驗確定并掌握了CaSR在白羽肉雞和藏雞肺動脈平滑肌組織中的表達情況,為闡明肉雞腹水綜合征的肺動脈重構提供了新的科學證據。免疫組化和Western blot結果表明,肉雞肺動脈平滑肌CaSR表達明顯高于藏雞組,我們前期進行了肉雞常氧條件下飼養試驗[20],與本試驗中缺氧條件下肉雞CaSR表達進行比較,發現缺氧條件下肉雞CaSR表達量明顯高于常氧條件下CaSR表達量。本試驗通過研究缺氧條件下肉雞和藏雞CaSR表達差異,進而發現CaSR表達與雞的品種有關。
參考文獻:
[1] 楊慧萍,高? 睿.肉雞腹水綜合征的病理學研究[J].黑龍江畜牧獸醫,2018(1):160-162.
[2] 張? 彬,劉海濤,李鐵成.肉雞腹水綜合征的防制措施[J].現代農業,2018(2):85.
[3] 王建琳,喬? 健,趙立紅,等.低溫誘發肉雞腹水綜合征發生過程中肺血管重塑與肺動脈高壓的關系[J].中國獸醫學報,2007, 27(6):874-878.
[4] 劉健華,梁禮成,金久善.肺血管結構重建與肉雞肺動脈高壓形成的關系[J].畜牧獸醫學報,2003,34(5):515-520.
[5] WANG Y,GUO Y,NING D,et al. Changes of hepatic biochemical parameters and proteomics in broilers with cold-induced ascites[J].Anim Sci Biotechnol,2012,3(1):41.
[6] 潘家強,王小龍,唐兆新,等.早期限飼對低溫所致肉雞肺血管重構的影響[J].南京農業大學學報,2008,31(4):124-128.
[7] WANG R,XU C Q,ZHAO W M,et al. Calcium and polyamine regulated calcium-sensing receptors in cardiac tissues[J].Eur J Biochem,2003,270:2680-2688.
[8] SANELA S,JAKOB L H,TUE E H,et al. Extracellular calcium sensing in rat aortic vascular smooth muscle cells[J].Biochemical and biophysical research communications,2006,348:1215-1223.
[9] 王建琳,尹燕博,喬? 健.環境低溫對肉雞肺小動脈壁c-myc mRNA表達的影響[J].中國獸醫學報,2011,31(1):103-106.
[10] TFELT-HANSEN J,BROWN E M. The calcium-sensing receptor in normal physiology and pathophysiology:a review[J].Crit Rev Clin Lab Sci,2005,42:35-70
[11] LIN M J,GEORGE P H L,ZHANG W M. Chronic hypoxia-induced upregulation of store-operated and receptor-operated Ca2+ channels in pulmonary arterial smooth muscle cells-a novel mechanism of hypoxic pulmonary hypertension[J].Circ Res,2004,95:496-505
[12] MOLOSTVOV G,BLAND R,ZEHNDER D. Expression and role of the calcium-sensing receptor in the blood vessel wall[J].Current pharmaceutical biotechnology,2009,10:282-288
[13] LI G W,WANG Q S,HAO J H. The functional expression of extracellular calcium-sensing receptor in rat pulmonary artery smooth muscle cells[J].Journal of biomedical science,2011, 18(1):16.
[14] ZIEGELSTEIN R C,CORDA S,PILI R,et al. Initial contact and subsequent adhesion of human neutrophils or monocytes to human aortic endothelial cells releases an endothelial intracellular calcium store[J].Circulation,1994,90(4):1899-1907.
[15] OHANIAN J,GATFIELD K M,WARD D T,et al. Evidence for a functional calciumsensing receptor that modulates myogenic tone in rat subcutaneous small arteries[J].Ajp heart & circulatory physiology,2005,288(4):H1756-1762.
[16] 王關嵩,錢桂生.低氧肺血管重構的分子機制研究概況及展望[J].第三軍醫大學學報,2009,31(1):3-5.
[17] 袁雅冬,陳? 燁,王? 麗,等.2015年呼吸系統疾病研究進展[J].臨床薈萃,2016,31(2):143-150.
[18] JULIAN R J,FRIARS G W,FRENCH H,et al. The relationship of right ventricular hypertrophy,right ventricular failure,and ascites to weight gain in broiler and roaster chickens[J].Avian diseases,1987,31:130-135.
[19] FUCHS B,DIETRICH A,GUDERMANN T,et al. The role of classical transient receptor potential channels in the regulation of hypoxic pulmonary vasoconstriction[J].Adv Exp Med Biol,2010,661:187-200.
[20] ZHANG H,CHANG Z Y,MEHMOOD K,et al. Calcium-sensing receptor arbitrates hypoxia-induced proliferation of pulmonary artery smooth muscle cells via the G protein-PLC-IP3 pathway[J].Crit Rev Eukaryot Gene Expr,2019,29(1):69-76.

