植物生長調節劑對羅浮山黃精繁殖的影響
廖建良 周澤鑫

摘要:以黃精種子作為試驗材料,研究了不同植物生長調節劑浸種、浸種時間對黃精種子萌發的影響,以篩選適合黃精種子萌發的植物生長調節劑;用黃精的地下根莖作為組織培養的材料,以篩選出合適的培養基。結果表明,GA3、6-BA和IAA這3種植物生長調節劑都能對黃精種子的萌發起到明顯的促進作用。其中GA3對黃精種子萌發的促進作用要優于6-BA和IAA,在GA3質量濃度為150 mg/L,浸種時間為24 h時,其發芽率與發芽勢最大,分別為 90.00%、64.67%。24 h的浸種效果要優于12 h。在黃精植物組織培養中,最佳的消毒滅菌方式為先用75%乙醇溶液浸泡15 s、后再用0.1% HgCl2溶液浸泡20 min。理想的芽分化誘導培養基為MS+3.0 mg/L 6-BA+0.5 mg/L IAA、MS+3.0 mg/L 6-BA+0.5 mg/L IBA。最優的增殖培養基為MS+4.0 mg/L 6-BA+0.2 mg/L IAA,增殖系數達到 2.1,且不定芽長勢良好。
關鍵詞:黃精;植物生長調節劑;快速繁殖;組織培養
中圖分類號:S567.23+9.043 ??文獻標志碼: A ?文章編號:1002-1302(2020)10-0168-05
收稿日期:2019-03-26
基金項目:廣東省科技計劃(編號:2017A020213031);惠州市科技項目(編號:2016X0427042);惠州學院植物學課程群優秀教學團隊(編號:TD2016003);廣東省植物學精品共享課程[編號:粵高校(2017)24號];惠州學院項目(編號:hzu201703)。
作者簡介:廖建良(1965—),男,廣東紫金人,碩士,教授,研究方向為藥用植物學。E-mail:chxnljl@163.com。
黃精為百合科(Liliaceae)黃精屬(Polygonatum)多年生草本植物,具有藥用、食用、觀賞和美容等價值。黃精的種類很多,按形狀不同,可分別為“大黃精”“雞頭黃精”“姜形黃精”。黃精主要含多糖、低聚糖、黃酮、蒽醌、皂苷、木脂素等化合物,以其根莖入藥,性平、味甘,為滋補上品,具有滋陰潤燥、補腎益精、降血脂、降血糖、降血壓、提高人體免疫力、抗衰老等功效[1-5]。因此,在研制新藥和開發保健品等方面黃精具有廣闊前景。由于人們對黃精的需求日益增加,野生黃精資源已遠不能滿足當今生產需要,人工規模化種植成為黃精資源獲得的發展趨勢。黃精的繁殖方式為有性繁殖(種子繁殖)和無性繁殖(根莖繁殖)2種[6-7],但其種子成熟后具較長的休眠期,且種子在自然條件下發芽率極低,播種后第1年出苗率也低,從播種到收成的生長歷程長達5~6年,黃精生長緩慢,藥材稀缺,黃精市場需求量日益增加[8-9]。而植物生長調節劑能打破種子休眠期,促進種子活性,提高種子發芽率等,植物生長調節劑具有較強的針對性,很少的量就能達到明顯的效果[10-16]。目前植物生長調節劑應用于黃精繁殖的報道鮮少,所以本試驗主要探討植物生長調節劑對黃精萌發的促進作用,找出適合廣東省惠州栽培黃精的最適濃度和浸種時間,以黃精根莖為組培材料,研究其組培過程中適合的培養基與合適的消毒方法。
1 材料與方法
1.1 試驗材料、試驗地點和時間
從廣東省惠州市羅浮山基地采集黃精果實和黃精苗,果實去除果皮,將新鮮的種子清洗干凈并在室內陰涼處曬干水分,黃精苗移栽至大棚。研究地點在廣東省惠州市博羅石灣農業推廣中心組培室及大棚,試驗時間為2017年7月至2018年5月。
1.2 試驗方法
1.2.1 種子處理試驗
1.2.1.1 不同植物生長調節劑處理 選取顆粒飽滿的黃精種子分別浸泡在50、100、150、200 mg/L的IAA(吲哚乙酸)、GA3(赤霉素)、6-BA(6-芐氨基嘌呤)溶液中,分別處理12、24 h,再用蒸餾水漂洗 5 min 后,將其均勻置于墊有2層充分吸濕濾紙的培養皿中,于25 ℃的培養箱和黑暗條件下進行發芽培養,每個處理50粒種子,3次重復。
1.2.1.2 對照組處理 清水浸泡種子12、24 h做對照試驗,置于墊有2層充分吸濕濾紙的培養皿中,于25 ℃的培養箱中在黑暗條件下進行發芽培養,每個處理50粒,3次重復。
1.2.1.3 發芽數據統計 種子萌發試驗在25 ℃的培養箱中在無光條件下進行,試驗期間每天觀察種子發芽情況,以60 d為種子發芽期限,30 d統計發芽勢,60 d時所得數據為最終的發芽率,胚根突破種皮即可視為發芽。
發芽率=60 d時種子總發芽數/總體種子數×100%;
發芽勢=30 d時種子總發芽數/總體種子數×100%。
1.2.2 黃精組培試驗
1.2.2.1 不同消毒處理下的滅菌效果 切去健康黃精苗的葉片和根系,將黃精根莖中帶有小芽的那部分切下,放入錐形瓶中。在流水條件下用牙刷將其帶芽根莖上的雜質刷洗干凈,后放入含有洗衣粉的水中浸泡10 min,再流水沖洗30 min。轉移至超凈工作臺,并盡可能剃除其表面的黑斑。用75%乙醇溶液浸泡消毒15、30 s,接著用無菌水沖洗3次,每次3 min,再用0.1% HgCl2溶液深入滅菌10、15、20 min。在無菌水中不斷晃洗3次,每次 3 min。將滅完菌的黃精根莖置于無菌培養皿中,再切去其與乙醇以及0.1% HgCl2接觸的傷口和塊莖上已壞死的組織,將其接種于MS培養基中,每瓶接種1個外植體,每個處理5瓶,重復3次,20 d后統計其污染率。
1.2.2.2 不同植物生長調節劑組合對黃精不定芽的誘導效果 將黃精外植體按照最佳效果進行滅菌處理后,將其移至5種不同誘導培養基中,每瓶 1~2個芽,每個處理10瓶,10個芽為1個重復,重復3次,進行誘導培養、觀察,30 d后統計其誘導情況。
誘導率=誘導出的芽個數/接種的外植體數×100%。
1.2.2.3 不同植物生長調節劑對黃精不定芽增殖的影響 待誘導培養基中誘導出不定芽且不定芽的數量足夠后,將含有分化出不定芽的塊莖切去芽苗,并切成1 cm3左右的小塊,接入不同激素組合的增殖培養基中,每瓶1~2個芽,每個處理10瓶,10個芽為一個重復,重復3次,30 d后統計增殖情況。
增殖系數=(萌發總芽數-接種時的芽數)/接種時的芽數。
1.2.2.4 組織培養培養基及培養條件 以MS培養基為基本培養基,加入25 g/L的蔗糖、7 g/L的卡拉膠,再根據試驗的需求添加不同質量濃度的6-BA(6- 芐氨基嘌呤)、GA3(赤霉素)、NAA(萘乙酸)、IAA(吲哚乙酸)等激素,調節其pH值為5.8~6.0,配完后裝入培養瓶中,滅菌,滅菌條件為 121 ℃、131 kPa、20 min。滅菌完后將其放置于冷凝室降溫,當其溫度為室溫時可接種,材料接完后置于(溫度保持在25 ℃左右)恒溫培養室中培養,光照時間12 h/d,光照度2 100~2 500 lx。
2 結果與分析
2.1 不同質量濃度的GA3對黃精種子萌發的影響
從表1可以看出,浸種時間和GA3的質量濃度都對黃精種子的萌發有影響,并且浸種時間24 h的效果要優于12 h。隨著GA3質量濃度的增加,黃精種子的發芽率和發芽勢呈現出先升高后降低的趨勢。GA3質量濃度為0~150 mg/L時,隨著GA3質量濃度的增加,黃精種子的發芽率和發芽勢也隨之增大。當GA3質量濃度為150 mg/L且浸種時間為24 h時,黃精種子萌發的發芽率與發芽勢最大,分別為90.00%、64.67%。超過150 mg/L后,GA3對其萌發的促進作用隨質量濃度的增加而降低,但依舊高于CK組。總之,在0~200 mg/L之間,對比CK組,GA3對黃精的萌發具有明顯的促進作用。
2.2 不同質量濃度的6-BA對黃精種子萌發的影響
由表2可知,6-BA對黃精種子的萌發也具有促進作用,并且不同質量濃度和不同的浸種時間對其萌發的影響都不同,總體上看,浸種時間24 h的效果要優于12 h。隨著質量濃度的升高,黃精種子的發芽率和發芽勢呈現一個先增加后減少的趨勢。6-BA質量濃度為0~100 mg/L時,隨著6-BA質量濃度的增加,黃精種子的發芽率和發芽勢也隨之增大。在6-BA的質量濃度達到100 mg/L、浸種時間為24 h時,黃精種子的發芽率和發芽勢最大,分別為84.67%、60.67%。當質量濃度超過100 mg/L后,6-BA對其萌發的促進作用隨質量濃度的增加而降低,但依舊高于CK組。
2.3 不同質量濃度的IAA對黃精種子萌發的影響
由表3可知,IAA對黃精種子的萌發也具備一定的促進作用,并且不同質量濃度和不同浸種時間對其萌發的影響都不同。隨著質量濃度的升高,黃精種子的發芽率和發芽勢呈現一個先增加后減少的趨勢。IAA質量濃度為0~100 mg/L時,隨著IAA質量濃度的增加,黃精種子的發芽率和發芽勢也隨之增大。在IAA質量濃度達到100 mg/L時,黃精種子的發芽率和發芽勢最大,分別為80.67%、56.67%。當質量濃度超過100 mg/L后,IAA對其萌發的促進作用反而隨質量濃度的增加而降低,并且在200 mg/L時,與對照組差異不大。IAA對黃精種子萌發的促進作用較明顯。
2.4 不同消毒處理對黃精外植體的滅菌效果
由表4可知,0.1% HgCl2溶液浸泡時間越久,污染率越低,外植體的存活率也越高。0.1% HgCl2溶液浸泡時間為10 min、75%乙醇溶液為15 s時,污染率最高,為53.3%左右,而0.1% HgCl2溶液浸泡時間為10 min、75%乙醇溶液為30 s時,存活率最低,為33.3%左右。隨著75%乙醇溶液時間的增加,存活率不具有明顯增加的趨勢。從表4的5組處理中,處理3的效果最佳,因此,選擇其為最佳的消毒滅菌方式。
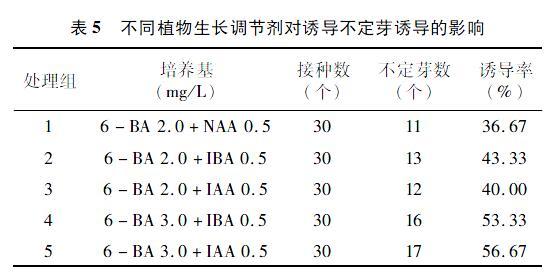
2.5 不同植物生長調節劑對誘導不定芽的影響
由表5可知,NAA、IBA、IBA這3種植物生長調節劑均可誘導芽的萌發,其中IAA和IBA的效果差異不大,出芽個數大致相同。在6-BA均為2 mg/L時,6-BA與IBA組合的誘導率和6-BA與IAA組合的誘導率高于6-BA與NAA組合的誘導率,所以IAA 0.5 mg/L和IBA 0.5 mg/L均適合黃精不定芽的誘導。隨著6-BA質量濃度的增加,不定芽的個數明顯增加,可看出3 mg/L的6-BA比2 mg/L的 6-BA在試驗中誘導不定芽的個數更多,也就是在一定范圍內,6-BA質量濃度的增加有利于黃精誘導出更多不定芽。因此,MS+3.0 mg/L 6-BA+0.5 mg/L IAA、MS+3.0 mg/L 6-BA+0.5 mg/L IBA均可作為黃精的誘導培養基。
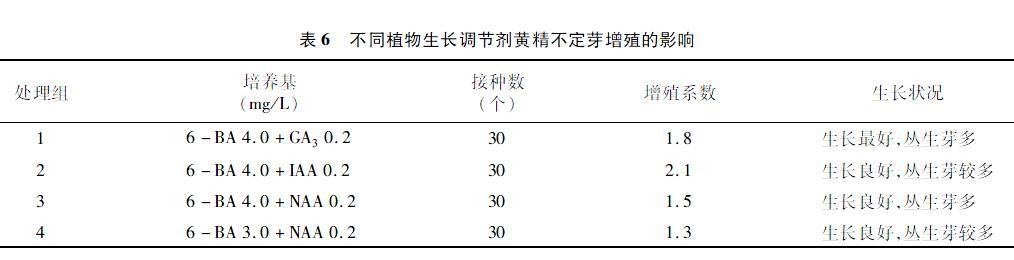
2.6 不同植物生長調節劑黃精不定芽增殖的影響
由表6可知,4種不同植物生長調節劑配比的培養基增殖產生的不定芽生長狀況均不錯,其中 4.0 mg/L 6-BA+0.2 mg/L GA3的培養基生長狀況最好, 但其增殖系數在6-BA質量濃度相同的情況下不是最高,由此可看出GA3有利于不定芽的生長,對不定芽的分化增殖效果也不低,但并不是最佳培養基。對比前3個處理組,4.0 mg/L 6-BA+0.2 mg/L IAA培養基的效果最佳,而NAA的效果最差,因此,適宜的增殖培養基為MS+4.0 mg/L 6-BA+0.2 mg/L IAA。在6-BA質量濃度相同時,IAA的增殖系數最大,效果最好,IAA對黃精不定芽的增殖效果要優于GA3和NAA。從表現性狀上看,高質量濃度的6-BA對黃精不定芽分化起著很重要的作用。
3 結論與討論

