參芪扶正注射液通過下調MMP-2表達抑制口腔鱗狀細胞癌轉移
張樂琪, 譚蕾, 羅晶, 鄧春妮, 劉治
(西安交通大學第一附屬醫院口腔科,陜西西安 710061)
口腔鱗狀細胞癌(oral squamous cell carcinoma,OSCC)是指發生于口腔內以鱗狀細胞為主的惡性腫瘤,具有高復發率和高頻率淋巴結轉移的特點[1]。盡管手術、化療和靶向治療取得了較大的進展,但由于其易遠處轉移,OSCC仍有很高的復發率[2]。因此,減少OSCC的轉移是治療OSCC和改善患者預后的有效策略。參芪扶正注射液是由傳統中藥材黨參和黃芪為主要原料,提取分離總皂苷和黃芪甲苷等主要有效成分精制而成的中藥注射液,具有益氣養陰、扶正固本的功效[3]。既往藥理學研究表明,參芪扶正注射液在臨床上常作為腫瘤治療的輔助藥物,具增加腫瘤抑制的作用,并能減輕各種毒副反應[4-5]。故本研究觀察參芪扶正注射液對OSCC的治療作用及其對OSCC遠處轉移的影響,以期為臨床治療OSCC提供實驗依據。現將研究結果報道如下。
1 材料與方法
1.1細胞來源及培養人口腔鱗狀細胞癌SCC-25細胞,購自上海匹拓生物科技有限公司。SCC-25細胞在37℃、體積分數為5%的CO2培養箱中,以含有體積分數為10%胎牛血清的RPMI-1640培養基培養。
1.2動物來源及飼養40只SPF級3~4周齡雌性BALB/c-nu/nu裸鼠,體質量16~22 g,購自四川夏派森醫藥科技有限公司,動物質量合格證號:SYXK(川)2017-203。飼養在西安交通大學第一附屬醫院中心實驗室,溫度控制在25℃左右、濕度在50%左右,裸鼠在實驗前均予普通飼料適應性喂養1周。
1.3藥物、試劑與儀器參芪扶正注射液(麗珠集團利民制藥廠,批號:國藥準字Z19990065);順鉑(浙江聯碩生物科技有限公司,批號:PHR1624)。RPMI-1640培養液(上海栩冉生物科技有限公司);RIPA裂解緩沖液(南京海克爾生物科技有限公司);二喹啉甲酸(BCA)試劑盒(上海易色醫療科技有限公司);基質金屬蛋白酶2(MMP2)抗體、細胞外信號調節激酶(ERK)抗體、磷酸化ERK(p-ERK)抗體(英國Abcam公司);c-Raf抗體(上海博研生物科技有限公司);p-c-Raf抗體(上海邦景實業有限公司);絲裂原激活蛋白激酶激酶(MEK)抗體(康朗生物有限公司);磷酸化MEK(p-MEK)抗體(南京厚百電子商務有限公司);pc-MMP2質粒(上海生物工程有限公司);Lipofectamine 2000轉染試劑(上海恪敏生物科技有限公司);QIAzol裂解試劑(北京鴻躍創新科技有限公司);cDNA逆轉錄試劑盒(上海捷瑞生物工程有限公司)。Elx800酶標儀(美國Biotek公司);DYCZ-40G型轉印電泳儀(北京六一儀器廠);FluorChem HD2凝膠成像系統(美國Proteinsimple公司)。
1.4體外實驗
1.4.1 應用四甲基偶氮唑鹽(MTT)法觀察參芪扶正注射液的細胞毒性 將SCC-25細胞接種到24孔板上,用0~80μg·mL-1參芪扶正注射液37℃處理24 h。再用磷酸鹽緩沖液(PBS)洗滌細胞,加MTT 0.5 g·L-1溫育4 h后,每孔加入150μL二甲基亞砜(DMSO)在搖床低速振蕩10 min,應用分光光度法于570 nm波光處測定吸光度。
1.4.2 細胞分組及處理 ①實驗1:設置空白對照組,順鉑組,參芪扶正低、中、高劑量組。其中:空白對照組SCC-25細胞正常培養;順鉑組用含有40μg·mL-1順鉑的培養基培養[6];參芪扶正低、中、高劑量組分別用含有10、20、40μg·mL-1參芪扶正注射液的培養基培養[6]。②實驗2:設置空白對照組、參芪扶正高劑量組、MMP2高表達組、MMP2+參芪扶正組。其中:空白對照組和參芪扶正高劑量組處理同“實驗1”;MMP2高表達組應用LipofectamineTM2000試劑將pc-MMP2質粒轉染至SCC-25細胞,以正常培養基培養;MMP2+參芪扶正組應用LipofectamineTM2000試劑將pc-MMP2質粒轉染至SCC-25細胞,用含有40μg·mL-1參芪扶正注射液的培養基培養。
1.4.3 劃痕實驗測定細胞遷移情況 細胞鋪滿單層后用小號槍頭垂直劃痕,加入無血清培養基,在體積分數5%CO2、37℃恒溫的培養箱中培養24 h后,在顯微鏡下拍照,用Image J軟件分析。
1.4.4 Transwell實驗測定細胞侵襲情況 培養48 h后,將細胞消化成單細胞,并配成5×104個/mL濃度的不含血清的懸液。在用Matrigel包被的Transwell小室上室加入該細胞懸液,下室加入含有體積分數10%胎牛血清的DMEM細胞培養。孵育24 h后,除去膜上層細胞,將通過膜侵襲的細胞固定染色,每組隨機選取5個視野,在顯微鏡下觀察。細胞侵入情況以每視野的平均細胞數表示。
1.4.5 蛋白免疫印跡(Western Blot)法檢測細胞MMP2/β-actin、 p-c-Raf/c-Raf、 p-MEK/MEK、p-ERK/ERK蛋白相對表達水平 用RIPA裂解液提取細胞總蛋白,并用BCA試劑盒檢測總蛋白濃度。經十二烷基硫酸鈉—聚丙烯酰氨凝膠電泳(SDS-PAGE)分離蛋白后,用半干轉膜儀轉移蛋白質至聚偏氟乙烯(PVDF)膜。以脫脂牛奶室溫封閉2 h后,加入一抗(分別為MMP2 1∶500、β-actin 1∶1 000、 p-c-Raf 1∶1 000、 c-Raf 1∶1 000、p-MEK 1∶500、 MEK 1∶500 、 p-ERK 1∶1 000、ERK 1∶1 000稀釋)4℃過夜。再加入對應二抗室溫封閉1 h。TBST洗脫后,使用電化學發光(ECL)暗室曝光,X光片掃描,最后分析各條帶的灰度值。
1.5體內實驗
1.5.1 移植瘤實驗 將40只裸鼠隨機分為空白對照組、參芪扶正高劑量組、MMP2高表達組、MMP2+參芪扶正組,每組10只。各組裸鼠于右后肢腹側分別皮下注射0.2 mL的1×107個/mL對應組別培養24 h的SCC-25細胞。同時,參芪扶正高劑量組和MMP2+參芪扶正組裸鼠每天給予癌旁注射40 mg·kg-1·d-1參芪扶正注射液,空白對照組和MMP2高表達組裸鼠每天給予癌旁注射等量生理鹽水1次,連續21 d。期間,各組裸鼠均于SPF條件下正常喂食。第21天給藥后頸椎脫位法處死裸鼠,完整取出皮下移植瘤,測定移植瘤體積,電子天平稱質量。
1.5.2 免疫組織化學法檢測裸鼠移植瘤E-cadherin表達水平 裸鼠皮下移植瘤經常規體積分數10%中性甲醛溶液固定后,石蠟包埋切片,脫蠟水化。應用過氧化物酶阻斷內源性過氧化物酶活性,非免疫性動物血清阻斷非特異性反應。再分別加入鼠抗人E-cadherin抗體(1∶100稀釋),4℃過夜。然后,滴加生物素標記二抗,DAB顯色,蒸餾水沖洗,蘇木素復染,梯度酒精脫水,二甲苯透明。最后,封片觀察統計。免疫組織化學陽性細胞胞質為棕色著染,顯微鏡下隨機選取5個視野,每個視野陽性細胞比率=陽性細胞數/總細胞數×100%。
1.5.3 Western Blot法測定裸鼠移植瘤MMP2/β-actin、p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相對表達水平 操作方法同“1.4.5”項。
1.6統計方法采用SPSS21.0統計軟件進行數據分析,圖形使用GraphPad Prism 6.0構建。實驗數據以均數±標準差(-x±s)表示,數據呈正態分布,方差齊,2組比較采用t檢驗,檢驗標準為α=0.05(雙側),以P<0.05為差異有統計學意義。
2 結果
2.1不同濃度參芪扶正注射液的細胞毒性圖1結果顯示,0~40μg·mL-1參芪扶正注射液對SCC-25細胞的增殖活性無明顯毒性,50~80μg·mL-1參芪扶正注射液明顯降低口腔鱗狀細胞癌SCC-25細胞的增殖活性(P<0.05)。因此,選擇參芪扶正注射液0~40μg·mL-1濃度進行后續實驗。
2.2參芪扶正注射液對SCC-25細胞遷移、侵襲及MMP2、c-Raf/MEK/ERK通路的影響圖2-A、-B結果顯示:與空白對照組比較,參芪扶正中、高劑量組和順鉑組細胞遷移率、每視野侵襲細胞個數均降低(P<0.05或P<0.01)。表明參芪扶正注射液可抑制SCC-25細胞遷移、侵襲。
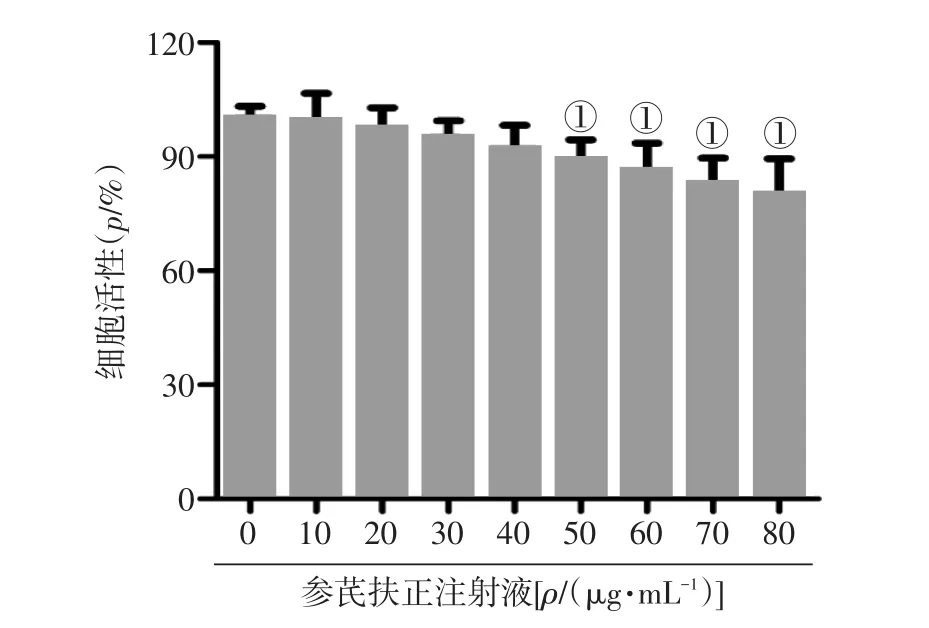
圖1 不同濃度參芪扶正注射液的細胞毒性Figure 1 The cytotoxicity of different concentrations of Shenqi Fuzheng Injection
圖2-C結果顯示,與空白對照組比較,參芪扶正中、高劑量組SCC-25細胞MMP2/β-actin蛋白相對表達量顯著降低(P<0.05或P<0.01),而順鉑組SCC-25細胞MMP2/β-actin蛋白相對表達量無顯著變化(P>0.05)。結果表明,參芪扶正注射液可抑制SCC-25細胞MMP2蛋白的表達,作用優于順鉑。
圖2-D結果顯示,與空白對照組比較,參芪扶正中、高劑量組SCC-25細胞p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相對表達量顯著降低(P<0.05或P<0.01),而順鉑組SCC-25細胞p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相對表達量無顯著變化(P>0.05)。結果表明,參芪扶正注射液可抑制SCC-25細胞c-Raf/MEK/ERK通路的激活,作用優于順鉑。
2.3參芪扶正注射液對MMP2高表達SCC-25細胞侵襲、遷移及c-Raf/MEK/ERK通路的影響圖3-A、-B結果顯示,與空白對照組比較,參芪扶正高劑量組細胞遷移率、每視野侵襲細胞數目顯著降低(P<0.01),MMP2高表達組細胞遷移率、每視野侵襲細胞數目明顯增加(P<0.05);與MMP2高表達組比較,MMP2+參芪扶正組細胞遷移率、每視野侵襲細胞數目明顯減少(P<0.01)。結果表明,參芪扶正注射液可通過抑制MMP2活性阻止SCC-25細胞遷移、侵襲。

圖2 參芪扶正注射液對SCC-25細胞遷移、侵襲及MMP2表達、c-Raf/MEK/ERK通路的影響Figure 2 The effects of Shenqi Fuzheng Injection on the migration,invasion,and MMP2 expression,c-Raf/MEK/ERK pathway in SCC-25 cells

圖3 參芪扶正注射液對MMP2高表達SCC-25細胞侵襲、遷移及c-Raf/MEK/ERK通路的影響Figure 3 The effects of Shenqi Fuzheng Injection on the migration,invasion,and c-Raf/MEK/ERK pathway in MMP2 over-expressed SCC-25 cells
圖3-C結果顯示,與空白對照組比較,參芪扶正高劑量組SCC-25細胞p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相對表達量顯著降低(P<0.01),MMP2高表達組p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相對表達量明顯升高(P<0.05);與MMP2高表達組比較,MMP2+參芪扶正組細胞p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相對表達量明顯下調(P<0.01)。結果表明參芪扶正注射液可通過抑制MMP2活性來阻止SCC-25細胞c-Raf/MEK/ERK通路的激活,從而限制OSCC轉移。
2.4參芪扶正注射液對裸鼠MMP2高表達移植瘤生長的影響圖4-A、-B、-C結果顯示,與空白對照組比較,參芪扶正高劑量組裸鼠移植瘤體積和質量均顯著降低(P<0.01),MMP2高表達組裸鼠移植瘤體積和質量均明顯增加(P<0.01);與MMP2高表達組比較,MMP2+參芪扶正組移植瘤體積和質量均明顯減少(P<0.01)。
圖4-D結果顯示,與空白對照組比較,參芪扶正高劑量組移植瘤E-cadherin陽性細胞所占比率顯著增多(P<0.01),MMP2組移植瘤E-cadherin陽性細胞所占比率明顯減少(P<0.01);與MMP2高表達組比較,MMP2+參芪扶正組移植瘤E-cadherin陽性細胞所占比率明顯增加(P<0.01)。
圖4-E結果顯示,與空白對照組比較,參芪扶正高劑量組移植瘤中MMP2/β-actin、p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相對表達量顯著下調(P< 0.01),MMP2組移植瘤中MMP2/β-actin、p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相對表達量明顯上調(P<0.01);與MMP2高表達組比較,MMP2+參芪扶正組移植瘤中MMP2/β-actin、p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相對表達量明顯降低(P<0.01)。
以上研究結果表明,參芪扶正注射液可能通過抑制細胞MMP2的活性阻止c-Raf/MEK/ERK通路的激活,從而控制OSCC移植瘤的生長。

圖4 參芪扶正注射液對裸鼠MMP2高表達移植瘤生長的影響Figure 4 The effects of Shenqi Fuzheng Injection on the growth of MMP2-overexpressed SCC-25 xenografts
3 討論
遠處轉移是口腔鱗狀細胞癌(OSCC)高復發率和預后差的主要原因。高侵襲能力和高遷移能力是腫瘤細胞高轉移能力的必要條件,抑制腫瘤細胞侵襲能力和遷移能力可有效地預防腫瘤細胞向遠處轉移。腫瘤轉移通過一系列包括細胞外基質的降解、細胞—細胞粘附、侵襲、遷移、血管生成和無限制細胞增殖的喪失等復雜事件發生[7]。有研究表明,基質金屬蛋白酶2(MMP2)在細胞遷移和侵襲過程中發揮重要作用,主要降解細胞外基質蛋白并參與信號轉導[8-9]。其在OSCC轉移病例中高表達,可促進OSCC細胞轉移[10-11]。本研究結果顯示,MMP2高表達使OSCC細胞遷移率、每視野侵襲細胞數目明顯增加,高劑量參芪扶正注射液可逆轉上述改變,表明參芪扶正注射液可通過抑制MMP2活性來阻止OSCC的轉移。
c-Raf/絲裂原活化蛋白激酶激酶(MEK)/細胞外調節蛋白激酶(ERK)信號通路是一條可被廣泛激活的絲裂原活化蛋白激酶(MAPK)通路,能夠將細胞外信號傳遞入細胞核內,其廣泛參與細胞的生長、增殖、分化、凋亡、侵襲和遷移等過程[12],其失調與腫瘤的發病和惡性進展密切相關[13]。c-Raf可磷酸化激活MEK1和MEK2雙特異性蛋白激酶,而MEK1和MEK2反過來磷酸化激活ERK1和ERK2,激活的ERKs是細胞生理的多效性效應因子,在調控細胞分裂周期、細胞凋亡、細胞分化和細胞遷移的基因表達方面發揮重要作用[12]。已有研究發現,OSCC中c-Raf/MEK/ERK信號通路過度活化[14]。本研究結果顯示,MMP2高表達使OSCC細胞p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白表達升高,而參芪扶正注射液可逆轉上述改變,表明參芪扶正注射液可能通過抑制MMP2活性來阻止SCC-25細胞c-Raf/MEK/ERK通路的激活,從而限制OSCC轉移。
相比單一的外部環境,生物體內環境是極其復雜多變的。本研究進行了裸鼠體內MMP2高表達的移植瘤實驗,進一步探討了參芪扶正注射液對裸鼠MMP2高表達移植瘤生長的影響。E-cadherin的表達與惡性腫瘤的侵襲和遷移能力呈負相關,與預后呈正相關[15],故E-cadherin的表達間接反映了腫瘤細胞的侵襲和遷移能力,而高侵襲能力和高遷移能力是腫瘤細胞高轉移能力的必要條件。本研究結果顯示,MMP2高表達使OSCC裸鼠體內移植瘤的質量和體積明顯增加,移植瘤的E-cadherin陽性細胞比率降低,p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白表達明顯升高,而參芪扶正注射液可逆轉上述變化,表明參芪扶正注射液可能通過抑制細胞MMP2的活性阻止c-Raf/MEK/ERK通路的激活,從而控制OSCC移植瘤的生長。
綜上所述,參芪扶正注射液可抑制OSCC的轉移和發生發展,其機制可能與抑制OSCC細胞MMP2活性來阻止c-Raf/MEK/ERK信號通路激活有關。但具體分子機制還有待進一步深入研究。

