關節鏡下微骨折術合并關節腔注射富含血小板血漿治療老年性膝關節骨性關節炎*
江欽文 賴沛群 黃偉楨 陳歌海 楊周生
(廣東省普寧市人民醫院骨外科 普寧515300)
膝關節骨性關節炎(Knee Osteoarthritis,KOA)由于關節軟骨退變、破壞,軟骨下骨硬化、增生等,導致膝關節腫痛、活動受限,給患者家庭造成經濟負擔。由于關節軟骨缺乏神經、血管和淋巴組織等,再生能力有限,因此治療比較困難[1]。針對關節軟骨損傷,目前臨床上常見治療方法有關節鏡下軟骨磨削成形術、微骨折術(Microfracture,MF)、骨軟骨或骨膜移植術、組織工程技術等[2]。MF 由于操作簡單、創傷小、費用低被廣泛地應用于臨床上,而富含血小板血漿(Platelet Rich Plasma,PRP)通過制備含有大量活性生長因子和炎癥調節因子等物質[3],前者可刺激軟骨細胞再生,促進軟骨基質合成[4],后者可抑制炎癥反應,調節膝關節局部微環境[5]。研究證明PRP治療KOA 療效要優于玻璃酸鈉[6],因此越來越被重視。本研究通過觀察研究關節鏡下微骨折術合并關節腔注射PRP 治療老年性KOA 的臨床療效,旨在為治療KOA 提供臨床依據。現報道如下:
1 資料與方法
1.1 一般資料 納入2015 年12 月~2018 年7 月普寧市人民醫院骨外科治療的符合要求的老年KOA 患者58 例患者按治療方法的不同分為MF 組(對照組)和MF+PRP 組(觀察組),兩組患者性別、年齡、體質量指數(BMI)、治療側別等一般資料比較,差異無統計學意義(P>0.05)。見表1。
表1 兩組患者一般資料比較

表1 兩組患者一般資料比較
組別 n 性別(例)男 女 年齡(歲) BMI(kg/m2) 治療側別(例)左 右觀察組對照組t/χ2 P 29 29 13 16 12 17 0.162 0.687 69.84±1.87 69.54±5.65 0.356 0.722 22.82±1.58 22.46±2.15 0.955 0.342 11 18 14 15 1.020 0.313
1.2 入組標準 納入標準:(1)患者年齡≥60 歲,且<80 歲;(2)符合2009 年美國風濕病協會制定的KOA 診斷標準;(3)KOA 屬X 線Kellgren-Lawrence[7]分級中Ⅱ、Ⅲ級患者,且軟骨損傷面積<4 cm2;(4)BMI≤30 kg/m2;(5)患者配合治療和隨訪。排除標準:(1)患者膝關節有近期外傷史或者其他炎癥性疾病;(2)膝關節畸形,或Kellgren-Lawrence 分級屬Ⅰ、Ⅳ級患者;(3)有嚴重的心、肝、腎功能不全或并發全身惡性腫瘤疾病的患者;(4)有精神意識障礙,不能配合手術和術后療效評估的患者;(5)排除術后失訪的患者。
1.3 治療方法
1.3.1 微骨折術 患者神經阻滯麻醉后,取仰臥位,患肢綁止血帶、消毒、驅血,常規膝關節鏡前內、前外側入路,依次詳細探查內外側間溝、髕上囊、股骨滑車、股骨內外側髁、脛骨平臺等,明確軟骨損傷部位、范圍、類型等,如合并有滑膜皺襞增生、半月板損傷等,可先采用刨削刀或藍鉗等處理,清理修整軟骨損傷部位,應用不同角度微骨折錐由周圍向中心打孔,微骨折錐尖端應與軟骨下暴露骨面盡量垂直,深度3~4 mm,間距為2~3 mm,如有血液或者脂肪滴滲出,提示骨孔深度剛好,否則需要加深,反復沖洗關節腔,留置引流管,無菌敷料覆蓋,彈力繃帶加壓包扎。
1.3.2 PRP 關節腔注射 PRP 制備:抽取患者外周靜脈血30 ml,采用5 ml 枸櫞酸鈉抗凝劑混勻抗凝,使用PRP 制備套裝(山東威高醫療集團新生器械有限公司生產),參考Aghaloo 法[8]二次離心,注意嚴格按照無菌原則操作,最終獲得6~7 ml 的PRP。PRP關節腔注射:患者取仰臥位,膝關節伸直,選取膝關節外上側穿刺點,以穿刺點為中心常規消毒,進針后先回抽確認進入關節腔,連接含有PRP 的套裝注射器,勻速注入關節腔后,局部敷料覆蓋,活動膝關節以便PRP 布散均勻。MF 術后第1 周開始注射,每周注射1 次,共連續3 次。
1.3.3 術后處理及隨訪 術后盡早踝泵和股四頭肌力鍛煉,借助扶拐可部分負重,術后3 個月可完全負重。
1.4 觀察項目及評價方法 對兩組患者術前和術后3、6、9、12 個月的VAS 評分、IKDC 主觀評分、Lysholm 評分、WOMAC 評分進行比較,并觀察記錄不良反應。VAS 評分中0 分表示無痛,依次增加,10分表示劇烈疼痛,難以忍受。IKDC 主觀評分包括癥狀和功能兩個方面,Lysholm 評分重點包括爬樓梯、下蹲、跛行等,兩者均評分越高,功能改善越明顯。WOMAC 評分包括疼痛、僵硬、功能三個方面。
1.5 統計學方法 采用SPSS22.0 軟件進行數據分析,符合正態分布的計量資料采用(x±s)表示,組間比較采用t 檢驗,重復測量的計量資料采用重復測量方差分析,計數資料以%表示,采用χ2檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 兩組患者VAS 評分比較 兩組患者術前VAS評分組間比較,差異無統計學意義(F=1.197,P=0.277>0.05);術后VAS 評分在術后3、6、9、12 個月各觀察點上組間比較,差異均有統計學意義(P=0.000<0.05);兩組患者VAS 評分組內術后3、6、9、12 個月各觀察點上比較,差異均有統計學意義(P<0.05)。見表2。
表2 兩組患者VAS 評分比較
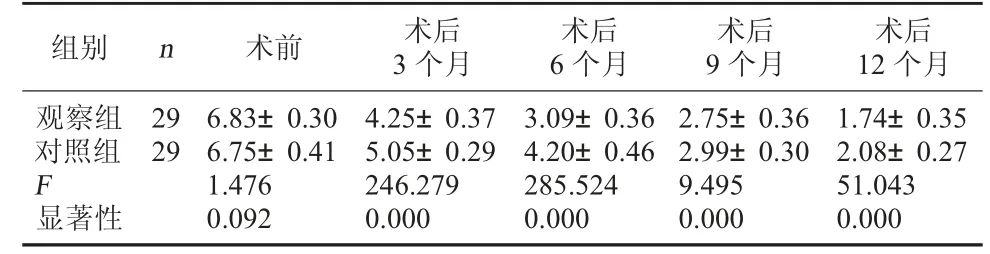
表2 兩組患者VAS 評分比較
組別 n 術前 術后3 個月術后6 個月術后9 個月術后12 個月觀察組對照組F顯著性29 29 6.83±0.30 6.75±0.41 1.476 0.092 4.25±0.37 5.05±0.29 246.279 0.000 3.09±0.36 4.20±0.46 285.524 0.000 2.75±0.36 2.99±0.30 9.495 0.000 1.74±0.35 2.08±0.27 51.043 0.000
2.2 兩組患者IKDC 評分比較 兩組患者術前IKDC 評分組間比較,差異無統計學意義(F=0.033,P=0.855>0.05);術后IKDC 評分在術后3 個月、術后6 個月、術后9 個月各觀察點上組間比較,差異均有統計學意義(P<0.05);術后12 個月組間比較,差異無統計學意義(P>0.05);兩組患者IKDC 評分組內術前和術后3、6、9、12 個月各觀察點上比較,差異均有統計學意義(P<0.05)。見表3。
表3 兩組患者IKDC 評分比較

表3 兩組患者IKDC 評分比較
組別 n 術前 術后3 個月術后6 個月術后9 個月術后12 個月觀察組對照組F顯著性29 29 52.46±3.42 52.60±4.19 0.776 0.382 61.46±3.28 59.46±3.41 35.116 0.000 75.74±3.26 70.14±3.92 132.692 0.000 82.66±2.37 79.86±3.10 60.439 0.000 89.18±2.77 88.78±2.62 1.669 0.202
2.3 兩組患者Lysholm 評分比較 兩組患者術前Lysholm 評分組間比較,差異無統計學意義(P>0.05);術后Lysholm 評分在術后3、6、9 個月各觀察點上組間比較,差異均有統計學意義(P<0.05);術后12 個月組間比較,差異無統計學意義(P>0.05);兩組患者Lysholm 評分組內術前和術后3、6、9、12個月各觀察點上比較,差異均有統計學意義(P<0.05)。見表4。
表4 兩組患者Lysholm 評分比較

表4 兩組患者Lysholm 評分比較
組別 n 術前 術后3 個月術后6 個月術后9 個月術后12 個月觀察組對照組F顯著性29 29 44.78±2.68 44.90±3.30 3.051 0.086 52.48±3.45 49.80±2.99 29.981 0.000 67.36±2.51 64.62±2.90 58.895 0.000 81.62±1.89 78.80±2.55 102.254 0.000 89.14±3.00 88.94±5.92 2.592 0.113
2.4 兩組患者WOMAC 評分比較 兩組患者術前WOMAC 評分組間比較無統計學意義(P>0.05),術后WOMAC 評分在術后3、6、9 個月、術后12 個月各觀察點上組間比較,差異均有統計學意義(P=0.000<0.05);兩組患者WOMAC 評分組內術前和術后3、6、9、12 個月各觀察點上比較,差異均有統計學意義(P<0.05)。見表5。
表5 兩組患者WOMAC 評分比較
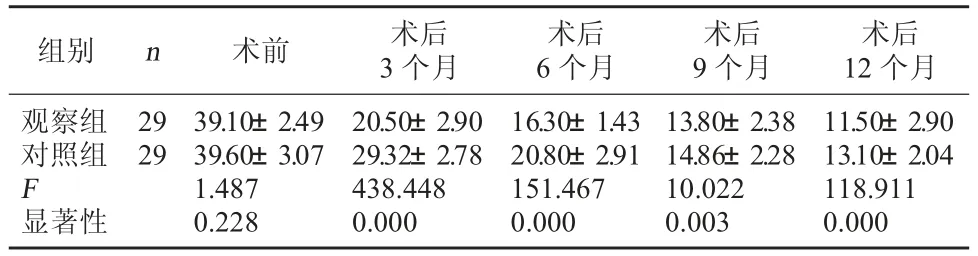
表5 兩組患者WOMAC 評分比較
組別 n 術前 術后3 個月術后6 個月術后9 個月術后12 個月觀察組對照組F顯著性29 29 39.10±2.49 39.60±3.07 1.487 0.228 20.50±2.90 29.32±2.78 438.448 0.000 16.30±1.43 20.80±2.91 151.467 0.000 13.80±2.38 14.86±2.28 10.022 0.003 11.50±2.90 13.10±2.04 118.911 0.000
2.5 不良反應記錄 觀察組29 例患者中,有1 例患者第2 次注射PRP 后,出現膝關節腫脹不適,對照組29 例患者中,有1 例患者術后膝關節腫脹明顯,兩者當時均予以局部冰敷,抬高患肢,密切觀察,經對癥處理3 d 后上述癥狀均明顯緩解。此外,其他所有患者均未出現關節感染、傷口不愈合、下肢深靜脈血栓等并發癥。兩例典型術后患者膝關節MRI 變化如下。見圖1、圖2。

圖1 患者A 術后膝關節MRI 表現
圖2 患者B術后膝關節MRI 表現
3 討論
隨著人口老齡化趨勢加快,KOA 患病率逐年上升,嚴重危害老年人健康,對家庭和社會都造成重大影響。KOA 主要病理特征為軟骨細胞外基質的進行性降解和關節軟骨細胞破壞[9-~10],由于膠原纖維合成受阻,結構破壞,基質金屬蛋白酶、溶酶體蛋白酶等活性酶的溶解作用加強,同時軟骨細胞外基質中蛋白多糖數量、結構改變,軟骨細胞合成分泌代謝微環境失衡,最終導致軟骨破壞、脫落[11]。目前治療早中期KOA 的方法有口服氨基葡萄糖類、非甾體類抗炎藥,關節腔注射玻璃酸鈉等,但均是緩解膝關節疼痛,無法改變KOA 發展進程[12]。近年研究發現PRP能夠促進具有多向分化潛能的骨髓間充質干細胞(Bone Marrow Mesenchymal Stem Cells, BMSCs)向軟骨細胞方向分化[13],為治療KOA 提供了新的方向。
PRP 是采集自體靜脈血經過離心分離而得到的含有高濃度血小板的血漿,經活化后含有大量的活性生長因子和炎癥調節因子[14],血小板源性生長因子、轉化生長因子、血管內皮生長因子、結締組織生長因子等[15]可促進細胞增生、分化,細胞外基質合成,促使軟骨細胞增生,組織修復,而炎癥細胞因子如白介素-1、白介素-4、白介素-6、白介素-10(IL-1、IL-4、IL-6、IL-10)等[16],可緩解KOA 的癥狀,減輕炎癥因子的破壞,可協同生長因子促進對關節軟骨和軟骨外基質修復。有研究表明,PRP 可促進軟骨細胞的增殖和細胞外基質的積聚,此外由于來源于自體組織,不會引起免疫排斥反應、基因突變或誘發腫瘤的效應等[17]。因此,近年來國內外對PRP研究越來越多,從動物實驗到臨床觀察,都不同程度地說明了PRP 在治療KOA 方面的獨特優勢[18]。
本研究結果顯示,兩組患者術后VAS 評分在術后3、6、9、12 個月各觀察點上組間比較均有統計學意義(P=0.000<0.05),兩組患者VAS 評分組內術前和術后3、6、9、12 個月各觀察點上比較均有統計學意義(P=0.000<0.05)。提示通過MF 或MF 術后膝關節腔注射PRP 均能有效減輕患者疼痛,可能與MF 利用骨孔刺激釋放BMSCs,誘導損傷軟骨面纖維軟骨保護層形成有關,改善軟骨代謝,減輕對滑膜刺激,從而減輕疼痛。而MF 聯合注射PRP 較單純采用MF 疼痛緩解更為明顯,可能與PRP 誘導炎癥介質在軟骨損傷部位聚集,降低IL-1、IL-6 等炎癥介質表達,減輕無菌炎癥反應等相關。
本研究結果顯示,兩組患者術后IKDC 評分和Lysholm 評分在術后3、6、9 個月各觀察點上組間比較,差異均有統計學意義(P<0.05);而兩組術后12個月IKDC 評分和Lysholm 評分比較,差異無統計學意義(P>0.05);兩組患者IKDC 評分和Lysholm評分組內術前和術后3、6、9、12 個月各觀察點上比較,差異均有統計學意義(P<0.05)。提示通過MF結合注射PRP 能有效改善患膝功能,可能與MF 緩解患者疼痛,改變軟骨損傷部位局部壓力環境,促使患者活動量增加,進而膝關節屈伸活動增加,功能得到改善相關。此外,通過PRP 關節腔注射釋放多種生長因子,促進軟骨下骨細胞生長分化,加快軟骨損傷修復,同時抑制炎癥反應,減輕對軟骨的破壞,均有利于患者患肢功能改善,而術后第12 個月IKDC評分和Lysholm 評分比較,差異無統計學意義(P>0.05),可能隨著時間的變化,PRP 在關節腔內有效的作用逐漸弱化,因此PRP 在關節內注射的各組分濃度、注射次數及代謝變化情況等問題有待進一步深入研究。
WOMAC 評分為KOA 中最常見的評分之一,本研究結果顯示,兩組患者術后WOMAC 評分在術后3、6、9、12 個月各觀察點上組間比較,差異均有統計學意義(P=0.000<0.05),兩組患者WOMAC 評分組內術前和術后3、6、9、12 個月各觀察點上比較,差異均有統計學意義(P=0.000<0.05)。提示通過膝關節腔注射PRP 結合MF 能有效緩解患者疼痛,減輕患膝僵硬,改善膝關節功能,可能與PRP 釋放大量生長因子和抑制炎癥反應等密切相關。本研究觀察組有1 例患者治療后出現關節腫脹不適,可能與注射PRP 的量有一定的關系,導致關節內壓增加,刺激滑膜出現不適,而所有患者未出現感染、下肢靜脈血栓等,提示了PRP 注射是安全的。綜上所述,關節鏡下微骨折術合并關節腔注射PRP 治療老年性KOA,安全有效,能明顯緩解關節疼痛,改善關節功能,臨床療效優于單純微骨折術。

