Cajal間質細胞在慢傳輸型便秘中的作用及番瀉苷A的治療作用
林 強,張靜瑜,秦小金,王景杰*,李 冀
(1空軍軍醫大學唐都醫院消化內科,西安 710038;2西安市第六醫院消化內科;*通訊作者,E-mail:jingjie@fmmu.edu.cn;#共同通訊作者,E-mail:827537844@qq.com)
慢傳輸型便秘(slow transit constipation,STC)是由于結腸功能紊亂、傳導功能失常造成的排便困難、排便時間延長,常見癥狀以大便干燥、排便次數減少、腹脹等。STC患者就診人數逐漸增多,發病率逐年上升,嚴重影響人們生活質量[1]。目前治療慢傳輸型便秘經常使用的藥物為促胃腸動力藥物,中藥在慢傳輸型便秘的治療作用和藥理機制是臨床和基礎研究的一個重要的方向。番瀉葉是尖葉番瀉或狹葉番瀉的干燥小葉[2],其性味甘、苦、寒,歸大腸經,具有瀉熱行滯,利腸腑,通大便之功效[3],有明確的促胃腸動力作用,是臨床應用最廣泛的導瀉藥之一。大量的臨床實踐發現,番瀉葉可促胃腸蠕動,對胃腸道動力障礙性疾病的治療效果顯著[4-6]。番瀉苷A是番瀉葉的有效成分之一[6-8],但是關于番瀉苷A在STC中的作用及其機制目前研究尚不明確。
目前研究認為,STC的病因及發病機制與腸道動力異常密切相關[9]。在胃腸道中,廣泛分布Cajal間質細胞(ICC),它是胃腸道平滑肌慢波的發起者和傳播者,被視為胃腸動力的起搏細胞[10]。我們前期研究結果表明,ICC表面的超極化激活環核苷酸門控陽離子通道(hyperpolarization-activated cyclic nucleotide-gated channels 1,HCN1)是其節律電活動的始發離子通道[11,12],目前尚不清楚ICC以及HCN1蛋白在慢傳輸型便秘形成中的作用。
我們課題組根據目前國內外研究基礎,提出如下假說:Cajal間質細胞數目減少以及功能蛋白HCN1異常在慢傳輸型便秘發生發展中具有重要作用,而番瀉苷很有用可能通過激活ICC細胞膜上的HCN1通道蛋白促進腸動力,進而改善慢傳輸型便秘的臨床癥狀。針對以上的假說,本研究擬在成功制作STC動物模型基礎上,采用免疫組織化學、藥理學等方法研究ICC及其功能蛋白HCN1在慢傳輸型便秘形成過程中的作用及其機制,同時研究番瀉苷A在慢傳輸型便秘中的藥理作用以及藥理機制,為進一步闡明慢傳輸型便秘發病機制以及后續研究番瀉葉治療STC奠定理論基礎。
1 材料與方法
1.1 實驗動物
7周齡SD大鼠30只,SPF級,雌雄各半,體質量(220±30)g,由空軍軍醫大學動物實驗中心提供(生產許可證號:SYXK(軍)-2012-0023,動物合格證號SCXK(軍)-2012-0007)。將SD大鼠30只隨機分為正常組、模型組、ZD7288+番瀉苷A組、番瀉苷A組和莫沙必利組,每組6只;除正常組外,其余各組采用冰水灌胃法,灌胃給予大鼠0-4 ℃生理鹽水2 ml/只,1次/d,14 d,建立慢傳輸型便秘大鼠模型。
1.2 主要試劑、儀器
番瀉苷A由陜西中醫藥大學藥物研究所提供,根據《中華人民共和國藥典》(一部)[3]計算番瀉苷A大鼠與人體等效劑量。ZD7288(HCN1阻斷劑)為美國Abcam公司產品;山羊抗兔FITCt購自美國Sigma公司;驢抗鼠Texas-red購自美國Molecular Probes公司;兔抗c-kit多克隆抗體購自美國Sigma公司;鼠抗HCN1單克隆抗體購自美國Sigma公司。FV1000激光共聚焦顯微鏡(日本Olympus公司);恒冷箱切片機(德國Leica公司);多導生理記錄儀RM6280B(成都儀器廠)。
1.3 胃腸道組織標本制備
腹腔注射戊巴比妥鈉(40 mg/kg)麻醉大鼠,先給予靜滴生理鹽水100 ml。隨后用溫度為4 ℃、濃度為40 g/L多聚甲醛磷酸鹽(0.1 mol/L)緩沖液500 ml(PB,pH7.4),經靜脈先快后慢灌流約2 h,將固定好的結腸組織置于25%蔗糖溶液,4 ℃浸泡過夜,待組織沉底后,恒冷箱切片機上連續切片,切片厚12 μm,風干,-20 ℃保存備用。
1.4 免疫熒光雙標染色檢測結腸c-kit陽性細胞數目和HCN1蛋白表達情況
將制備好的腸道組織冰凍切片或者全層鋪片用含1% BSA+0.3%Triton的PBS液封閉1 h,入一抗(HCN1抗體按1 ∶500稀釋,c-kit按1 ∶1 000稀釋,GFAP抗體按1 ∶500稀釋)。一抗孵育12 h(4 ℃)。經PBS漂洗后入二抗(羊抗兔FITC二抗,驢抗鼠Texas-red二抗均按1 ∶500稀釋)室溫孵育2 h,DAPI襯核。PBS漂洗,50%緩沖甘油封片,鏡下觀察組織。
1.5 大鼠結腸推進速度測定
實驗前30 min,正常組和模型組均給予生理鹽水灌胃,番瀉苷A組給予1.0 mg/ml番瀉苷A灌胃,ZD7288+番瀉苷A組大鼠尾靜脈給予0.5 ml HCN1的特異性阻斷劑ZD7288(0.5 mmol/L)同時灌胃給予1.0 mg/ml番瀉苷A干預,莫沙比利組給予灌胃給予0.05 mg/ml莫沙比利;以上各組均灌服同體積液體(0.1 ml/100 g)。各組大鼠用30%水合氯醛麻醉,待麻醉成功后,將直徑3 mm玻璃小球用細的塑料軟管推入距肛門3 cm直腸處。籠內墊清潔濾紙,待大鼠蘇醒后迅速移至籠內喂食飲水,并開始計時,記錄直腸內玻璃小球排出的時間。
1.6 結腸離體肌條制備
將20只SD大鼠在室溫(20±2)℃的環境中飼養,其中15只SD大鼠給予0-4 ℃生理鹽水2 ml灌胃,每日1次,共14 d,建立慢傳輸型便秘大鼠模型,隨機分成正常組、模型組、番瀉苷A組、ZD7288+番瀉苷A組,每組各5只。將大鼠脫頸椎處死,從腹部正中剖開腹腔,取結腸,在距離肛門約5 cm處截取一段結腸,長4-5 cm,放入盛有4 ℃ Krebs液的培養皿中,持續通入5%二氧化碳和95%氧氣的混合氣體,保持標本活性;用濕棉簽擦破結腸系膜,用眼科鑷剔除漿膜,沿結腸系膜縱行剪開腸腔,用Krebs液洗凈結腸內容物,將腸管黏膜層朝上鋪平固定在硅膠板上,用眼科鑷和玻棒剝除黏膜層及黏膜下層組織,觀察結腸環行肌走行,將兩個刀片固定刀片架上,刀片之間距離設定為3 mm,沿結腸環行肌走行方向切取3 mm×8 mm的肌條,再沿著縱行平滑肌纖維的方向切取3 mm×8 mm的肌條。
1.7 離體結腸肌條收縮頻率和幅度測定
將制備好的環行肌肌條、縱行肌肌條標本移入持續通以95%氧氣和5%二氧化碳混合氣體,盛有37 ℃ Krebs液中的恒溫肌槽中,含鈣Krebs液:NaCl 6.75 g/L,CaCl20.28 g/L,KCl 0.344 g/L,NaHCO31.84 g/L,MgSO47 g/L,NaPO40.18 g/L,H2O 0.28 g/L,葡萄糖2.0 g/L,維持pH值于7.3-7.5;在肌條兩端分別用醫用絲線扎牢,一端固定在平滑肌槽下端的彎鉤,另一端固定于張力換能器,在前負荷為1.0 g狀態下,孵育肌條1 h,每15 min更換新鮮Krebs液1次,待肌條自發收縮活動平穩后,通過多導生理記錄儀,記錄縱行肌肌條和環行肌肌條的收縮振幅和頻率,描記活動曲線3-5 min。番瀉苷A組給藥的方法,先給予番瀉苷A(1.0 mg/ml)0.5 ml,觀察肌條收縮振幅和頻率,描記給藥后肌條活動曲線3-5 min;ZD7288+番瀉苷A組給藥的方法,加入HCN1阻斷劑ZD7288(0.5 mmol/L)0.5 ml,觀察肌條收縮和頻率,同時記錄給藥后肌條活動曲線3-5 min,5 min后加入番瀉苷A(1.0 mg/ml)0.5 ml,再次觀察肌條收縮和頻率,并描記給藥后肌條活動曲線。
1.8 統計學分析

2 結果
2.1 慢傳輸型便秘大鼠胃腸道c-kit陽性細胞ICC數目和HCN1蛋白表達的變化
免疫組織化學熒光雙標染色結果顯示,在慢傳輸型便秘大鼠胃腸道中,c-kit免疫熒光強度及光密度值與對照組相比均顯著下降,即c-kit陽性ICC細胞數目顯著減少(P<0.05,見圖1,2);同樣,在慢傳輸型便秘大鼠胃腸道中HCN1免疫熒光密度值和對照組相比亦均顯著下降,即HCN1蛋白表達水平顯著下降(P<0.05,見圖1,2)。
2.2 在體阻斷離子通道HCN1對番瀉苷A促結腸蠕動作用的影響
特異性阻斷HCN1通道蛋白,觀察HCN1被阻斷劑阻斷后番瀉苷A對結腸蠕動的影響。實驗結果顯示:模型組結腸推進速率低于正常組(P<0.05);番瀉苷A組和莫沙比利組結腸推進速率明顯高于模型組(P<0.05),而ZD7288+番瀉苷A組結腸推進率和模型組相比較無統計學差異(P>0.05,見圖3)。同時,番瀉苷A組結腸推進速率略高于莫沙必利組(P<0.05),即番瀉苷A促結腸動力效果優于莫沙必利;而ZD7288+番瀉苷A組結腸推進率顯著低于番瀉苷A組(P<0.05,見圖3)。
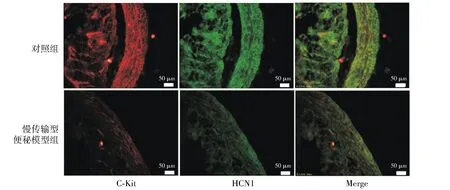
圖1 大鼠近端結腸c-kit陽性細胞數目和HCN1蛋白表達變化情況Figure 1 The number of c-kit positive ICC and the expression of HCN1 in the proximal colon of rats
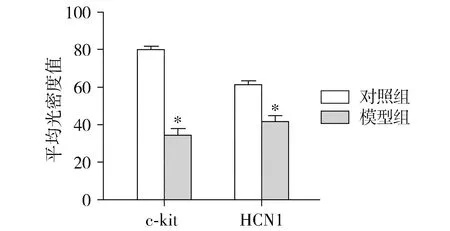
與正常組比較,*P<0.05圖2 兩組大鼠近端結腸c-kit陽性細胞密度和HCN1蛋白表達水平比較Figure 2 Comparison of the density of c-kit positive ICC and expression of HCN1 in the proximal colon of rats between normal group and model group
2.3 番瀉苷A和ZD7288干預對結腸縱行平滑肌肌條收縮情況的影響
模型組慢傳輸型便秘模型大鼠結腸縱行肌收縮幅度和頻率明顯小于正常組大鼠結腸縱行肌收縮幅度和頻率(P<0.05);番瀉苷A組與模型組相比,大鼠縱行肌收縮頻率和收縮幅度均明顯升高(P<0.05)。但是ZD7288+番瀉苷A組大鼠結腸縱行肌收縮頻率和收縮幅度與模型組比較差異均無統計學意義(P>0.05,見圖4),即番瀉苷A組促結腸縱形肌收縮作用可以被HCN1阻斷劑所阻斷。
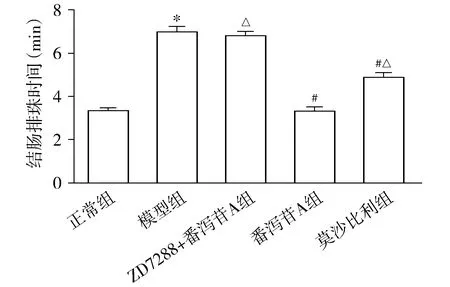
與正常組比較,*P<0.05;與模型組比較,#P<0.05;與番瀉苷A組比較,△P<0.05圖3 在體阻斷HCN1對番瀉苷A促結腸蠕動作用的影響Figure 3 Effect of blocking HCN1 in vivo on the role of sennoside A in promoting colon peristalsis
2.4 番瀉苷A和ZD7288干預結腸環行平滑肌肌條收縮情況的影響
模型組慢傳輸型便秘模型大鼠結腸環行肌收縮幅度和頻率明顯小于正常組大鼠結腸環行肌收縮幅度和頻率(P<0.05)。給予番瀉苷A干預的慢傳輸型便秘模型大鼠環行肌收縮頻率和收縮幅度與模型組大鼠環行肌收縮頻率和收縮幅度相比,兩個指標均明顯升高(P<0.05)。但是ZD7288+番瀉苷A組大鼠結腸環行肌收縮頻率和收縮幅度與模型組大鼠結腸環行肌收縮頻率和收縮幅度差異均無統計學意義(P>0.05,見圖5),即番瀉苷A組促結腸環形肌收縮作用可以被HCN1阻斷劑所阻斷。
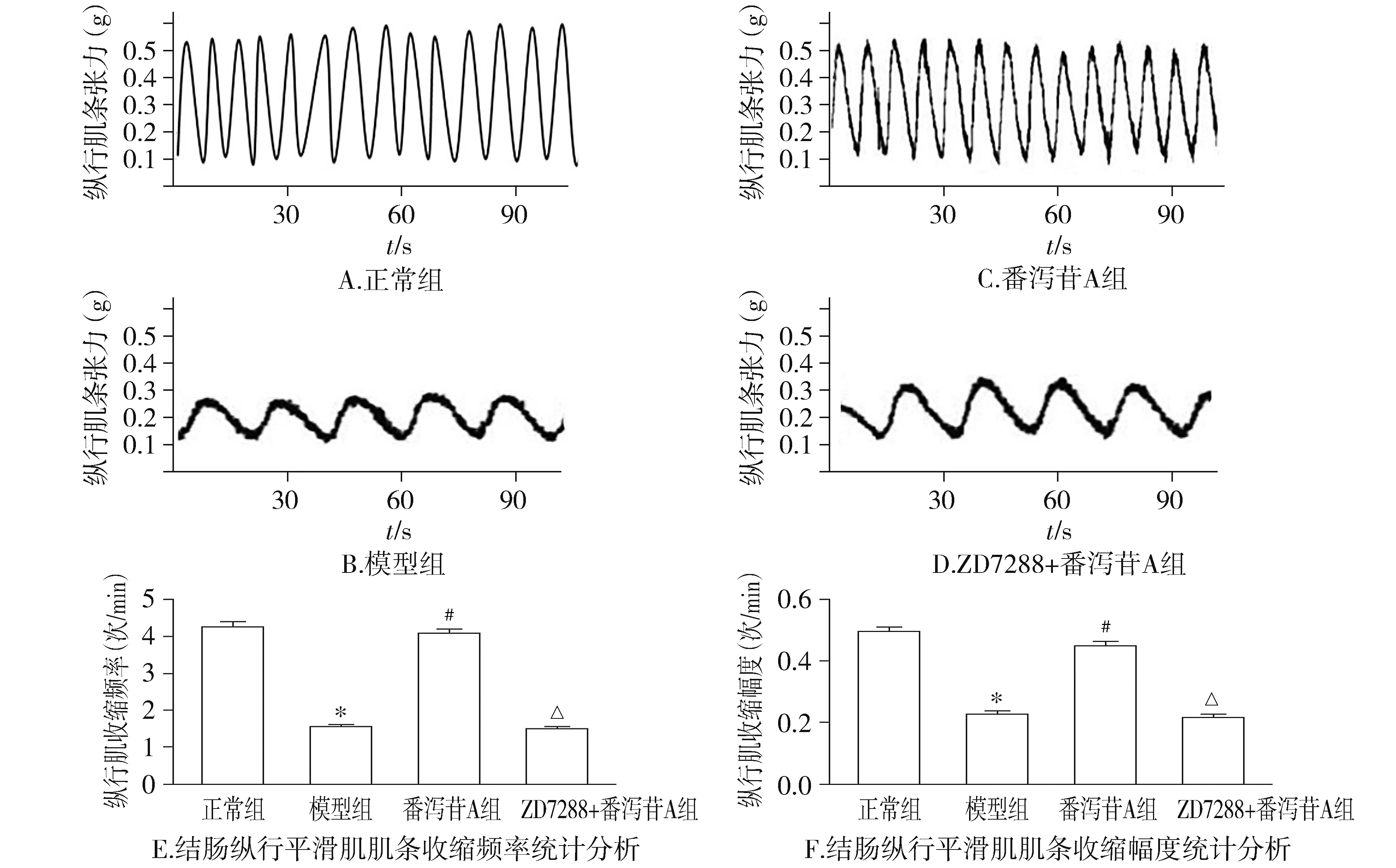
與正常組比較,*P<0.05;與模型組比較,#P<0.05;與番瀉苷A組比較,△P<0.05圖4 番瀉苷A和ZD7288對大鼠結腸縱行平滑肌肌條收縮的影響Figure 4 Effect of Sennoside A or ZD7288 on the e spontaneous contractile activity of the longitudinal muscle strip isolated from the colon of the adult rat
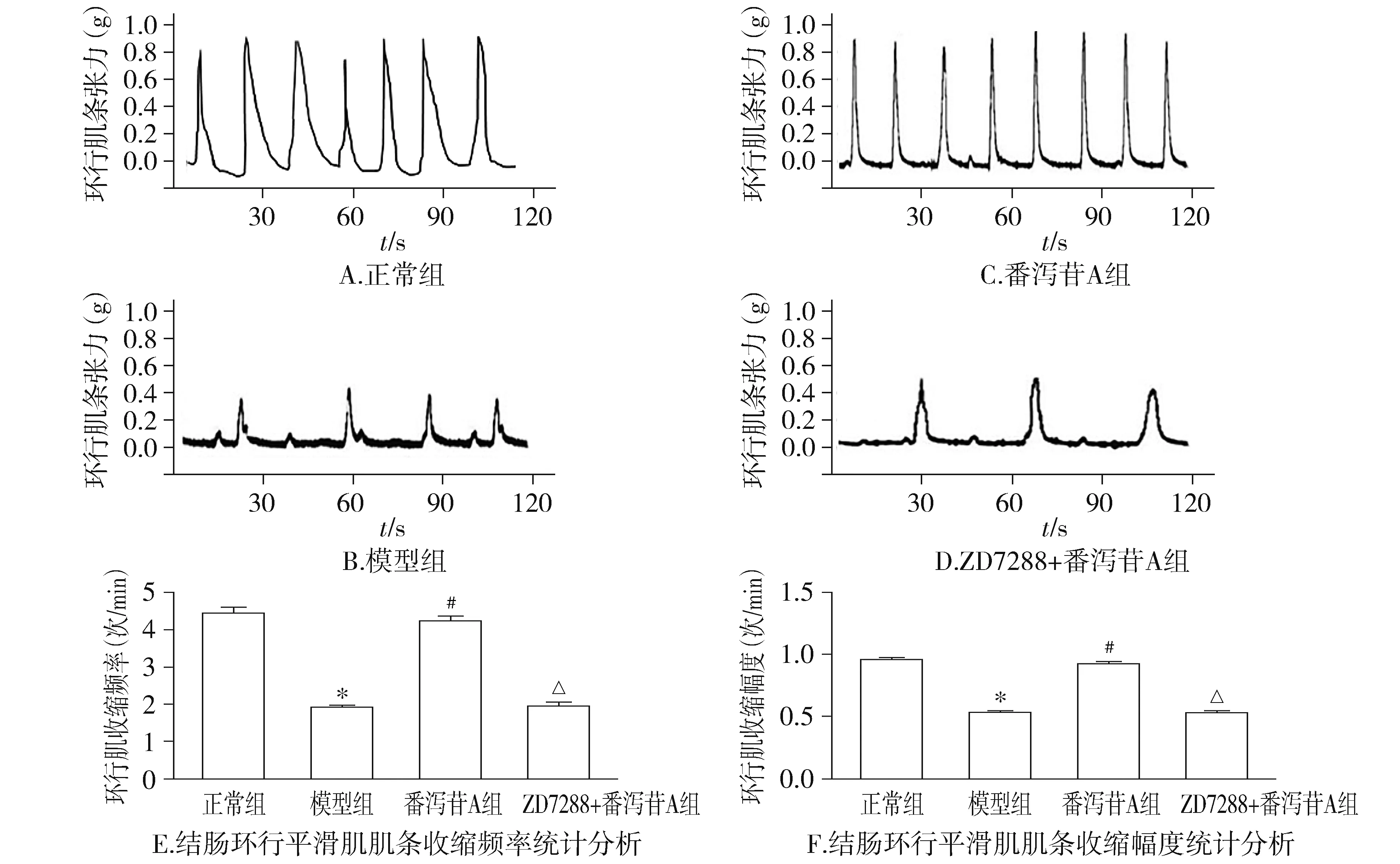
與正常組比較,*P<0.05;與模型組比較,#P<0.05;與番瀉苷A組比較,△P<0.05圖5 番瀉苷A和ZD7288對大鼠結腸環行平滑肌肌條收縮的影響Figure 5 Effect of sennoside A or ZD7288 on the spontaneous contractile activity of the circular muscle strip isolated from the colon of the adult rats
3 討論
慢性特發性便秘(chronic idiopathic constipation,CIC)已經成為最常見的胃腸道疾病之一,全球發病率為14%[13]。其中慢傳輸型便秘(STC)是慢性特發性便秘最為常見的一種亞型,約占慢性特發性便秘患者42%[14]。北京地區在2001年及2010年兩次對慢性便秘流行病學的調查結果顯示,發病率分別為6.07%和4.1%,女性多于男性[15,16]。還有廣州、西安、天津、杭州等地也曾進行便秘流行病學調查,各地的發病率有很大差異,在3%-17%之間[17-21]。便秘不僅對患者的身心健康造成長期的不良影響,同時也造成了巨大的經濟負擔。最近的一項研究表明,平均每年為每位便秘患者提供的醫療費用為7 522美元[22]。因此,針對慢性特發性便秘尤其是慢傳輸型便秘的發病機制和診療策略的研究具有重要的臨床意義。
已經有許多研究表明,結腸動力障礙在慢傳輸型便秘的發生發展過程中發揮著重要作用[14,23]。在胃腸道平滑肌層中,環行肌和縱行肌協調舒縮是胃腸動力產生的重要基礎。因此,對STC疾病模型結腸環、縱行肌運動特征的研究,將有助于我們進一步深入理解STC的發病機制。本次實驗在體檢測結腸排珠時間,結果顯示,與正常大鼠相比,慢傳輸型便秘模型大鼠結腸傳輸速率均顯著下降;在此基礎上,通過離體肌條實驗探究結腸環縱行肌運動特點,結果顯示,與正常大鼠相比,慢傳輸型便秘模型大鼠結腸腸道平滑肌收縮幅度和頻率顯著下降。以上研究結果提示,慢傳輸型便秘之所以發生,不但其結腸的舒縮功能下降(主要是環形肌的作用),而且其推進功能也降低(主要是縱行肌的作用),二者的功能改變,進而導致其協同性的下降,進一步導致結腸舒縮和推進的下降,使得結腸處于一種“無力”的狀態,結腸運動障礙,水分過度吸收,進而使得大便性狀及在結腸中被推進的速率均產生了變化,患者表現為排便費力和大便干結的情況。
不同于骨骼肌,胃腸道平滑肌存在自發性、節律性收縮運動,即慢波節律;慢波是胃腸運動的基本節律,在胃腸動力形成過程中發揮至關重要的作用[24]。本次離體肌條實驗結果顯示,STC模型大鼠結腸慢波頻率和幅度均下降,這提示慢波節律的異常是STC形成的重要病理生理機制。但是,導致STC結腸慢波節律異常的潛在細胞與分子基礎研究尚不明確。大量研究表明,Cajal間質細胞(interstitial cells of Cajal,ICC)作為胃腸道起搏細胞,是胃腸道慢波的發起與傳播者,它在胃腸道平滑肌收縮節律、幅度、方向的調節中發揮著重要作用[10,24]。Cajal間質細胞是廣泛分布于胃腸道肌層一種間質細胞,可以被干細胞因子受體c-kit特異性標記[25]。研究表明,化學性損害Cajal間質細胞可以導致胃腸慢波節律明顯異常甚至消失[26]。隨后通過膜片鉗技術發現,ICC確實具有自發性電節律特點[27]。而且,也有研究報道運用中和性抗體阻斷ICC膜上標記分子c-kit或者基因敲除c-kit,可以導致ICC發育缺陷,同時導致胃腸道慢波形成障礙[28]。Cajal間質細胞在胃食管反流病、胃輕癱等胃腸動力障礙性疾病中均具有重要作用[29,30],但是ICC在慢傳輸型便秘中的作用研究尚不是很明確。為了進一步研究Cajal間質細胞在慢傳輸型便秘發生發展過程中的作用及其機制,我們采用免疫熒光染色觀察胃腸道ICC形態變化。實驗結果顯示,慢傳輸型便秘模型大鼠結腸c-kit陽性的ICC數目顯著減少,同時HCN1蛋白表達也下調。HCN1通道蛋白在具有自發性電節律的心肌細胞、神經元上有分布,并介導這些細胞的起搏電流Ih(hyperpolarization-activated current)的形成,該電流又被稱為If(funny current),因此HCN1在這些細胞的起搏電活動中發揮至關重要的作用[31,32]。而我們課題組前期研究結果表明,離子通道HCN1是特異性分布于ICC上的離子通道蛋白,在ICC起搏節律形成中作為始發離子通道而發揮著重要作用[11]。因此,胃腸道ICC數目降低、功能蛋白HCN1表達下調可能是慢傳輸型便秘形成的細胞和分子基礎。
番瀉葉主要成分為尖葉番瀉葉含有的番瀉苷A、B、C及蘆薈大黃素-8-葡萄糖苷、大黃酸-1-葡萄糖苷、大黃酸-8-葡萄糖苷、蘆薈大黃素、大黃酸糖等。番瀉葉主要導瀉成分為番瀉苷A、B、C、D,其中番瀉苷A和B互為同分異構體,且番瀉苷A的含量較多,相對易于提取[7-9]。番瀉葉具有瀉下通便作用,因此被廣泛應用于便秘患者的治療中,番瀉苷是番瀉葉導瀉促蠕動的有效成分,但是具體的機制尚不明確。本次在體實驗結果表明,番瀉苷A對慢傳輸型便秘模型大鼠結腸促蠕動作用優于傳統促動力藥莫沙比利,而離體肌條實驗也發現番瀉苷A可以顯著提高胃腸道離體肌條收縮頻率和幅度。但是如果選擇性阻斷HCN1可以明顯削弱番瀉苷A在慢傳輸型便秘模型大鼠中的促結腸動力作用。同時離體肌條實驗也表明選擇性阻斷HCN1確實可以顯著削弱番瀉苷A促結腸肌條收縮作用。以上實驗結果表明,番瀉苷A促進慢傳輸型便秘模型大鼠結腸蠕動的作用有賴于HCN1通道蛋白的存在,但是番瀉苷A是否通過激活HCN1通道蛋白來起促結腸動力作用還需進一步深入研究。
本次實驗結果顯示,慢傳輸型便秘模型大鼠結腸Cajal間質細胞數目減少、HCN1通道蛋白表達減少,這構成STC形成的細胞和分子基礎;同時在體和離體實驗結果表明番瀉苷A可以通過促進慢傳輸型便秘模型大鼠結腸蠕動來發揮對STC的治療作用,且這種作用有賴于HCN1通道蛋白的存在。但是進一步探究番瀉苷A是通過激活HCN1通道蛋白來發揮藥理作用,還需要開展細胞膜片鉗實驗才能直接驗證。

