主動脈瓣置換術后再發急性A型主動脈夾層手術治療
楊靈波,王學寧,鄭志發,張忠杰,張立魁,宗俊青,王 棟
(山西醫學科學院,山西白求恩醫院心臟大血管外科,太原 030032;*通訊作者,E-mail:wangxuening-2004@126.com)
據報道,主動脈瓣置換術(AVR)后A型主動脈夾層的發生率可達0.6%[1-3],手術治療難度明顯增加,術后重要臟器功能不全等并發癥的發生率高,現將我院近期手術治療的1例AVR后再發A型主動脈夾層患者情況報道如下,并對其發生的危險因素及術中要點進行總結分析。
1 病例簡介
患者,男性,65歲,因“突發胸背部疼痛6 h”入院。患者于入院前6 h爬樓梯時突然出現胸背部撕裂樣疼痛,伴出汗,持續不能緩解,急診于當地醫院轉入我院。入院查體:平臥位,神志清楚,血壓125/75 mmHg左右,心率85次/min左右,律齊,心前區可聞及機械瓣音,腹平軟,周圍征陽性。高血壓病史15年,否認糖尿病病史。曾于2年前(2017年8月)因主動脈瓣狹窄伴關閉不全行主動脈瓣機械瓣置換術,術前超聲心動圖示,主動脈瓣中度狹窄伴中度關閉不全,升主動脈內徑44 mm。本次入院超聲心動圖示:升主動脈擴張,內徑53 mm,升主動脈內可見細線樣內膜回聲,將管腔分為真、假兩腔,提示主動脈夾層(Stanford A型);主動脈瓣機械瓣啟閉正常,未見瓣周漏;左房擴大,前后徑38 mm;左室擴大,舒張末期內徑(LVEDD)56 mm;心包腔少量積液(前心包腔液深0.6 cm)。入院主動脈CTA示,主動脈升、弓、降各段內膜撕裂,假腔大,真腔小,升主動脈管徑5.5 cm,頭臂干夾層受累,腹腔干及腸系膜上動脈起自假腔,左腎動脈閉塞,提示主動脈夾層(Stanford A型)(見圖1)。實驗室檢查示:白細胞計數8.2×109/L,谷丙轉氨酶(ALT)125.7 IU/L,谷草轉氨酶(AST)211.2 IU/L,肌酸激酶(CK)310.5 IU/L,肌紅蛋白147.8 ng/ml,血肌酐(Scr)95.6 μmol/L。血栓彈力圖試驗示:凝血因子活性8.9 min,纖維蛋白原功能2.2 min,60.3 deg,血小板功能59.4 mm。
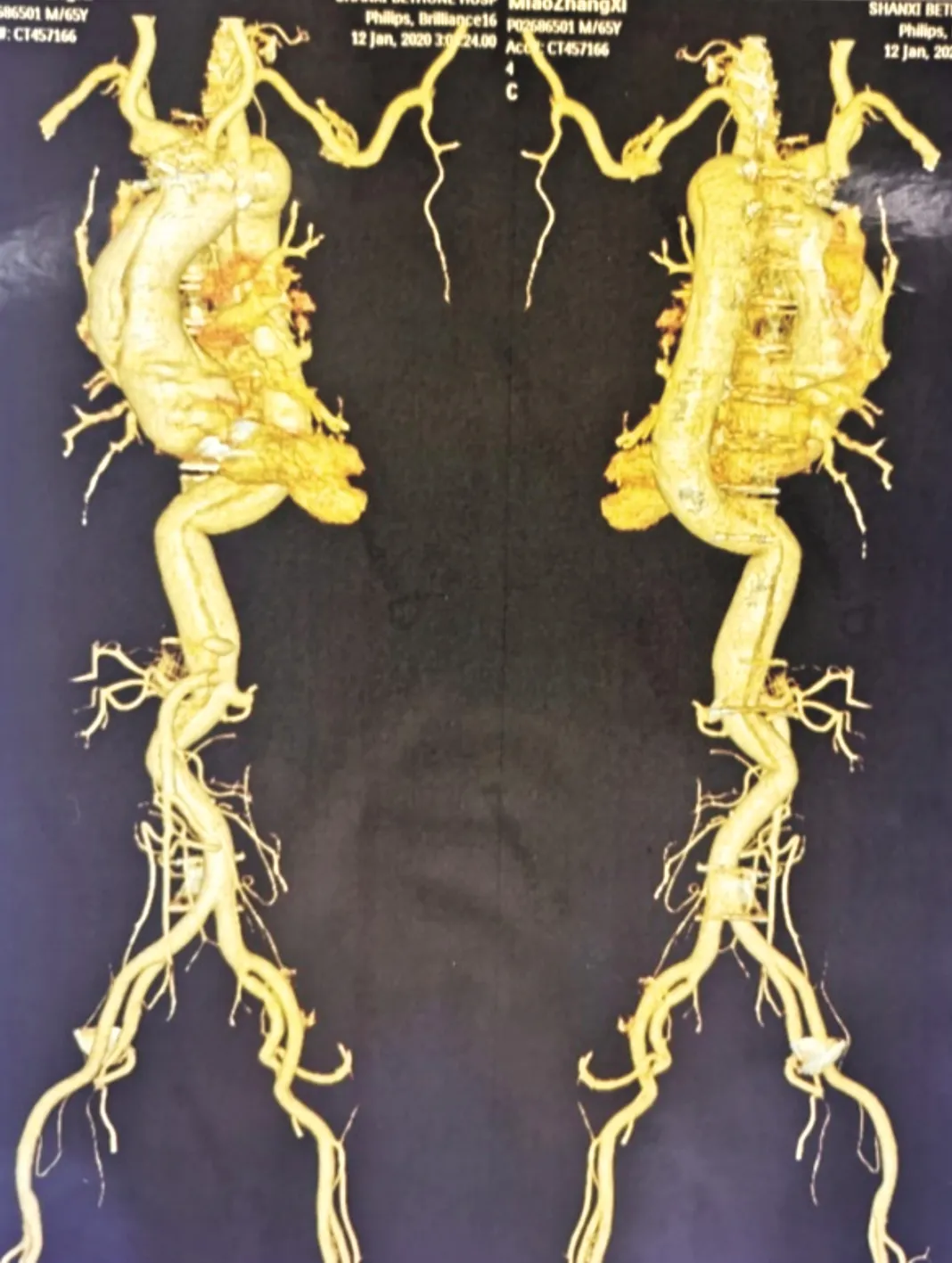
圖1 主動脈瓣置換術后再發A型主動脈夾層患者術前主動脈CTA檢查結果
入院后施行急診手術。采用靜吸復合麻醉,中心靜脈穿刺,同時建立上下肢動脈監測,監測鼻溫及肛溫,消毒鋪單,備好股動靜脈插管,游離腋動脈備用,隨時做好緊急轉機降溫的準備。適當降低血壓后正中開胸,仔細游離心臟,顯露右心房、右上肺靜脈入口、心尖等部位,游離弓部各分支,全身肝素化,經腋動脈插主動脈供血管,經右心房插腔房雙極靜脈管,經右上肺靜脈插左心引流管,開始轉機降溫。頭部放置冰帽。阻斷升主動脈,切開升主動脈經冠脈開口行心肌保護,探查,升主動脈前外側壁可見內膜破口,長約3.5 cm,升主動脈假腔形成,原主動脈機械瓣啟閉正常,未見瓣周漏,夾層未累及左、右冠脈開口。取26#人工血管,用4-0 prolene線將人工血管、主動脈瓣環及機械瓣縫合環進行連續縫合,行升主動脈置換。在人工血管與左冠脈開口對應部位打孔,移植左冠脈開口。在人工血管與右冠脈開口對應部位打孔,取8 mm人工血管長約6 mm,移植右冠脈開口(見圖2)。繼續降溫至26 ℃,停循環,經腋動脈施行選擇性順行腦保護,完成主動脈弓人工血管置換及降主動脈內支架置入術(即“孫氏”手術)。術畢行原主動脈外膜的包裹分流。深低溫停循環時間32 min,體外循環時間178 min。
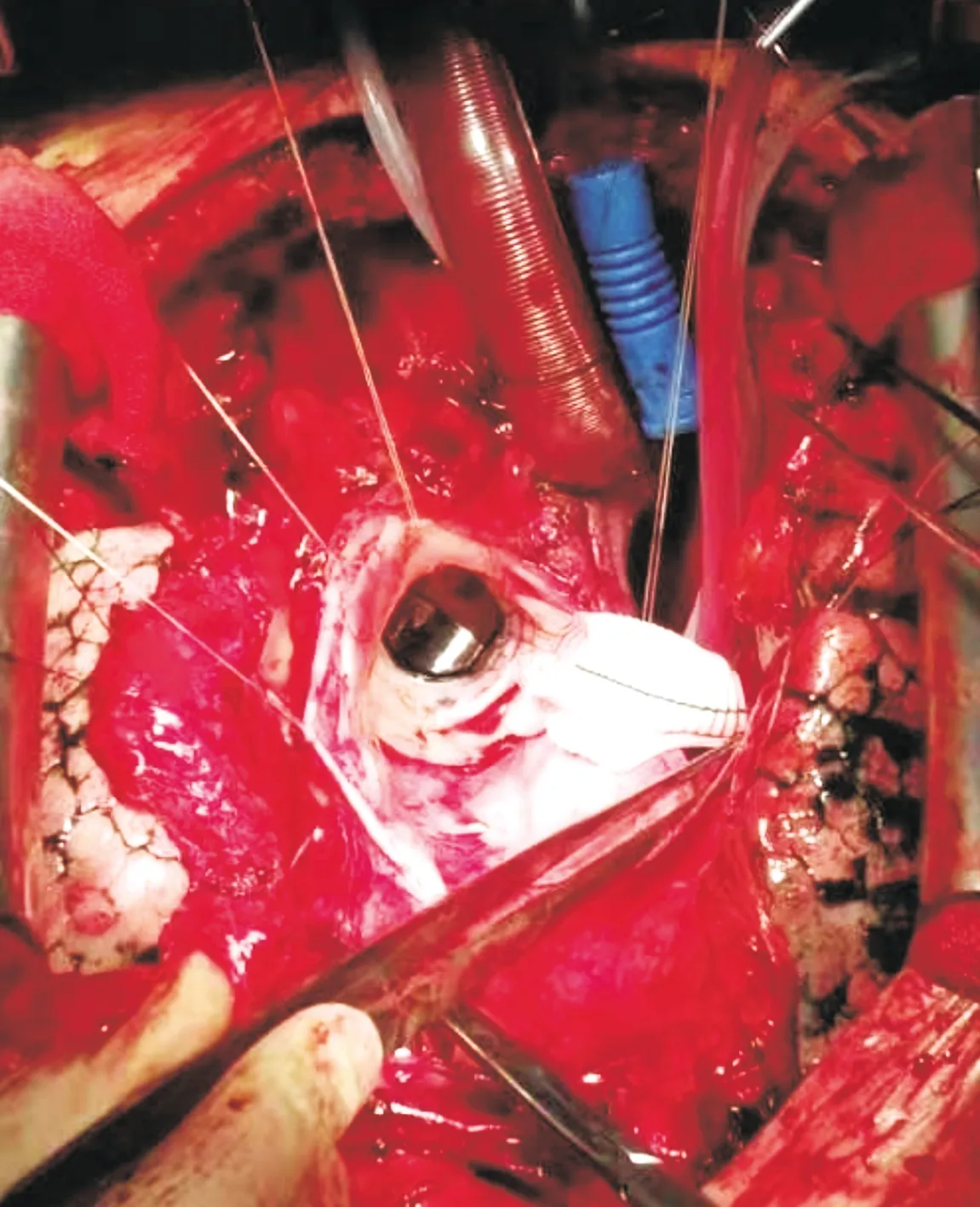
圖2 主動脈瓣置換術后再發A型主動脈夾層患者術中所見
術后予呼吸機輔助,心率65-110次/min,血壓90-150/50-95 mmHg,術后8 h起尿量呈減少趨勢,30-60 ml/h,ALT 265.5 IU/L,AST 284.8 IU/L,CK 2 592 IU/L,Scr 259.8 μmol/L,尿素29.7 mmol/L,SpO292%-98%,使用連續性腎臟替代(CRRT)48 h,尿量逐漸恢復至100-150 ml/h。術后第3天ALT 97.4 IU/L,AST 91.2 IU/L,CK 428.5 IU/L,Scr 102.4 μmol/L,停用CRRT。術后呼吸機輔助70 h,ICU時間4 d,共引流1 050 ml,術后12 d治愈出院。
2 討論
心臟直視術后發生Stanford A型主動脈夾層較為罕見,發生率為0.06%-0.23%,多見于主動脈瓣置換術(AVR)后,發生率可達0.6%[1-3]。心臟術后發生A型主動脈夾層有兩種情況:①術中即刻發生;②術后數月或數年發生。前者需術中即刻處理,后者一旦診斷明確也需緊急手術干預。對于術后遲發的A型主動脈夾層,有報道其病死率可高達50%,手術難度增加,術后重要臟器功能不全等并發癥的發生率較自然發生的A型主動夾層明顯增高[1],此類病例預防意義大于治療。
回顧性研究顯示,AVR后遲發主動脈夾層的獨立危險因素包括:主動脈壁脆弱、主動脈瓣反流、主動脈壁薄,危險度分別為22%,14%和7%,而如果三者均有則風險增加96%[4]。以往大多數研究者認同升主動脈直徑>5.0 cm時,需在AVR中同時替換升主動脈,特別是合并主動脈瓣二瓣化畸形、主動脈瓣返流、常年高血壓、男性、動脈粥樣硬化、術中見動脈壁纖薄及彈性明顯下降時,升主動脈直徑>4.5 cm,即應該積極處理[5,6]。2010年美國和2014年歐洲主動脈疾病指南建議,對于主動脈瓣病變合并升主動脈擴張,直徑>4.5 cm時即應同期行升主動脈替換,同時還需綜合考慮患者年齡、體格、瓣膜疾病病理情況、手術中的情形、主動脈壁的厚薄、脆弱性等,如升主動脈最大直徑或主動脈根部截面積(cm2)除以患者身高(m)超過10,可考慮行升主動脈置換[7,8]。另外研究發現,主動脈瓣關閉不全患者較主動脈瓣狹窄患者行AVR后更易發主動脈夾層[9]。對于主動脈瓣狹窄伴升主動脈擴張者,若患者高齡、合并癥多,且升主動脈擴張范圍局限于主動脈竇部至頭臂動脈之間,可于AVR時行升主動脈成形加升主動脈包裹,但不包括主動脈瓣二葉畸形患者;對于主動脈瓣關閉不全伴升主動脈擴張者,應積極行升主動脈置換[10-13]。本例患者術前升主動脈直徑擴大(44 mm),長年高血壓病史,主動脈瓣狹窄合并關閉不全,因此我們認為AVR當時應積極行升主動脈置換,以防止繼發主動脈夾層或升主動脈瘤。
AVR術后發生主動脈夾層,手術難度及病死率明顯上升,我們總結二次主動脈手術方案的要點如下:①術前準備。行主動脈CTA明確主動脈病變,判斷動脈瘤與胸骨的距離,超聲心動圖明確心臟功能及人工主動脈瓣情況,決定手術入路及體外循環方式,制定詳盡手術方案,備體外除顫電極板,備血小板。②再次開胸。仔細操作,避免大出血,如主動脈與胸骨間有足夠縫隙,可常規開胸及建立體外循環,粘連較緊,應果斷先行股動脈或右腋動脈主動脈插管及股靜脈插管,運轉體外循環,降溫至鼻溫32 ℃左右,心臟停搏放空后再行開胸和游離,以降低主動脈破裂風險。③體外循環。推薦先考慮采用右腋脈插管行術中腦保護,右上肺靜脈游離困難,可打開右側胸膜,經胸腔置入右上肺靜脈左心插管。④手術方式。根據人工瓣膜狀態及主動脈病變范圍決定手術方式,本例人工瓣啟閉正常,夾層未累及冠脈開口,根部予施行升主動脈置換,而夾層累及主動脈弓部及降主動脈,予施行孫氏手術,將左冠狀動脈開口直接與人工血管吻合,而右冠狀動脈則通過一段8 mm人工血管與升主動脈人工血管相吻合,以防止吻合張力過大、冠狀動脈扭曲導致冠狀動脈供血障礙;另外手術吻合口較多,術前使用抗凝藥物,二次手術創面廣泛,因此術中將吻合口用原主動脈外膜包裹并引流至右心房,減少止血時間,防止術后感染。⑤術后處理。AVR再發主動脈夾層,術后重要臟器功能不全等并發癥發生率高,需積極處理,本例患者術后早期出現尿量少,肝腎功能指標升高,及時給予CRRT,術后恢復順利。
總之,AVR術中應根據升主動脈直徑等情況決定是否同期行升主動脈替換;而AVR術后一旦發生主動脈夾層,應緊急施行手術,根據術前判斷和術中情況,慎重選擇手術方式,術后積極處理合并癥。

