人源性與豬源性冠狀病毒的再認識與防控策略
胡偉 文麗 鄧小紅 許建章


摘? 要:本文對人源性和豬源性的冠狀病毒進行綜述,讓養豬人足不出戶了解冠狀病毒以及它對我們的影響和危害,從而避免或減少冠狀病毒對我們造成的損失。
關鍵詞:人源性冠狀病毒;豬源性冠狀病毒;分泌型IgA;豬傳染性胃腸炎病毒;豬流行性腹瀉病毒
中圖分類號:S851.33 文獻標志碼:C 文章編號:1001-0769(2020)06-0041-06
2019新型冠狀病毒牽動著世界上每個人的心,這個看不見的敵人帶來了一場沒有硝煙的戰爭,給全世界帶來了災難性的打擊。此后無人不知冠狀病毒,從未上過學的老父親也因這次疫情知道鐘南山的大名。冠狀病毒首次發現距今已有70多年的歷史,此類病毒可感染人、豬、其他哺乳動物和鳥類,引起呼吸道和腸道疾病。冠狀病毒變異快,傳播迅速,已知和新出現的冠狀病毒對人類和養豬業造成了巨大的威脅和經濟損失。作為養豬人,不僅需要了解人源性冠狀病毒,更要了解豬源性冠狀病毒,防患于未然,把豬養得更好,賺更多錢。
1? 人源性冠狀病毒
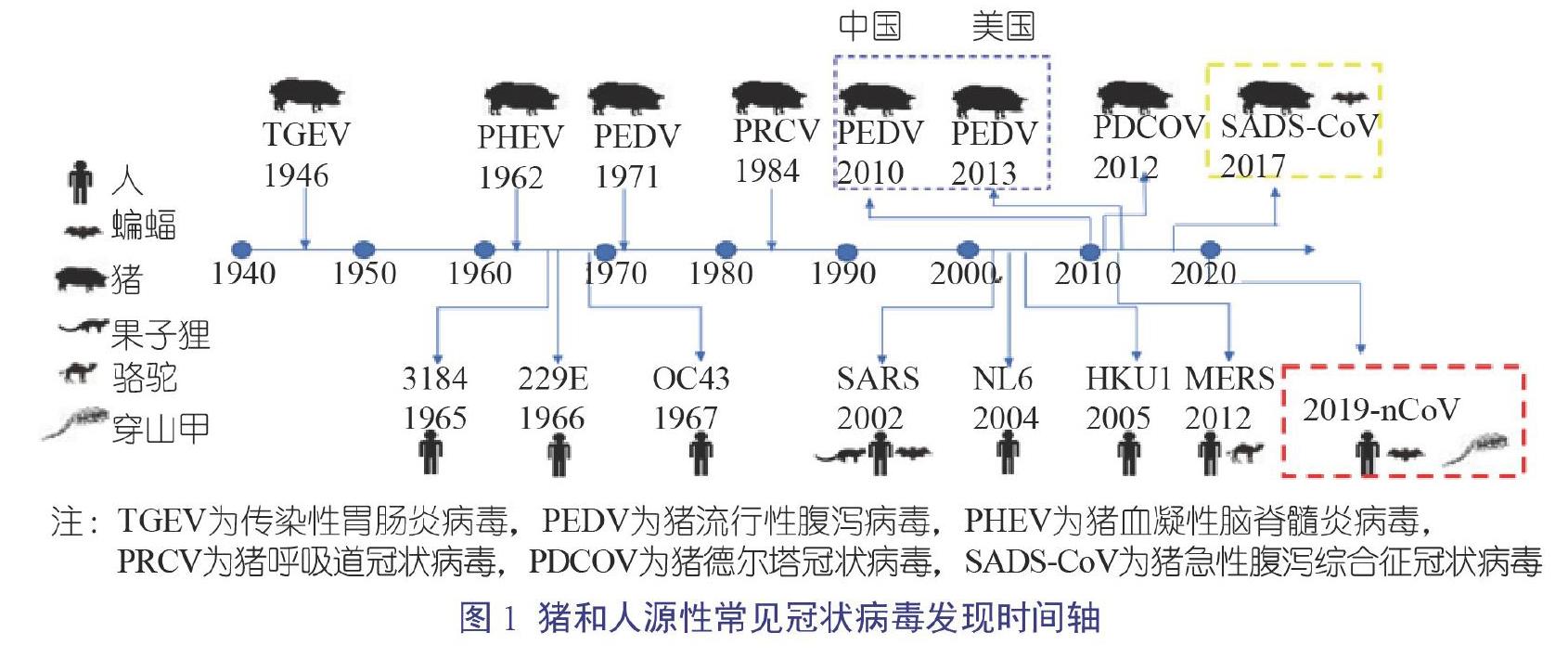
最早的人源性冠狀病毒于1965年從具有感冒癥狀的病人鼻腔分泌物中分離獲得,命名為人冠狀病毒B814。目前,常見的感染人的冠狀病毒有7種,分別為人冠狀病毒229E(229E)、人冠狀病毒OC43(OC43)、嚴重急性呼吸綜合征冠狀病毒(SARS-CoV)、人冠狀病毒NL63(NL63)、人冠狀病毒HKU1(HKU1)、中東呼吸綜合征冠狀病毒(MERS-CoV)和新型冠狀病毒(2019-nCoV)。其中,最為人們熟悉的當屬2002年底開始流行的SARS-CoV以及2019年底開始流行的2019-nCoV;另外,2012年始于沙特阿拉伯的MERS-CoV也是人源性冠狀病毒著名成員(圖1)[1-3]。
現有的試驗證據表明,229E、OC43、NL63和HKU1 4個冠狀病毒主要在人群中流行,可引起免疫抑制人群溫和的呼吸道癥狀,目前沒有發現其他動物作為病毒的儲存宿主。而SARS、MERS和2019-nCoV則存在其他自然宿主,有研究表明SARS病毒以果子貍作為中間宿主,將病毒從蝙蝠帶給人類,導致9%的感染者死亡;MERS則以駱駝作為病毒來源,傳染給人類,感染者的死亡率高達36%,是目前對人類最具威脅性的冠狀病毒。針對最新的2019-nCoV,華南農業大學Xiao等[4]以及香港大學Lam等[5]的研究表明,穿山甲很可能作為中間宿主將病毒從蝙蝠傳染給人來。幸運的是,目前為止沒有研究發現豬可以作為人源性冠狀病毒的宿主,因此豬對人類是安全的。
2? 豬源性冠狀病毒
豬源性冠狀病毒雖然不會感染人類,但是同樣會造成巨大的經濟損失,如2010年以來在中國養豬業流行的豬流行性腹瀉病毒(Porcine Epidemic Diarrhea Virus,PEDV)導致了100萬頭仔豬死亡,美國自2013年起也因PEDV損失10%的仔豬[3]。截至目前,從豬上共鑒別了6類常見冠狀病毒,分別為傳染性胃腸炎病毒(Transmissible Gastroenteritis Virus,TGEV)、PEDV、豬呼吸道冠狀病毒(Porcine Despiratory Corouavirus,PRCV)、豬血凝性腦脊髓炎病毒(Porcine Hemagglutinating Encephalomyelitis Virus,PHEV)、豬德爾塔冠狀病毒(Porcine Delta Coronavirus,PDCOV)和豬急性腹瀉綜合征冠狀病毒(Swine Acute Diarrhoea Syndrome Coronavirus,SADS-COV)。作為養豬人,自然要對豬源性冠狀病毒有所了解,保護好當下的金豬。
2.1 PEDV、TGEV和PRCV
大部分養豬人對PEDV和TGEV不陌生,這兩種病毒感染豬的腸道后均可引起腹瀉、嘔吐和死亡等癥狀,且會造成1周齡以下的發病仔豬極高的死亡率,尤其是PEDV。2010年12月以來PEDV新的變異毒株給全國豬場帶來了巨大的損失,發病仔豬死亡率達80%~100%,目前國內很多豬場仍然遭受該病毒的侵襲。TGEV于1946年在美國被鑒定出來,為豬上最早發現的冠狀病毒。目前該病毒在美國和歐洲的豬群中流行率較小,其中很大的原因歸咎于這兩個地區的豬群普遍感染PRCV。
PRCV作為TGEV在S基因片段大量堿基缺失后變異的病毒,主要感染豬的呼吸道,大多引起10~15周齡以上的豬呼吸道癥狀。研究發現大部分豬場為陽性狀態,但通常豬群處于亞臨床癥狀,在其他病毒和細菌存在的情況下,該病的臨床癥狀才明顯。如豬繁殖與呼吸綜合征病毒(Porcine Reproductive and Respiratory Syndrome Virus,PRRSV)和PRCV共感染可導致該病表現出明顯的臨床癥狀,兩者會共同加劇感染豬肺部病變。那么,為何TGEV在PRCV流行的歐洲地區會平靜下來?原因在于PRCV感染豬群后可誘導豬產生對抗TGEV的中和抗體,起到部分保護效果,而且這種保護力可以通過初乳或常乳保護新生仔豬,降低TGEV導致的仔豬死淘率(懷孕階段二次感染后母豬的乳汁可提供87.5%~100%保護率)[6]。
在國內,緣何TGEV仍然在豬場中普遍流行(山東規模化豬場流調顯示,TGEV感染率達18.52%),導致豬場損失慘重?
筆者分析認為:
⑴ PEDV的廣泛流行以及PEDV和TGEV的混合感染加劇了豬場的損失;
⑵ 國內豬繁殖與呼吸障礙綜合征(Porcine Reproductive and Respiratory Syndrome,PRRS)等免疫抑制性疾病導致豬群免疫力下降,母豬的母源抗體不能很好地保護仔豬(眾所周知,對PEDV和TGEV的防控,乳汁中的IgA發揮著關鍵的作用;引起母豬群免疫抑制的PRRS等疾病或者其他損害母豬黏膜免疫的因素可導致母源抗體水平降低)。
2.2 PDCoV、PHEV和SADS-COV
2012年,中國香港首次報道在豬上分離到PDCoV,感染豬的臨床癥狀類似于PEDV感染,表現為仔豬和母豬出現水樣腹瀉以及仔豬死亡(圖2),但感染仔豬的死亡率(30%~40%)低于PEDV引起的死亡率低,隨后內地也從腹瀉豬的臨床樣品中檢測到PDCoV,并也出現仔豬死亡。2014年末,肖少波研究團隊從湖北、河南、安徽和廣東等地的豬場腹瀉病例中分離到多個PDCoV分離株;中國農業科學院哈爾濱獸醫研究所馮力研究團隊對2014年1月至2015年11月收集的77家豬場的232份臨床腹瀉樣品進行了RT-PCR檢測,結果顯示10.34%(24/232)的樣品呈PDCoV陽性,且某些腹瀉病例僅僅分離到PDCoV。
1957年,加拿大第一個報道了豬感染PHEV后引發的臨床疾病,該病的主要癥狀包括4周齡以下的仔豬出現嘔吐、消瘦、腦脊髓炎以及死亡(圖3和圖4)[10-11]。目前,該病普遍存在于世界各地的豬群中,主要引起4周齡以下仔豬的死亡。PHEV是唯一一個會引起仔豬出現神經癥狀的冠狀病毒。在中國,豬群最早的發病時間是1985年,發病地是北京,近年來多個豬場報道了該病的發生;根據2014年吉林市某豬場的報道,發病豬主要出現嘔吐和神經癥狀,部分病豬伴隨著尖叫和拉稀,病豬最終均死亡[8-9]。流行病學調查顯示,雖然PHEV流行廣泛,但是發病案例較少,主要得益于母源抗體的保護。通常發病豬場都與后備母豬的大量引進有關,因此應引起豬場的重視。
SADS-COV為最近才發現的豬源性冠狀病毒,時間為2016年,發病地為廣東省清遠市的4家豬場,導致24 693頭仔豬死亡。該病毒引起的臨床癥狀和PEDV的基本一致,導致5日齡以下的仔豬出現急性拉稀和脫水,死亡率高達90%;然而,母豬等大齡豬感染后僅僅出現溫和型腹瀉,并且2 d內即可康復。研究發現,SADS-COV與HKU-2相關冠狀病毒的核酸序列相似性高達98.48%,有關數據表明該病毒可能來自于馬蹄蝠[12]。SADS-COV的發現提示我們養豬人:其他物種如蝙蝠的冠狀病毒對豬場的豬群具有一定的威脅。
3? 人源性和豬源性冠狀病毒之間的關系
如上文所述,目前的研究表明豬源性冠狀病毒不會感染人,而人源性冠狀病毒也不會在豬體內復制。如2004年有研究人員嘗試用SARS冠狀病毒感染6周齡仔豬,雖然宣告失敗,但是實驗動物血清SARS病毒轉陽。另外,實驗用仔豬屬于PRCV抗體陽性動物,因此可能會存在干擾[13]。無論如何,豬源性冠狀病毒對人類是安全的,目前生物安全級別非常高的豬場絕對是安全的地方。但是,我們要警惕豬作為載體將野生動物身上的病毒傳染給人類!
4? 豬源性冠狀病毒的防控
無論是人類還是動物,對傳染病的防控都需要遵循控制傳染源、切斷傳播途徑和保護易感動物/人的策略,因此生物安全應擺放在豬源性冠狀病毒病防控的首要位置。對豬場來說,一如既往地加強生物安全不僅是為了防控非洲豬瘟,也是為了防控豬的其他疾病,如豬源性冠狀病毒。
在養豬生產中,豬場保護易感動物的第一個方法是生物安全。當然,豬群感染冠狀病毒后,保護易感動物以減少損失同樣非常重要。在6類常見的豬源性冠狀病毒中,無論是PEDV和TEGV,還是PRCV、PDCOV、PHEV以及SADS-COV,它們均會對幼齡仔豬產生較大的危害,但成年豬感染后僅引起輕微的癥狀;因此,在疫情發生時,保護幼齡仔豬是豬場首要任務。由于幼齡仔豬的免疫系統未發育成熟,無法采用刺激新生仔豬使其產生免疫力的方法,因此養豬生產中保護幼齡仔豬的常見方法有:⑴刺激或補充新生仔豬干擾素,如給仔豬注射新城疫Ⅰ系疫苗產生的干擾素能夠減少PEDV引起的損失;⑵通過母源抗體保護仔豬。在這兩種方法中,效果最好的當屬第 2種,也最受大家青睞。
要利用母源抗體保護仔豬,首先要刺激母豬產生免疫力,然后通過初乳和常乳將保護力傳遞給仔豬。這種免疫保護具有一定的交叉性,如上文提到的歐洲地區的豬群廣泛感染后PRCV產生了對抗TEGV的保護力,因此這些地區的TEGV得到了很好控制。
如何刺激母豬產生針對冠狀病毒的保護力?通常有兩種做法:返飼和接種疫苗。目前尚無疫苗可以預防PDCOV、PHEV和SADS-COV的感染,但已有多個商品疫苗可預防PEDV和TEGV的感染,然而疫苗的免疫效果一直存在爭議。另外,2010年PEDV變異毒株的廣泛流行導致疫苗的免疫預防效果大打折扣。雖然返飼法在美國和泰國廣泛使用,但是國內的使用效果存在較大的差異。筆者以PEDV為例闡述冠狀病毒疫苗和返飼法,希望對大家有所啟示。
⑴ 母豬的胎盤組織結構決定了仔豬出生時體內沒有母源免疫球蛋白。在自身主動免疫發揮作用前,仔豬通過初乳和常乳中的抗體進行被動獲得性保護。此外,給新生仔豬接種PEDV疫苗進行免疫存在兩個問題:①母源抗體可干擾疫苗的免疫反應;②仔豬需要到達3周齡才能產生堅實的免疫力。
⑵ PED的防控依靠母源免疫力,主要依靠母豬乳汁中的IgA。初乳中含量最高的抗體為IgG,初乳轉換成常乳后,乳汁中的IgG含量急劇下降,此時含量最高的抗體為IgA,為主要免疫保護蛋白。仔豬從母豬初乳獲得IgG,可防止系統性感染;常乳中的分泌型IgA(sIgA)可產生局部被動免疫保護力,保護仔豬腸道。
⑶ IgG主要通過肌肉注射由中樞免疫系統產生。但是,對新生仔豬起主要保護作用的抗體是sIgA,主要由腸道黏膜免疫產生。研究表明,80%的IgA抗體分泌細胞(ASC)定植于腸道相關淋巴結中(腸道黏膜免疫面積非常大,鋪開猶如一個足球場。因此,sIgA主要由腸道黏膜免疫產生,小部分由中樞免疫產生)。母乳被動免疫保護哺乳仔豬主要依靠IgA漿母細胞傳遞到乳腺,并且sIgA在常乳中蓄積,這種傳遞被稱為“腸道-乳腺-sIgA軸”[14]。
⑷ IgA主要由腸道黏膜免疫產生,需要消化道受到活病毒的刺激。多項研究表明,乳汁中PEDV中和抗體的產生需要活病毒刺激豬的消化道,因此返飼比肌肉注射疫苗能更好地刺激母豬乳汁中sIgA的產生。
⑸ 滅活苗或亞單位(S蛋白)苗腸道外疫苗免疫陰性母豬,不能很好地誘導黏膜免疫的產生,但可促進IgG的產生(主要在血清和初乳中)。常乳中的IgG水平會迅速下降,給仔豬提供的乳源性免疫保護力非常有限。但是,在某些情況下也有例外,如血清中IgG的水平非常高,被大量傳遞到初乳中,并且在常乳中保持較高的水平,在新生仔豬出生后第1周可以提供持續片段性的保護力。
⑹ 返飼活病毒可以很好地誘導母豬產生sIgA,而非腸道免疫,如肌肉注射滅活苗或亞單位苗不能很好誘導陰性母豬產生sIgA或免疫保護力,但作為自然感染后加強免疫非常有效。因為經消化道感染后腸道源的IgA記憶細胞不僅僅在小腸中存在,同時在系統性中樞免疫器官如脾臟中也存在,所以第2次接種滅活苗后作用于中樞免疫同樣可以誘導sIgA的大量產生。
⑺ 臨床中部分豬場返飼失敗?常見原因如下:①返飼操作不當,如返飼材料的質量不合格,正確的做法是選取7日齡內出現典型癥狀的仔豬制作材料;返飼過程中出現高溫或太陽光殺死了病毒;②豬場的偽狂犬病和豬瘟不穩定;③亞健康母豬問題,如PRRS和霉菌毒素等導致的亞健康母豬,這部分母豬在返飼后并未產生保護力,或產生的sIgA水平低,不能很好地保護仔豬,導致PED在豬場中零星發生。
5? 結語
一場沒有硝煙的戰爭讓世人認識到冠狀病毒的厲害,看不見的敵人給世界的經濟帶來了巨大的損失。作為養豬人,冠狀病毒一點也不陌生,PEDV和TGEV這些大家熟知的冠狀病毒給豬場同樣帶來了巨大的經濟損失。此次的新型冠狀病毒同樣給養豬業帶來了警示:PDCOV、PHEV和SADS-COV等已經出現的和未出現的冠狀病毒時刻威脅著養豬業。PEDV等豬源性冠狀病毒的防控與母豬腸道黏膜免疫反應密切相關,腸道接觸活病毒才能激發母豬產生更多的sIgA,隨后通過腸道-乳腺-sIgA軸使乳汁含有更多的保護性抗體。因此,改善母豬腸道黏膜免疫對防控PEDV等冠狀病毒的感染非常重要。此外,豬場要避免PRRS和霉菌毒素等對母豬免疫力的破壞,防止PRRS引發豬場暴發PED。
參考文獻:(14篇,略)

