貴州油茶軟腐病病原檢測
秦紹釗,劉文霞,張柱亭
貴州油茶軟腐病病原檢測
秦紹釗,劉文霞,張柱亭
凱里學院大健康學院, 貴州 凱里 556011
貴州是我國主要油茶種植省份之一,油茶種植爆發病蟲害導致產量與質量急劇下降,其中軟腐病最為顯著。本文以油茶軟腐病中的粉芽孢桿菌為例,結合實時熒光PCR和巢式PCR技術,檢測油茶軟腐病病原菌。熒光PCR檢測過程為:設計反應程序與標準曲線,確定引物濃度、Mg2+濃度,將油茶軟腐病病原菌DNA作模板,通過特異性引物對L1/L2實現PCR擴增;在克隆質粒和病原菌XJ8-3-3懸液兩種模板中,對比實時熒光PCR和普通PCR的靈敏度;向健康植株葉片注射軟腐病粉芽孢桿菌懸液,培養5 d后,采集患病油茶植株根部、球莖等部位檢測軟腐病病原菌含量。巢式PCR檢測病原菌過程為:菌株活化放置PDA平板培養兩天并采集病原菌絲;根據油茶軟腐病的ITS序列和GenBank中,近似種的ITS序列差異設計B1與B2兩種特異性引物,經過預變性、變性等步驟完成擴增,擴增產物用于凝膠檢測。檢測結果如下:(1)兩種模板環境下,實時熒光PCR檢測靈敏度優于普通PCR技術100倍,葉柄組織的根部軟腐病病原菌含量最少;(2)引物B1與B2檢測油茶軟腐病病菌得到405 bp左右的條帶擴增產物,測序結果顯示發病菌株的堿基序列和粉芽孢桿菌序列吻合。結果顯示,兩種PCR技術均可檢測油茶軟腐病病原中的粉芽孢桿菌,為防治油茶軟腐病提供科學依據。
油茶; 軟腐病; 病原檢測
油茶是我國特有的油料植物樹種,收獲期產生大量茶油,茶油屬于不飽和脂肪酸油脂范疇,是有益于人體的油脂類型[1]。油茶樹除生產茶油以外,還能產生茶枯、茶殼等副產品[2],是醫療、生物醫藥、化學等領域的重要應用原料。因此,油茶的綜合使用價值不可忽視[3,4]。近幾年,油茶的種植優惠政策不斷出臺,國家的政策與財政支持下,油茶種植規模快速增加[5]。貴州是油茶種植大省,栽培的油茶品種一般為霜降、立冬子等系列[6]。大規模種植過程中,油茶病害頻發是導致油茶產量與品質降低的關鍵原因[7]。油茶的病害種類繁多,軟腐病為典型的油茶病害,發生頻率較高、發病規模較大。在不同栽培環境、氣候條件、管理方式影響下,油茶軟腐病爆發程度有所差異。油茶軟腐病的主要表現為落葉、葉片枯黃,因此又稱為葉枯病或者落葉病。軟腐病在油茶幼苗中發生的頻率較高,造成植株落葉、無花芽分化,最終降低茶油產量。由于茶農不具備良好的軟腐病鑒別能力,導致軟腐病大規模爆發[8]。因此設計相關檢測方法至關重要。
為改善油茶種植品質、提升油茶利用率,本文設計實時熒光PCR與巢式PCR技術,檢測油茶軟腐病的病原,從預估油茶發生軟腐病的角度出發,需了解軟腐病病原菌作用機制,掌握油茶軟腐病病原信息。本文以油茶軟腐病的粉芽孢桿菌為例展開研究,兩種PCR技術均可快速、準確檢測出油茶軟腐病的病原菌,在預防與治理油茶軟腐病方面具有重要意義。
1 材料與方法
1.1 材料來源
實驗研究對象為貴州某茶園示范基地,按要求采集油茶植株葉片樣本作為油茶軟腐病病原鑒定材料。收集到供試油茶軟腐病病菌在實驗室中分離、檢測、存儲。圖1為油茶軟腐病發病葉片狀態。

圖 1 油茶軟腐病葉片
1.2 材料處理
粉芽孢桿菌為本次研究的供試菌種,在實驗室中完成分離、鑒定和提取,借鑒貴陽科技公司出品的說明書完成細菌總DNA提取。
1.2.1 實時熒光PCR檢測技術的反應程序與標準曲線制作在前人研究基礎上,改進基于熒光PCR技術檢測茶油軟腐病病原的反應體系,確定引物濃度為0.1、0.2、0.3 μmol·L-1,Mg2+濃度為2、4、6 mmol·L-1。SYBR Green Ⅰ反應體系包括四部分內容,一是兩個由上海生物科技公司生產的SYBR Green Mater Mix,二是0.2 μmol·L-1的引物對L1/L2,三是4 mmol·L-1Mg2+,四是將適量的滅菌ddH2O添加至模板,20 μL時終止。在日本儀器公司生產的熒光PCR儀器中,完成PCR反應擴增。
檢測模板為油茶軟腐病病原菌總DNA,通過特異性引物對L1/L2實現PCR擴增,對擴增完成的片段回收并純化,和大連公司生產的pMD18-T載體連接并轉化成大腸桿菌DH5α,提取結果中的質粒在上海某生物工程公司測序。質粒標準品為稀釋5次后的陽性克隆質粒2.4 ng·μL-1,熒光PCR反應DNA濃度如下:2.4×10-1ng·μL-1、2.4×10-2ng·μL-1、2.4×10-3ng·μL-1、2.4×10-4ng·μL-1、2.4×10-5ng·μL-1。最終構建實時熒光PCR檢測的標準曲線橫坐標為DNA濃度的對數值,縱坐標為Ct值。
1.2.2 巢式PCR菌株處理油茶粉芽孢桿菌株活化后放置在PDA平板上培養兩天,基于CTAB方法采集病原菌絲,提取時需謹慎小心以免破壞菌絲[9]。本次實驗提取油茶發病組織方法如下:在每個新發病組織添加0.5 mol/L的NaOH 50μL,以12000 r/min速度對研磨完成的組織試樣離心,持續5 min,混合48 μL濃度為0.1 mmol/L的Tris與5 μL上清液,以備后續使用。
1.3 培養與檢測
1.3.1 實時熒光PCR技術
(1)實時熒光PCR和普通PCR技術的靈敏度對比基于克隆質粒DNA的靈敏度檢測設置:實時熒光PCR檢測與普通PCR檢測的模板均為配比完成的5種濃度的克隆質粒DNA,檢測容量為1 μL,檢測完畢基于ddH2O的對照結果判斷實時熒光PCR檢測技術檢測克隆質粒的靈敏程度。
基于病原菌XJ8-3-3懸液的靈敏度檢測設置:檢測模板為稀釋5個梯度的油茶軟腐病菌活菌的懸液,體積為3.8×108cfu·mL-1;配比濃度為3.8×107cfu·mL-1、3.8×106cfu·mL-1、3.8×105cfu·mL-1、3.8×104cfu·mL-1、3.8×103cfu·mL-1、3.8×102cfu·mL-1、體積為3 μL的稀釋菌液,輔助完成熒光PCR檢測和普通PCR檢測。
(2)實時熒光PCR發病植株檢測采集健康無病患的油茶植株葉片,向健康植株葉片注射軟腐病粉芽孢桿菌懸液,容量為1 mL、濃度為108cfu·mL-1,注射部位為植株假莖以下部位,接近于球莖的位置;設置空白對照組葉片,向其注射無菌水,兩組樣品注射完畢存儲在恒溫光照培養箱中,溫度不高于26.5 °C;以晝夜交替的模式施加光照,培養周期為5 d。5 d后采集兩種培養樣品,采集患有軟腐病的油茶植株的根部、球莖、中部假莖、葉柄、葉尖等部位待檢測[10]。提取待檢測樣品的DNA后,即可開始PCR檢測。
1.3.2 巢式PCR檢測技術
(1)標準PCR反應體系與反應條件構建基于巢式PCR技術檢測油茶軟腐病病原時設計了B1與B2兩種特異性引物,設計依據為油茶軟腐病的ITS序列和GenBank近似種的ITS序列間的差異性,同樣在上海某生物工程公司中合成。引物序列如下:B1:5'GGTCCGTAGGTGAACCT3';B2:3'GAGCGCTTCGGCCGGGG5'。

表 1 PCR反應溶液構成
四個階段的反應條件如下:(1)93 °C環境下預變性4.5 min;(2)37個循環,此時執行93 °C變性1 min,61 °C退火30 s,71 °C延伸1 min;(3)71 °C持續延伸10 min;(4)4 °C保存。
(2)巢式PCR擴增第一輪反應物為ITS區通用的引物ITS1/ITS4,模板為1 μL PCR產物,B1、B2與模板組合完成巢式PCR擴增。表2為詳細的反應程序。

表 2 Nested-PCR反應程序
擴增產物存儲在4 °C環境中,混合1%的瓊脂糖凝膠與3 μL的擴增產物,在28 min的電泳作用下,在凝膠成像系統中檢測結果,并提取圖像。
2 結果與分析
2.1 油茶軟腐細菌實時熒光PCR檢測體系的建立
基于實時熒光PCR技術檢測油茶軟腐病病原時,變化引物的濃度與Mg2+濃度改進檢測效果。經過3次循環重復得到如下結果,擴增效率在92%~102%之間的前提條件是:引物濃度為0.1 μmol·L-1、0.2μmol·L-1、0.3 μmol·L-1、Mg2+濃度為4 mmol·L-1。上述結果趨近于理論擴增效率,所以將4 mmol·L-1作為Mg2+的最佳濃度。然后選取最佳引物,設置引物濃度0.1 μmol·L-1時,濃度較低導致模板定量誤差增加,因為擴增曲線提前收斂;將引物濃度更改為0.3 μmol·L-1時,擴增效率在108%以上,該引物濃度過高;據此將0.2 μmol·L-1作為引物的適中濃度,此時的擴增效率趨近于1,且處于合理的擴增啟動時機。最終將0.2 μmol·L-1、4 mmol·L-1作為改進的引物濃度與Mg2+濃度。
實時熒光PCR擴增體系,完成5個稀釋梯度的克隆質粒的熒光PCR擴增,結果如圖2所示。由圖可知:模板采用2.4×10-1ng·μL-1、2.4×10-2ng·μL-1、2.4×10-3ng·μL-1、2.4×10-4ng·μL-1、2.4×10-5ng·μL-15種DNA濃度時,得到的擴增曲線呈現相對光滑、較大傾斜度的狀態,同時循環閾值間隔勻稱,呈現規律分布狀態;比較之下,滅菌ddH2O未形成擴增曲線,由此得到實時熒光PCR檢測體系的檢測油茶軟腐病病原菌DNA的靈敏度為2.4×10-5ng·μL-1。
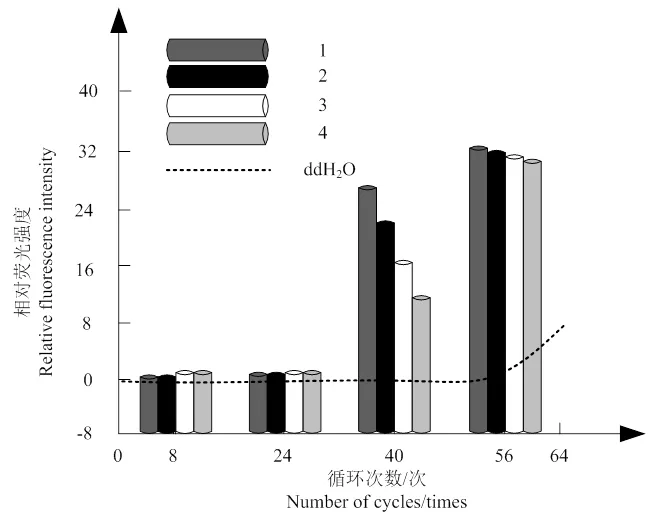
圖 2 實時熒光擴增曲線
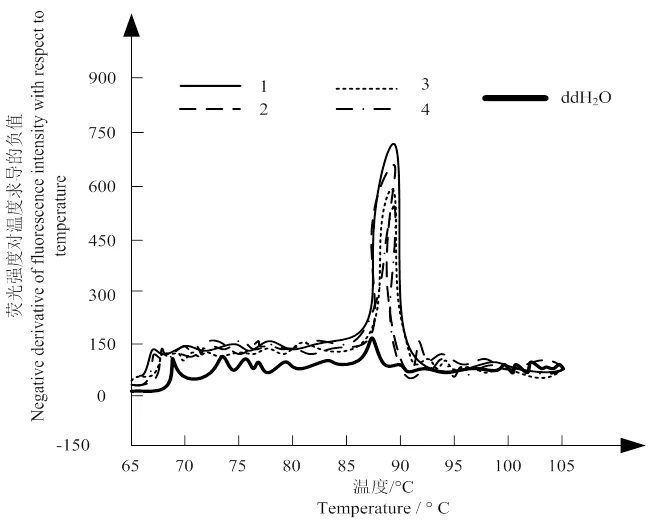
圖 3 溶解曲線分析

圖 4 標準曲線
圖3為深層次溶解的曲線。若出現引物二聚體則表明溶解曲線處于異常狀態,影響擴增效果;引物二聚體存在的表現為濃度模板產物的溶解曲線存在多樣化的峰值。圖3中并未出現多個曲線峰值,僅在溫度約為78 °C時出現一次溶解峰值,因此證明該溶解過程中不存在引物二聚體,溶解效果較好。
圖4為初始模板量對數和Ct循環數間的關系標準曲線,采用=-3.326+23.41描述標準曲線中克隆質粒DNA濃度的對數值和Ct值間的線性關系,其中,擴增效率與相關系數分別為94.3%、2=0.986。基于圖1~3結果可知,本研究確定的實時熒光PCR檢測體系、反應環境有效,可用于檢測油茶軟腐病病原。
2.2 實時熒光PCR技術檢測結果分析
2.2.1 實時熒光PCR和普通PCR靈敏度對比圖5為普通PCR擴增結果,為擴增模板是克隆質粒DNA 10倍稀釋時的檢測結果。模板為5個濃度的樣品。由普通PCR擴增結果可知,2.4×10-1ng·μL-1、2.4×10-2ng·μL-1、2.4×10-3ng·μL-1三個濃度的樣品可擴增出清晰靶帶,2.4×10-4ng·μL-1濃度樣品擴增的靶帶不清晰,2.4×10-4ng·μL-1濃度樣品并未擴增出靶帶。據此確定普通PCR技術的檢測靈敏度為2.4×10-3ng·μL-1,而實時熒光PCR檢測的靈敏度為2.4×10-5ng·μL-1,由此可知,實時熒光PCR檢測靈敏度約為普通PCR檢測的100倍。
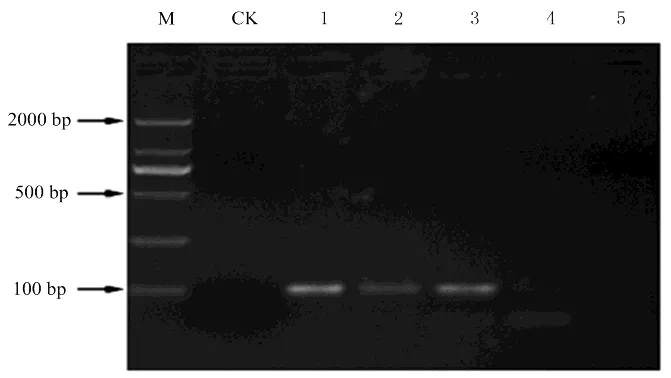
圖 5 普通PCR檢測靈敏度
變換檢測模板,再次對比兩種檢測技術的靈敏度。普通PCR技術與實時熒光PCR技術靈敏度第二次對比模板為油茶軟腐病菌活菌XJ8-3-3懸液,實時熒光PCR和普通PCR檢測的軟腐病病原菌濃度分別為3.8×104cfu·mL-1、3.8×102cfu·mL-1,所以實時熒光PCR檢測靈敏度更強,且優于普通PCR技術100倍。
2.2.2 軟腐病病原菌含量檢測分析陽性檢測樣品為發病植株生長點腐爛葉柄組織、根部組織、球莖組織、中部假莖組織、葉片尖部等部分,陽性對照樣品為不存在軟腐病的健康油茶植株組織,檢測對象為植株不同組織部分的DNA。反復測試三次,記錄實驗結果見表3與表4,表3為油茶植株不同部位組織DNA出現擴增信號時的Ct值,表4為對應的DNA含量。數據顯示,葉柄組織的根部軟腐病病原菌含量最少,球莖和中部假莖的軟腐病病原菌含量較多,約達到93.74 pg·μL-1、96.85 pg·μL-1。
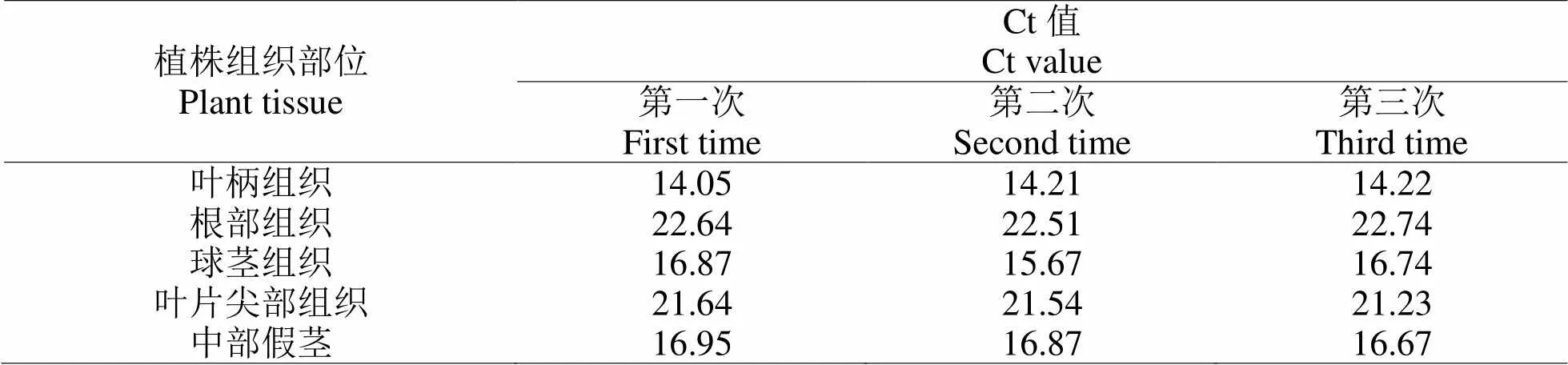
表 3 植株不同組織DNA擴增時的Ct值
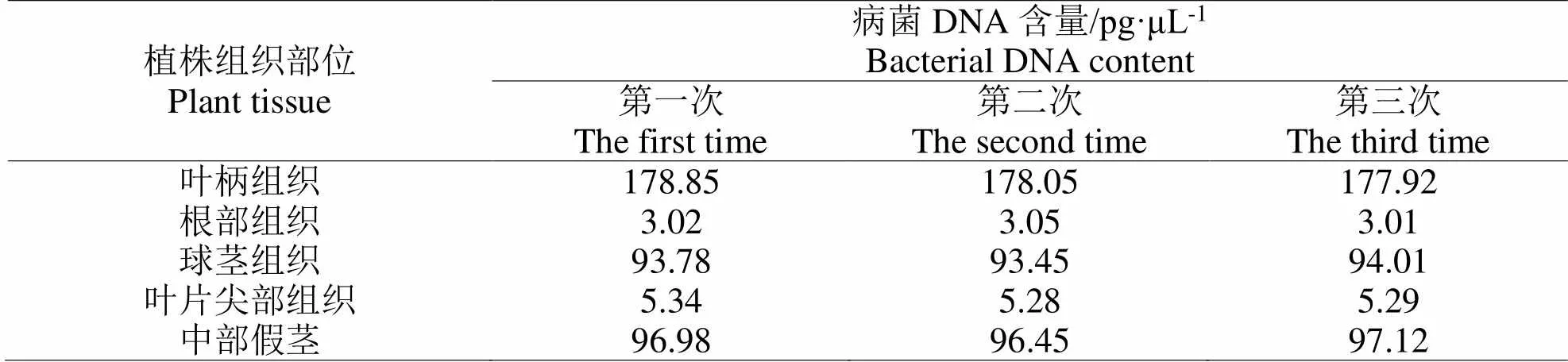
表 4 對應部位的DNA含量
觀察軟腐病注射5 d后的油茶植株葉片情況,整個葉片基本腐爛呈黑色,球莖內部逐漸發生清晰的褐色病變,假莖部分也呈現部分腐爛狀態,相對而言,葉片的根部基本未發生病變,該結果和基于實時熒光PCR檢測的病原菌檢測結果吻合,病菌DNA含量高的組織發生病變的程度較大。
2.3 巢式PCR技術檢測結果分析
2.3.1 引物B1與B2的特異性證明利用引物B1與B2檢測油茶軟腐病病菌能夠得到擴增產物,為405 bp左右的條帶,PCR擴增結果如圖6所示。由此可知引物B1與B2具有特異性,可用于辨別油茶軟腐病病原菌種類。

圖 6 特異性引物B1/B2對PCR擴增產物的電泳分析
2.3.2 發病組織病原檢測基于巢式PCR技術檢測人工接種的油茶軟腐病植株DNA,取2個發病樣品、4個健康樣品,檢測結果如下:2個發病樣品中擴增出405 bp左右的特異性條帶,圖7為擴增檢測結果;但是健康的樣品中并未擴增出條帶。對擴增結果切膠回收測序,測序結果顯示兩個發病菌株的堿基序列一致,和粉芽孢桿菌的序列排列情況吻合。由此可證,巢式PCR技術可迅速檢測油茶軟腐病病原菌。
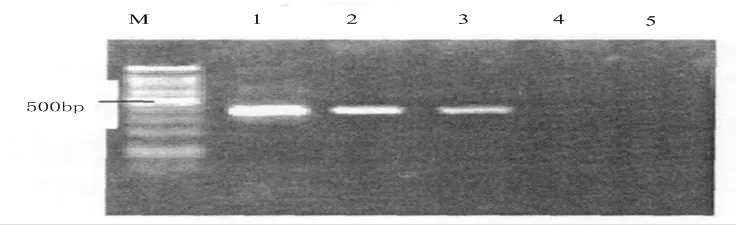
圖 7 擴增檢測結果
3 討論
本次研究采用實時熒光PCR技術檢測油茶軟腐病病原時,以劉鵬等人的檢測實驗為前提改進PCR擴增體系,構建適合油茶軟腐病病原粉芽孢桿菌的檢測環境[11]。設置了菌液和克隆質粒兩種形式的檢測模板驗證實時熒光PCR和普通PCR的檢測靈敏度,結果顯示,實時熒光PCR檢測靈敏度約為普通PCR的100倍之多,該結果和以往專家研究結果吻合。另外,基于實時熒光PCR技術檢測了油茶軟腐病植株的不同組織部位,其中球莖組織和中部假莖組織的軟腐病病原菌含量較多[12],約達到93.74 pg·μL-1、96.85 pg·μL-1,而根部組織的DNA含量最低。
基于巢式PCR技術擴增粉芽孢桿菌DNA,同時測定DNA的序列。設計引物B1、B2,聯合使用ITS1/ITS4引物對擴增檢測軟腐病粉芽孢桿菌,測試結果顯示,巢式PCR可快速檢測油茶軟腐病病原的粉芽孢桿菌。基于特異性引物的PCR檢測技術是近年來使用頻率較高的分子檢測技術,普遍應用于植物病源菌的檢測研究[13]。真菌核糖體基因ITS序列在不同真菌中呈現較高的變異特性、在真菌種內呈現較優的穩定性,是理想的真菌分子檢測靶序列[14]。因此,本次研究基于巢式PCR擴增油茶軟腐病病原菌的核糖體ITS基因,以檢測軟腐病的病原菌,該方式在植物病病原檢測中得到廣泛應用,取得較好的檢測效果[15],為預測油茶軟腐病發病狀態、趨勢提供可靠依據。
4 結論
本次研究以貴州茶園的油茶植株為對象,利用兩種差異性PCR技術檢測油茶軟腐病病原菌,結果證明實時熒光PCR技術和巢式PCR技術均能快速檢測到油茶軟腐病的粉芽孢桿菌,靈敏度較高。此次研究為檢測貴州油茶軟腐病粉芽孢桿菌提供了兩種可靠的研究途徑,根據實驗結果向茶農傳授更多的油茶軟腐病癥狀表現和防治知識,對于降低油茶軟腐病發病幾率具有重要意義。
[1] 文亞雄,劉君昂,劉小平,等.不同間作模式對油茶幼林病蟲害發生的影響[J].經濟林研究,2016,34(1):129-134
[2] 魏蜜,路露,李春琪,等.株油茶病害拮抗真菌的鑒定、生物學特性及拮抗作用研究[J].河南農業科學,2016,45(8):74-80
[3] 李河,李楊,蔣仕強,等.湖南省油茶炭疽病病原鑒定[J].林業科學,2017,53(8):43-53
[4] 陳志偉,龍夢琪,何小勇,等.油茶幼林復合經營系統中3種農作物的生長節律研究[J].浙江林業科技,2016,36(6):52-57
[5] 李楊,李河,周國英,等.油茶新炭疽病原鑒定及致病性測定[J].生物技術通報,2016,32(6):96-102
[6] 吳天樂,陳藝,馬力,等.一株油茶炭疽病病原拮抗細菌的分離與鑒定[J].湖南林業科技,2016,43(5):62-66
[7] 龍滿生,歐陽春娟,劉歡,等.基于卷積神經網絡與遷移學習的油茶病害圖像識別[J].農業工程學報,2018,34(18):202-209
[8] 馮潔.植物病原細菌分類最新進展[J].中國農業科學,2017,50(12):2305-2314
[9] Yuan JJ, Wang CZ, Chen HX,. Identification and Detection of AdulteratedAbel. Oils by Near Infrared Transmittance Spectroscopy[J]. International Journal of Food Properties, 2016,19(2):300-313
[10] 白劍宇,宋峰惠,吳正保,等.新疆紅棗軟腐病病原菌的鑒定[J].新疆農業科學,2017,54(8):1475-1480
[11] Borsu L, Intrieri J, Thampi L,. Clinical Application of Picodroplet Digital PCR Technology for Rapid Detection of EGFR T790M in Next-Generation Sequencing Libraries and DNA from Limited Tumor Samples[J]. Journal of Molecular Diagnostics, 2016,18(6):903-911
[12] 王星,周紅寧.我國瘧原蟲PCR常用檢測技術研究進展[J].中國病原生物學雜志,2018,13(3):318-321
[13] 劉學錄,童金鳳,馬振剛.蜜蜂主要病害及其病原PCR檢測研究進展[J].南方農業學報,2016,47(1):147-152
[14] Zhao Y,Xia QY,Yin YP,Comparison of Droplet Digital PCR and Quantitative PCR Assays for Quantitative Detection ofSub sp. citri[J]. Plos One, 2016,11(7):e0159004
[15] 程穎超,康華軍,石延霞,等.辣椒疫霉菌RT-PCR檢測技術的建立及應用[J].園藝學報,2018,45(5):997-1006
Detection of Soft Rot Pathogen ofin Guizhou Province
QIN Shao-zhao, LIU Wen-xia, ZHANG Zhu-ting
556011,
Guizhou is one of the main provinces ofin China. The outbreak of diseases and pests inresulted in a sharp decline in yield and quality, among which soft rot disease was the most significant. Takingas an example, the pathogen of soft rot ofwas detected by real-time fluorescent PCR and nested PCR. The detection process of fluorescent PCR was as follows: designing reaction procedure and standard curve, determining primer concentration and Mg2+concentration, using DNA of soft rot pathogen ofas template, amplifying L1/L2 by specific primers; comparing the sensitivity of real-time fluorescent PCR and ordinary PCR in two templates of cloned plasmid and XJ8-3-3 suspension of pathogen; injectingsuspension of soft rot into healthy plant leaves after cultivation for 5 days, the root and corm of diseasedplants were collected to detect the content of pathogenic bacteria of soft rot. Nested-PCR was used to detect pathogenic bacteria. The strains were cultured on PDA plate for two days and collected pathogenic hyphae. Two specific primers, B1 and B2, were designed according to the ITS sequence difference of the similar species in the ITS sequence ofsoft rot and GenBank. The amplified products were used for gel detection after pre-denaturation and denaturation. The results were as follows: (1) Under the two template environments, the sensitivity of real-time fluorescent PCR was 100 times higher than that of common PCR technology, and the content of pathogenic bacteria of soft rot in petiole tissue was the lowest; (2) primer B1 and B2 were used to detect soft rot pathogen of, and 405 BP band amplification products were obtained. The sequencing results showed that the base sequence of the pathogenic strain was identical with that of Bacillus farinosa. The results showed that both of the two PCR techniques could detectin the pathogen of soft rot of, and provide scientific basis for the prevention and control of soft rot of.
;oft rot; pathogen detection
S794.4
A
1000-2324(2020)03-0420-06
10.3969/j.issn.1000-2324.2020.03.006
2019-03-12
2019-04-05
貴州省科學技術基金(黔科合J字[2015]2132號);貴州省科學技術聯合基金(黔科合LH字[2014]7240號)
秦紹釗(1981-),男,博士,副教授,研究方向:植物病害鑒定與綜合防控技術研究. E-mail:sz_qin@163.com

