免疫檢驗分析質量控制在臨床免疫檢驗中的作用分析
薛曉陽
(吉林大學基礎醫學院,吉林 長春)
0 引言
在臨床各類疾病診斷及治療中,免疫學檢驗結果均為重要的參考指標,免疫指標的準確性會對后續治療方案的制定及療效評估產生直接影響[1]。為進一步提升免疫指標檢驗準確性,實驗室實施了室內與室間的質量控制管理,于臨床免疫檢驗過程中,采取標準化質量控制流程,其中室內控制以免疫檢驗操作人員的檢驗數據結果作為可靠的評價標準,室間質量控制則重點關注免疫指標結果數據中的誤差,對實驗室出具的免疫檢驗結果進行了有效校正[2]。免疫指標質量控制管理能夠有效提升檢測結果準確性與可靠性,臨床免疫檢驗結果也得到了科學性的質量控制,進而對臨床診療產生有利影響。本校實驗室自2019 年5 月開展了免疫指標的質量控制管理,并分析了免疫檢驗質量控制前后各項免疫指標變化,現報道如下。
1 資料與方法
1.1 一般資料
選取2019 年5 月至2019 年10 月實驗室開展質量控制后接受免疫檢驗的228 份標本納入研究組,檢測者中男110例,女118 例,年齡18-79 歲,平均(51.42±2.64)歲,選取2018 年11 月至2019 年4 月實施質量控制前接受免疫檢驗的186 份標本納入對照組,其中檢測者中男92 例,女94 例,年齡18-81 歲,平均(51.13±2.59)歲。納入標準:所有檢測者年齡均介于18-85 歲,均為醫院接診患者,臨床資料完整,意識清晰,可配合調查,對此項研究知情同意,且依從性良好。但需排除存在凝血功能障礙或合并精神疾病的患者。兩組基線資料差異均無統計學意義(P>0.05)。
1.2 檢驗方法
對照組依據常規流程進行免疫檢驗,依次按照采樣、送檢、檢驗、儀器分析、出具報告的流程實施各項免疫指標的檢驗[3]。
研究組則開展免疫檢驗分析質量控制管理,方法如下:(1)組織檢驗人員培訓。所有免疫檢驗人員均需具備資格認證書,根據醫院臨床檢驗工作的實際特點,定期開展綜合性培訓,包括標本采集、標本處理、檢驗與校對、報告出具與核查等多個環節相關知識的培訓,確保檢驗人員能夠熟練掌握各個環節的流程與實踐要點,尤其是檢驗項目不同時,應確保各流程的操作也按照相應標準執行樣本處理。(2)按國家標準進行儀器校準。免疫檢驗過程中涉及的器械設備,均需定期進行校準與核對,嚴格按照國家計量監督部門頒布的相關規范標準實施核準,確保儀器高標準運行,提升檢測結果的準確性。(3)操作流程規范化管理[4]。血液標本采集時應確保患者為清晨空腹狀態,病情穩定的患者最好于血樣采集后用藥,以避免藥物吸收影響檢驗結果。標本采集后盡早送至檢驗科,要求送檢時間控制在2h 內。檢驗過程中嚴格按照檢驗項目操作規范執行,還需記錄指標檢測相關的原始數據,于檢測完成后予以計算分析,按照臨床規范出具檢驗報告單。(4)室內質控措施[5]。如發生檢測結果出現異常,應回顧分析整個檢驗過程,找出可能影響檢測結果準確性的相關因素,詳細記錄質量失控原因與處理過程。在消除影響因素并校準儀器后重新采樣再次檢驗,同時更換試劑和儀器,與再次檢驗結果進行比對,所得檢測結果出現的偏差需處于允許范圍內。(5)室間質控。定期參與本省臨檢中心開展的室間質控評價,臨檢中心發放特定的質控樣本,由參與質控評價的科室在規定時間內完成檢驗工作[6]。經統計分析后回報檢驗結果,臨檢中心按照統一的標準對室間質控質量及科室工作能力加以評價,通過室間質控及時發現科室免疫檢驗存在的問題并提出改進策略,以實現不斷提升檢驗水平的目標。
1.3 觀察指標
標本采集質量。統計比較兩組的合格標本比例,判定依據如下:同時滿足以下三個標準為合格:①清晨空腹狀態下采集靜脈血,采血量4-5ml 或充分滿足檢查需求;②血液標本采集后于2h 內送檢;③標本檢測時血液標本未發生溶血或凝固現象。
免疫檢驗結果。比較兩組胰島素抗體(insulin antibody,IAb)、甲 胎 蛋 白(alpha fetoprotein,AFP)、糖 類 抗 原199(carbohydrate antigen -199 CA-199)、糖類抗原125(carbohydrate antigen-125,CA-125)、癌 胚 抗 原(carcinoembryonic antigen,CEA)、胃癌抗原(cancer antigen724,CA724)、血清C 肽(C-P 指數)、血清胰島素(insulin,INS)等指標水平。
臨床療效。以免疫指標變化判定療效,標準如下:免疫指標恢復至正常為顯效;免疫指標較治療前改善為好轉;未達到上述指標為無效,總有效率為好轉與顯效患者所占比例。
1.4 統計學分析
本組研究采用SPSS 24.0 統計學軟件進行數據的分析和處理,計數資料采用(n/%)表示,采用χ2檢驗,計量資料采用均數±標準差()表示,采用t 檢驗,P<0.05 為差異具有統計學意義。
2 結果
2.1 兩組標本采集合格率比較
研究組合格標本223 份,占97.81%,不合格5 份,占2.19%,對照組合格標本174份,占93.55%,不合格標本12份,占6.45%,組間標本采集質量差異有統計學意義(χ2=4.717,P=0.029)。組內所有不合格標本均進行了二次采樣。
2.2 兩組免疫指標檢測結果比較
研究組IAb、AFP、CA-199、CA-125、CEA、CA724、C-P指數、INS 免疫指標水平均較對照組降低,差異有統計學意義(P<0.05),見表1。
表1 兩組免疫指標檢測結果比較
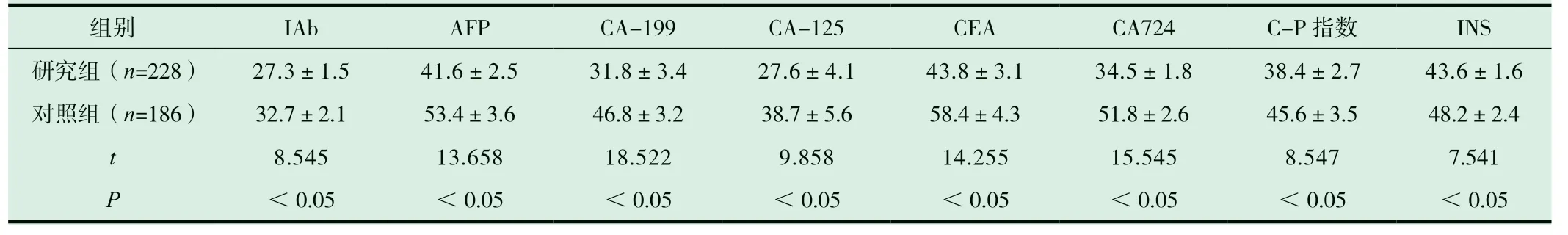
表1 兩組免疫指標檢測結果比較
組別 IAb AFP CA-199 CA-125 CEA CA724 C-P 指數 INS研究組(n=228) 27.3±1.5 41.6±2.5 31.8±3.4 27.6±4.1 43.8±3.1 34.5±1.8 38.4±2.7 43.6±1.6對照組(n=186) 32.7±2.1 53.4±3.6 46.8±3.2 38.7±5.6 58.4±4.3 51.8±2.6 45.6±3.5 48.2±2.4 t 8.545 13.658 18.522 9.858 14.255 15.545 8.547 7.541 P <0.05 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05
2.3 兩組有效率比較
研究組有效率為94.74%,高于對照組(P<0.05),見表2。
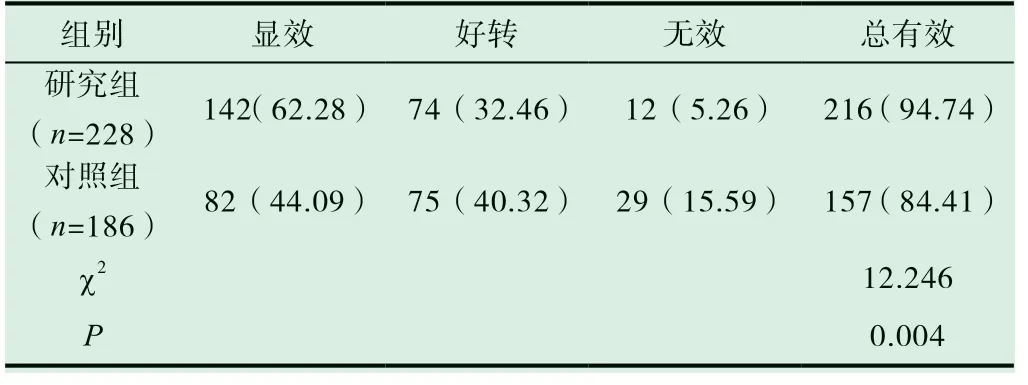
表2 兩組有效率比較[n(%)]
3 討論
檢驗科為院內重要的科室,檢測結果為臨床疾病診斷、用藥治療、療效評估的重要依據,檢驗質量的高低關乎科室技術水準,也是影響醫院整體形象的重要指標[7]。加強對檢驗工作的質量控制,能夠確保檢測結果準確性,為臨床診療活動提供了可靠的數據支持。
臨床多項研究均顯示[8],免疫檢驗中加強質量控制,對于提高免疫檢驗準確性具有積極影響。該研究指出,加強免疫檢驗的質量控制管理,有效縮短了標本送檢時間,提高了標本采集及檢驗的準確度,避免了臨床操作等外界因素對檢驗結果的影響,有利于提升檢驗流程科學性、檢測結果準確性。多種內源性因素與外源性因素均可影響免疫檢驗結果。上述因素可能對免疫檢驗結果產生一定程度的影響,對于可控因素,必須加強影響因素的質量控制管理,以確保免疫檢驗結果的準確性與科學性[9]。
本次研究顯示,質量控制管理中加強人員培訓措施有利于提升檢驗人員整體技能操作水平,使其熟練掌握各項免疫檢驗指標的檢測流程,滿足新形勢下免疫學檢驗對人才的需求[10]。確保儀器準確性為獲取可靠數據的基礎,儀器校準為主要措施,規范免疫檢驗流程為關鍵。同時配合室間質控與室內質控,能夠督促科室及時查找影響檢驗質量的因素,從而不斷提升科室檢驗質量[11]。
綜上所述,臨床免疫檢驗中加強免疫檢驗分析過程的質量控制,有助于提高標本采集成功率,提升檢測結果準確性,為臨床診療方案制定提供可靠依據,進而改善患者預后[12]。

