氧化還原滴定法在分析化學(xué)中的應(yīng)用
張靜萍 侯繼萍(青海省水環(huán)境監(jiān)測中心,青海 西寧810003)
1 氧化還原反應(yīng)的概述
在反應(yīng)過程中,物質(zhì)之間發(fā)生了電子轉(zhuǎn)移或偏移的一類反應(yīng)稱為氧化還原反應(yīng)。
1.1 氧化還原反應(yīng)的特點(diǎn)
①有電子得失(轉(zhuǎn)移),價(jià)態(tài)發(fā)生變化,且數(shù)目不固定
②復(fù)雜反應(yīng),由基元反應(yīng)組成,分步進(jìn)行
③反應(yīng)條件苛刻
④反應(yīng)速度慢,必須克服反應(yīng)勢能才能反應(yīng)
1.2 氧化還原反應(yīng)的速度及影響因素
1.2.1 反應(yīng)物的濃度對反應(yīng)速度的影響
反應(yīng)物的濃度越大,反應(yīng)的速度越快,測定高錳酸鹽指數(shù)時(shí),用草酸鈉標(biāo)定高錳酸鉀時(shí),必須在強(qiáng)酸性溶液中進(jìn)行,也就是增加草酸鈉的濃度或提高溶液的酸度,都可以使反應(yīng)速度加快。
1.2.2 溫度對反應(yīng)速度的影響
實(shí)驗(yàn)證明:一般溫度每升高10℃,反應(yīng)速度可增加2~3倍,常溫下高錳酸鉀與草酸鈉之間反應(yīng)速度緩慢,但加熱卻能加快反應(yīng)速度。但溫度不能過高,否則會引起草酸的分解,見下式:
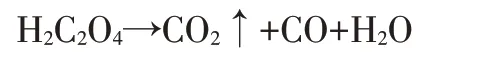
滴定完畢時(shí),溶液的溫度也不應(yīng)低于60℃,以保證監(jiān)測數(shù)據(jù)的準(zhǔn)確性。
1.2.3 催化反應(yīng)對反應(yīng)速度的影響
用草酸鈉標(biāo)定高錳酸鉀溶液的濃度時(shí),利用Mn04-與C2042-反應(yīng)后生成的微量MnO2作催化劑,加快了反應(yīng)的進(jìn)行,這是自動催化的作用。就是開始滴定時(shí)反應(yīng)速度
較慢,隨著滴定劑的不斷加入,其催化劑的濃度逐漸增多,反應(yīng)速度就逐漸加快,隨后反應(yīng)物的濃度越來越低,反應(yīng)速度由逐漸降低,到達(dá)滴定終點(diǎn)。
2 氧化還原滴定法
2.1 氧化還原滴定的基本原理
2.1.1 氧化還原滴定曲線
在進(jìn)行氧化還原滴定時(shí),隨著滴定劑的加入和反應(yīng)的進(jìn)行,氧化型和還原型物質(zhì)的濃度逐漸變化,電極電勢也隨之不斷發(fā)生改變,這種變化可以用氧化還原滴定曲線來表示。下面以1mol / LH2SO4介質(zhì)中,以0.1mol / LCe(SO4)2溶液滴定20mL0.1mol/LFeSO4溶液為例,討論氧化還原滴定曲線。
滴定的離子反應(yīng)Ce4++Fe2+=Ce3++Fe3+
(1)滴定前體積為0.1mol/L FeSO4溶液。
(2)滴定開始至化學(xué)計(jì)量點(diǎn)前此時(shí)滴加的Ce(SO4)2溶液中的Ce4+幾乎全部轉(zhuǎn)化為Ce3+,溶液中Ce4+濃度很小,且不易直接計(jì)算,而溶液中Fe2+和Fe3+的濃度容易求出,故在化學(xué)計(jì)量點(diǎn)前可利用Fe3+/Fe2+電對計(jì)算溶液中各平衡點(diǎn)的電極電勢值。
(3)化學(xué)計(jì)量點(diǎn)當(dāng)?shù)味ǚ謹(jǐn)?shù)為100%,滴入的Ce(SO4)2標(biāo)準(zhǔn)溶液為20mL時(shí),系統(tǒng)到達(dá)化學(xué)計(jì)量點(diǎn),此時(shí)Ce(SO4)2和FeSO4溶液均已定量反應(yīng)完全,它們的濃度均很小且不易求得,單獨(dú)采用任意電對都無法求得化學(xué)計(jì)量點(diǎn)的電極電勢,可將二者聯(lián)立起來考慮。
(4)化學(xué)計(jì)量點(diǎn)后化學(xué)計(jì)量點(diǎn)后,Ce(SO4)2過量,溶液中的二價(jià)鐵離子幾乎被氧化為三價(jià)鐵離子,二價(jià)鐵離子的濃度很小且不易求得。
在氧化還原滴定中,隨滴定劑的逐滴加入,溶液中有關(guān)組分濃度不斷變化,導(dǎo)致有關(guān)電對電勢也隨之不斷變化。以加入的標(biāo)準(zhǔn)溶液的體積為橫坐標(biāo),溶液的電極電勢為縱坐標(biāo)作圖,可得氧化還原滴定曲線。曲線形象的說明了滴定過程中溶液的電極電勢,特別是計(jì)量點(diǎn)附近的電極電勢變化的規(guī)律,可作為選擇指示劑的依據(jù)。
按照上述方法,整個(gè)滴定過程中電極電勢的計(jì)算結(jié)果列表1,并繪制如圖1以滴定百分率為橫坐標(biāo),溶液中的電極電勢為縱坐標(biāo)所示的滴定曲線。
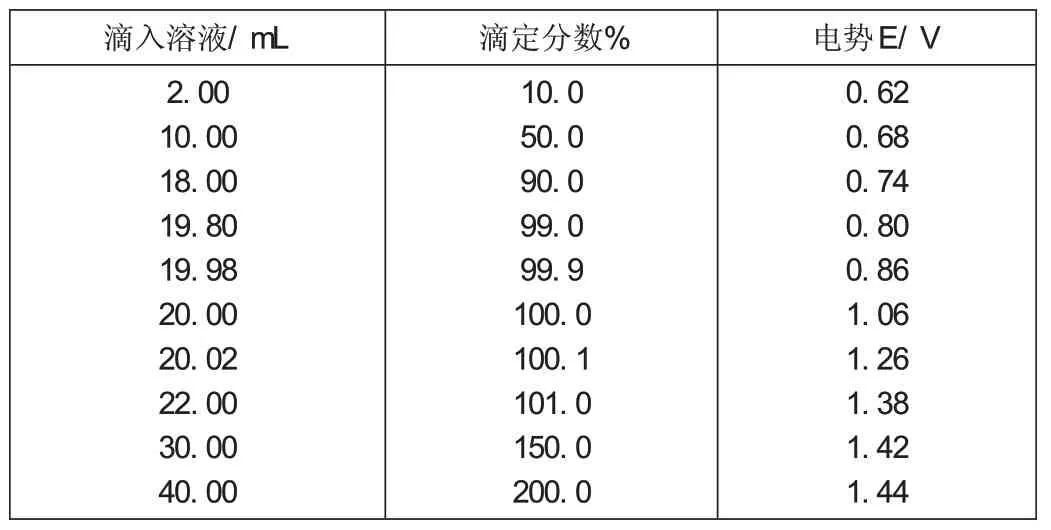
表1 滴定過程中電極電勢的計(jì)算結(jié)果表

圖1 滴定曲線
氧化還原滴定曲線的影響因素:
氧化還原滴定中,化學(xué)計(jì)量點(diǎn)附近電勢突躍范圍與兩個(gè)電對的條件電極電勢有關(guān)。條件電極電勢差值越大,即反應(yīng)的完全程度越高,突躍范圍就越大,滴定的準(zhǔn)確度越高;差值越小,突躍越小。由于條件電極電勢隨溶液的性質(zhì)而改變,故同一滴定反應(yīng)在不同的介質(zhì)中進(jìn)行,其計(jì)量點(diǎn)電勢及突躍范圍的大小不同。
2.1.2 氧化還原滴定中的指示劑
氧化還原滴定可用指示劑來指示終點(diǎn)。根據(jù)指示劑變色原理的不同,氧化還原滴定中常用的指示劑可分為以下幾種類型:
(1)氧化還原指示劑 氧化還原指示劑是一類本身可以發(fā)生氧化還原的物質(zhì),其氧化態(tài)In(OX)和還原態(tài)In(Red)具有不同的顏色。在滴定過程中,隨著滴定劑的加入,溶液的電勢不斷發(fā)生變化,指示劑被氧化或還原,使得在計(jì)量點(diǎn)附近由一種顏色變?yōu)榱硪环N顏色。
(2)自身指示劑 有些標(biāo)準(zhǔn)溶液或被滴定物質(zhì)本身具有很深的顏色,如果被測物溶液在反應(yīng)后變?yōu)闊o色或淺色,那么在滴定過程中,這種試劑稍有過量就容易檢出,這樣滴定時(shí)就不需要另加指示劑,而可以通過被測物本身顏色來判斷終點(diǎn),此類指示劑稱為自身指示劑。
(3)特殊指示劑 有些物質(zhì)本不具有氧化還原性,但卻能與滴定劑或被測物生成特殊顏色的物質(zhì),起到指示滴定終點(diǎn)的作用,這類指示劑被稱為特殊指示劑。
3 結(jié)語
在氧化還原滴定分析中,不僅要從平衡的觀點(diǎn)來考慮反應(yīng)的可能性,還應(yīng)從其反應(yīng)速度來考慮反應(yīng)的現(xiàn)實(shí)性。它不但能直接測定具有氧化性、還原性的物質(zhì),而且能間接測定一些非氧化還原性的物質(zhì);不僅能測定無機(jī)物,也能測定一些有機(jī)物。所以在氧化還原滴定分析中,不僅要從平衡的觀點(diǎn)來考慮反應(yīng)的可能性,還應(yīng)從其反應(yīng)速度來考慮反應(yīng)的現(xiàn)實(shí)性。

