長鏈非編碼RNA lnc-ZNF37A-2對肺癌細胞遷移和侵襲能力的影響
周發(fā)忱,舒鑫,周欣
(大連醫(yī)科大學(xué)1.附屬第一醫(yī)院胸外科,遼寧 大連 116011;2.基礎(chǔ)醫(yī)學(xué)院組織胚胎學(xué)教研室,遼寧 大連 116044)
肺癌具有高發(fā)病率和高死亡率,嚴重影響人類的生命健康。中國的肺癌發(fā)病率高于全球,新發(fā)病例約占全球肺癌新發(fā)病例的37%[1]。近年來肺癌的診斷和治療方法均有突破,但肺癌患者預(yù)后差仍是目前面臨的嚴峻問題,統(tǒng)計表明,只有約7%的肺癌患者生存期超過5年[2-3]。肺癌細胞的惡性增殖和遷移是肺癌患者死亡的主要原因。因此,對肺癌發(fā)生、發(fā)展以及轉(zhuǎn)移的機制進行探討,對改善肺癌患者預(yù)后、延長生存期具有重要意義。
長鏈非編碼RNA(long non-coding RNA,lncRNA)是一類存在于真核生物基因組中轉(zhuǎn)錄本長度大于200 nt的RNA分子,定位于細胞核或細胞質(zhì),但大多數(shù)不翻譯成蛋白質(zhì)[4]。有研究[5-6]表明,lncRNA在多種疾病的發(fā)生、發(fā)展過程中均異常表達,其調(diào)控的基因表達可發(fā)生在轉(zhuǎn)錄或轉(zhuǎn)錄后水平,在細胞凋亡、周期、增殖、遷移和化學(xué)抗性中擔(dān)任重要角色。近年來lncRNA對腫瘤進展的調(diào)控作用受到廣泛關(guān)注,其既能作為原癌基因促進腫瘤的發(fā)生發(fā)展,也能在腫瘤進展過程中起到抑制作用,發(fā)揮抑癌基因的功能[7-8]。然而,肺癌中l(wèi)ncRNA的詳細分子機制尚不明確,需要進行深入研究。
lnc-ZNF37A-2是2014年發(fā)現(xiàn)的一種新的lncRNA[9],在易于發(fā)生淋巴結(jié)轉(zhuǎn)移的肝癌細胞(HCCLYM-H2)中高表達,與定位相鄰的可預(yù)測肺癌復(fù)發(fā)的H2AFY2基因共表達。但其在肺癌中的作用和機制目前仍不清楚。本研究通過生物信息學(xué)分析,采用癌癥基因組圖譜(The Cancer Genome Atlas,TCGA)數(shù)據(jù)庫,分析lnc-ZNF37A-2(AL133271.1)在不同分期肺癌組織中的表達差異和臨床意義,并通過細胞實驗初步探討lnc-ZNF37A-2對肺癌細胞A549遷移和侵襲能力的影響。
1 材料與方法
1.1 材料
1.1.1 細胞系:肺癌細胞株A549、H1299購自中國科學(xué)院上海細胞庫。
1.1.2 主要試劑:RPMI 1640培養(yǎng)基和10%胎牛血清購自美國Hyclone公司;TRIzol試劑、PrimeScript逆轉(zhuǎn)錄試劑盒、SYBR PCR Master Mix購自日本TaKaRa公司;siRNA-lnc-ZNF37A-2、陰性對照siRNA和轉(zhuǎn)染試劑Lipofectamine 2000購自美國Invitrogen公司;Transwell小室購自美國CORNING公司。
1.2 方法
1.2.1 細胞培養(yǎng):將細胞培養(yǎng)于37 ℃、5%CO2的常規(guī)細胞培養(yǎng)箱,使用含10%胎牛血清、100 mg/L青霉素/鏈霉素的RPMI 1640培養(yǎng)基培養(yǎng)。待細胞貼壁且占滿培養(yǎng)皿底面積的80%~90%后傳代。
1.2.2 實時定量PCR(real-time quantitative PCR,qRT-PCR):將細胞用PBS清洗3遍,TRIzol試劑提取細胞總RNA,逆轉(zhuǎn)錄反應(yīng)體系根據(jù)說明書配置,合成cDNA后,將cDNA稀釋10倍,進行實時PCR,以2-ΔΔCt法定量分析,使用人GAPDH為內(nèi)參,RNA free H2O為陰性對照,實驗重復(fù)3次。GAPDH引物:上游5’-GCACCGTCAAGGCTGAGAAC-3’,下游5’-TGGTGAAGACGCCAGTGGA-3’;lnc-ZNF37A-2引物:上游5’-TTGCCCTGGTGTGCTGCTTTG-3’,下游5’-AGTCCATCCTCATCCTCTCCCATG-3’。
1.2.3 細胞轉(zhuǎn)染:將細胞接種到6孔板中,培養(yǎng)24 h后密度達到70%,轉(zhuǎn)染。設(shè)立lnc-ZNF37A-2干擾組(si-lnc-ZNF37A-2組)、陰性轉(zhuǎn)染組(NC組)、空白對照組。將 Lipofectamine 2000與si-lnc-ZNF37A-2或si-NC混合(終濃度為100 nmol/L)構(gòu)建轉(zhuǎn)染體系,將混合液加入6孔板中,37 ℃培養(yǎng)4 h,更換RPMI 1640完全培養(yǎng)基培養(yǎng)24 h,即可進行后續(xù)實驗。lnc-ZNF37A siRNA:順義,5’-AGUGAUAAGUGAAAUGGUGCA-3’,反義,5’-CACCAUUUCACUUAUCACUUU-3’。
1.2.4 劃痕實驗檢測細胞遷移能力:采用傷口愈合測定法評估細胞的遷移能力。細胞以6×105/孔的密度鋪6孔板。當細胞生長到100%匯合時,使用200 μL移液管吸頭劃傷傷口。用PBS將培養(yǎng)板洗滌3次,以除去細胞碎片,然后將細胞培養(yǎng)于不含胎牛血清的不完全RPMI 1640培養(yǎng)基中,37 ℃繼續(xù)培養(yǎng)。光學(xué)顯微鏡下拍攝初始傷口和培養(yǎng)48 h后恢復(fù)區(qū)域。計算傷口愈合面積,每個實驗重復(fù)3次。
1.2.5 Transwell侵襲實驗檢測細胞侵襲能力:每個Transwell小室(孔徑為8 μm)的上室加入1 ∶4體積比的基質(zhì)膠與無血清培養(yǎng)基混合液100 μL,待基質(zhì)膠凝固后進行實驗,評估細胞的侵襲能力。待細胞長到適宜密度后無血清處理4 h;收集饑餓處理過的細胞,上室接種細胞5×104/孔,加入無血清培養(yǎng)基200 μL,下室加入700 μL完全培養(yǎng)基,37 ℃培養(yǎng)48 h;取出小室,PBS清洗3次,4%多聚甲醛室溫固定30 min;PBS清洗3次,晾干后加入600 μL 0.2%的結(jié)晶紫溶液,室溫染色30 min,用棉簽小心擦掉上室細胞,在正置光學(xué)顯微鏡下隨機選擇5個視野以計數(shù)細胞數(shù)量。每個實驗重復(fù)3次。
1.2.6 生物信息學(xué)分析:訪問GEPIA(http://gepia.cancer-pku.cn)主頁,進入單基因分析中的Stage Plots頁面,能夠可視化分析不同分期的lnc-ZNF37A-2表達量。訪問starBase v3.0(http://starBase.sysu.edu.cn)主頁,進入Pan-Cancer頁面,分析lnc-ZNF37A-2表達量與肺癌患者總生存期的關(guān)系。利用在線數(shù)據(jù)庫Co-LncRNA(http://www.bio-bigdata.com/Co-LncRNA/)中肺癌數(shù)據(jù)集(GSE34329),查找與lnc-ZNF37A-2共表達的mRNA,并繪制共表達調(diào)控網(wǎng)絡(luò),之后將預(yù)測得到的共表達基因在CEGsFuncs菜單中進行GO和KEGG基因功能富集分析。利用starBase v3.0網(wǎng)站預(yù)測lnc-ZNF37A-2與ANAI1、FOXC2和TWIST1表達的相關(guān)性。
1.3 統(tǒng)計學(xué)分析
采用GraphPad Prism 7.0軟件處理數(shù)據(jù),不同病理分期表達差異的比較采用F檢驗;生存曲線比較采用log-rank(Mantel-Cox)檢驗;2組間比較采用配對樣本t檢驗;相關(guān)性分析采用Pearson線性相關(guān)分析。P< 0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 TCGA分析lnc-ZNF37A-2在肺癌組織中高表達
利用TCGA數(shù)據(jù)庫分析485例不同肺癌分期患者的組織樣本中l(wèi)nc-ZNF37A-2表達的差異(圖1),結(jié)果發(fā)現(xiàn),lnc-ZNF37A-2在Ⅰ期患者中表達較低,在Ⅳ期患者中表達最高,提示lnc-ZNF37A-2在晚期肺癌組織中高表達,可能發(fā)揮癌基因的作用。
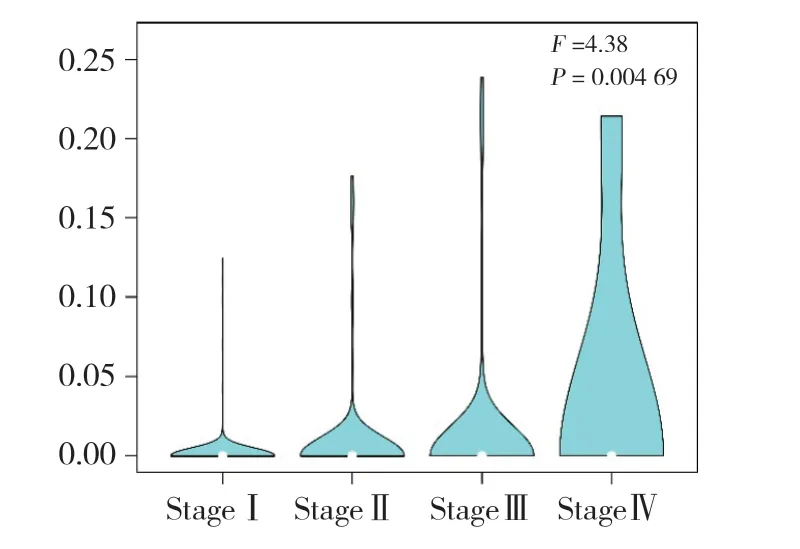
圖1 lnc-ZNF37A-2在不同病理分期的肺癌患者中的表達Fig.1 The expression of lnc-ZNF37A-2 for different pathological stages in lung cancer patients
2.2 lnc-ZNF37A-2表達與肺癌患者生存期的關(guān)系
應(yīng)用log-rank檢驗分析lnc-ZNF37A-2表達水平與肺癌患者總生存期的關(guān)系(圖2),結(jié)果發(fā)現(xiàn),lnc-ZNF37A-2表達對肺癌患者總生存期可能有影響,lnc-ZNF37A-2高表達的部分肺癌患者總生存期縮短(P=0.3)。
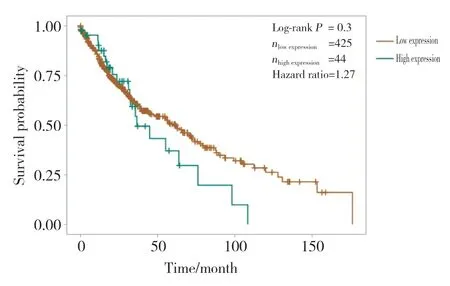
圖2 lnc-ZNF37A-2表達與肺癌患者預(yù)后的相關(guān)性Fig.2 Relationship between the expression of lnc-ZNF37A-2 and the prognosis of lung cancer patients
2.3 lnc-ZNF37A-2共表達的mRNA網(wǎng)絡(luò)構(gòu)建與基因富集分析
為了探究lnc-ZNF37A-2影響患者預(yù)后的原因,通過Co-LncRNA網(wǎng)站預(yù)測與lnc-ZNF37A-2相關(guān)的mRNA,共發(fā)現(xiàn)107個基因與lnc-ZNF37A-2共表達(圖3A)。對共表達的基因的生物過程(GO:BP)、細胞組分(GO:CC)、分子功能(GO:MF)進行功能富集分析(圖3B)。結(jié)果發(fā)現(xiàn),共表達基因與幾個過程有關(guān),如碳酸氫鹽運輸、細胞基質(zhì)黏附、小分子代謝過程、胞內(nèi)環(huán)磷酸腺苷應(yīng)答、細胞周期蛋白依賴性蛋白絲氨酸/蘇氨酸激酶活性的調(diào)控。細胞外基質(zhì)受體相互作用、轉(zhuǎn)化生長因子β信號通路和氧化磷酸化調(diào)節(jié)的信號通路是富集的主要通路。提示lnc-ZNF37A-2在肺癌細胞侵襲、遷移活性的調(diào)控中發(fā)揮重要作用。
2.4 抑制肺癌細胞中l(wèi)nc-ZNF37A-2表達后細胞侵襲和遷移能力減弱
驗證siRNA對細胞中l(wèi)nc-ZNF37A-2表達的干擾效率,通過實時PCR檢測A549、H1229細胞中轉(zhuǎn)染siRNA-lnc-ZNF37A-2后lnc-ZNF37A-2的表達,結(jié)果發(fā)現(xiàn),與空白對照組和NC組比較,轉(zhuǎn)染siRNA-lnc-ZNF37A-2的A549和H1229細胞中l(wèi)nc-ZNF37A-2表達明顯降低(圖4A),差異有統(tǒng)計學(xué)意義(P< 0.001),說明該siRNA可沉默肺癌細胞中l(wèi)nc-ZNF37A-2的表達。
由于A549細胞中siRNA-lnc-ZNF37A-2沉默效率高,因此使用A549細胞株進行后續(xù)實驗。通過劃痕實驗檢測細胞遷移水平的改變,結(jié)果發(fā)現(xiàn),A549細胞轉(zhuǎn)染siRNA-lnc-ZNF37A-2使其沉默后,細胞遷移能力明顯降低(圖4B),差異有統(tǒng)計學(xué)意義(P< 0.001)。通過Transwell侵襲實驗檢測抑制肺癌細胞中l(wèi)nc-ZNF37A-2表達后細胞侵襲能力的改變,結(jié)果表明,A549細胞中沉默lnc-ZNF37A-2后,與NC組比較,siRNA-lnc-ZNF37A-2組細胞的侵襲能力明顯降低(圖4C)(P< 0.001)。提示lnc-ZNF37A-2在肺癌細胞侵襲、遷移的調(diào)控中發(fā)揮重要作用。
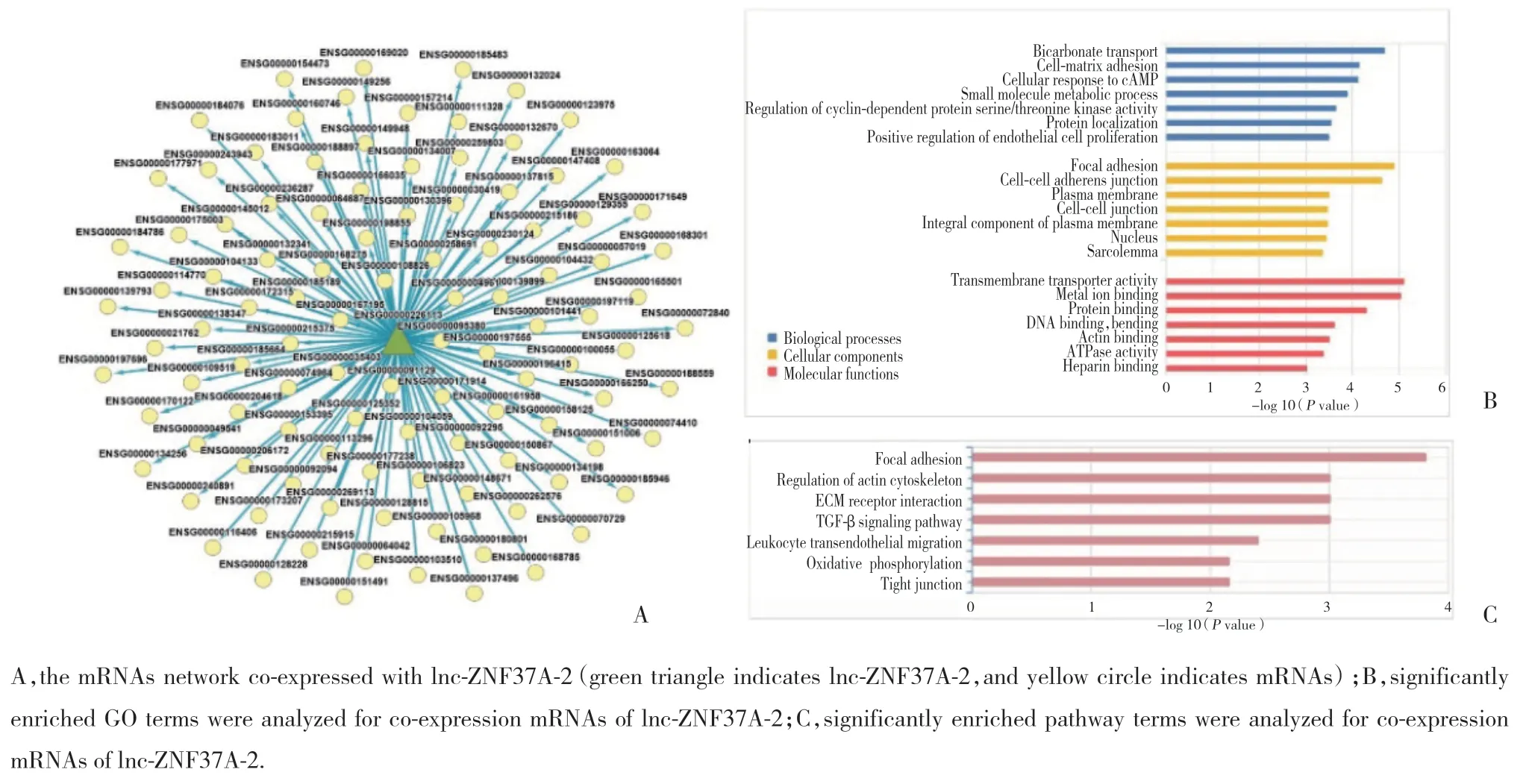
圖3 lnc-ZNF37A-2共表達的mRNA網(wǎng)絡(luò)與基因富集分析Fig.3 The network of co-expressed mRNAs with lnc-ZNF37A-2 and gene enrichment analysis
3 討論
肺癌是發(fā)病率和死亡率很高的惡性腫瘤,主要原因為早期診斷難度較大,確診時多為中晚期并已經(jīng)發(fā)生遠處轉(zhuǎn)移,患者錯過了最佳手術(shù)時機,而且治療后易局部復(fù)發(fā)。但肺癌侵襲和轉(zhuǎn)移的相關(guān)機制尚未完全明確,臨床研究推測與趨化因子刺激、基質(zhì)成分降解和上皮-間質(zhì)轉(zhuǎn)化等有關(guān)[10-12]。因此,早期準確評價腫瘤侵襲和轉(zhuǎn)移的情況對有效治療和改善預(yù)后至關(guān)重要。
lncRNA起初被認為是基因組轉(zhuǎn)錄的“噪音”,隨著高通量測序技術(shù)的發(fā)展,大量具有生物學(xué)功能的lncRNA進入人們的視野。近來研究表明,lncRNA通過表觀遺傳學(xué)修飾、轉(zhuǎn)錄和轉(zhuǎn)錄后水平以及可變剪接調(diào)控細胞周期、分化、凋亡等發(fā)揮生物學(xué)作用,如HOTAIR、AK126698、HOTTIP和TUG1等lncRNA明顯影響肺癌細胞增殖、遷移、凋亡、化療藥物敏感性等不同生物學(xué)功能[6,13-14]。以往研究[9,15]發(fā)現(xiàn),在易發(fā)生淋巴結(jié)轉(zhuǎn)移的肝癌細胞H2中,lnc-ZNF37A-2(RP11-672F9.1)的表達量顯著增加,與lnc-ZNF37A-2共表達的鄰近基因H2AFY2與肺癌復(fù)發(fā)相關(guān)。本研究發(fā)現(xiàn),與Ⅰ~Ⅲ期肺癌患者相比,lnc-ZNF37A-2在Ⅳ期肺癌患者中表達量上調(diào),提示lnc-ZNF37A-2與肺癌的進展相關(guān);且lnc-ZNF37A-2高表達的患者總生存期較短,提示其有望成為預(yù)測肺癌預(yù)后的指標。然后,通過富集分析與lnc-ZNF37A-2共表達的mRNA,推測lnc-ZNF37A-2與細胞黏附以及細胞外基質(zhì)受體相互作用相關(guān),可能影響肺癌侵襲、轉(zhuǎn)移。通過體外細胞實驗探討lnc-ZNF37A-2對肺癌細胞A549侵襲、遷移的作用,結(jié)果發(fā)現(xiàn),抑制肺癌細胞中l(wèi)nc-ZNF37A-2表達,肺癌細胞侵襲和遷移能力顯著降低,表明lnc-ZNF37A-2可能通過促進細胞的侵襲和遷移參與肺癌的發(fā)展。
本研究仍有以下不足,首先是缺少機制證據(jù)說明這些結(jié)果直接相關(guān);其次,lnc-ZNF37A-2對肺癌細胞增殖和藥物敏感性有何影響及可能的信號轉(zhuǎn)導(dǎo)機制仍需進一步研究。
綜上所述,本研究利用大數(shù)據(jù)挖掘結(jié)合細胞實驗發(fā)現(xiàn)lnc-ZNF37A-2在晚期肺癌組織中高表達,且與患者不良預(yù)后相關(guān);沉默lnc-ZNF37A-2表達會減弱肺癌細胞的侵襲和遷移能力,此過程可能是通過調(diào)控腫瘤微環(huán)境中的細胞黏附和細胞外基質(zhì)受體相互作用實現(xiàn)的。
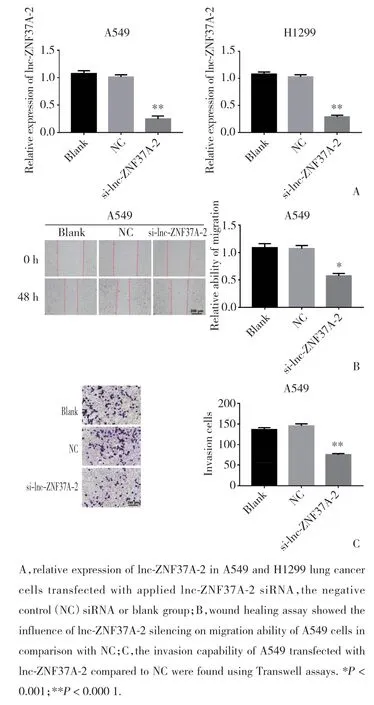
圖4 沉默lnc-ZNF37A-2的表達抑制肺癌細胞的侵襲和遷移能力Fig.4 Invasion and migration capability was inhibited after silencing lnc-ZNF37A-2 expression in lung cancer cells

