hMOF對子宮內(nèi)膜癌細胞生物學行為的影響
齊躍,葉秋霖,劉娟娟,林蓓
(中國醫(yī)科大學附屬盛京醫(yī)院婦產(chǎn)科,沈陽 110004)
子宮內(nèi)膜癌是子宮內(nèi)膜上皮源性惡性腫瘤,占女性生殖系統(tǒng)惡性腫瘤的20%~30%。近年來,其發(fā)病率和病死率呈上升趨勢,發(fā)病年齡亦趨于年輕化[1]。組蛋白乙酰化修飾是重要的表觀遺傳學修飾之一,可通過改變某些特殊位點的組蛋白與DNA的某些區(qū)域結(jié)合的緊密性,從而改變相關(guān)基因的轉(zhuǎn)錄,影響轉(zhuǎn)錄調(diào)節(jié)[2]。組蛋白乙酰化修飾受乙酰化酶和去乙酰化酶的雙重調(diào)節(jié)[3],hMOF是組蛋白乙酰化酶三大家族中MYST家族的重要成員[4],又被稱為MYST1或賴氨酸乙酰轉(zhuǎn)移酶8(lysine acetyltransferase 8,KAT8)。hMOF基因定位于人染色體16p11.2,編碼467個氨基酸,分子量52.4×103。hMOF參與胚胎發(fā)育、維護染色體的穩(wěn)定性[5]、DNA損傷修復[6-7]、轉(zhuǎn)錄調(diào)節(jié)等多種重要基礎(chǔ)生命過程,hMOF表達異常亦影響多種惡性腫瘤的發(fā)生、發(fā)展和預后[8-9]。而hMOF在子宮內(nèi)膜癌中的表達情況尚未見報道。本研究采用小干擾RNA(small intefering RNA,siRNA)
技術(shù)抑制子宮內(nèi)膜癌細胞中hMOF的表達,檢測細胞增殖、凋亡、遷移和侵襲能力的改變,為組蛋白乙酰化修飾成為子宮內(nèi)膜癌新的治療靶點提供理論依據(jù)。
1 材料與方法
1.1 材料
1.1.1 細胞系:人子宮內(nèi)膜癌細胞系Ishikawa購于中國科學院上海生命科學院細胞庫,由盛京醫(yī)院婦產(chǎn)科實驗室保存。
1.1.2 主要試劑:hMOF鼠抗人單克隆抗體(美國GeneTex公司);GAPDH鼠抗人單克隆抗體、HRP標記山羊抗小鼠IgG、HRP標記山羊抗兔IgG(北京中杉金橋試劑公司);RPMI 1640培養(yǎng)基、胎牛血清(美國Gibco公司);胰酶、DMSO(美國Sigma公司);TRIzol試劑、Lipofectamine 3000轉(zhuǎn)染試劑(美國Invitrogen公司);MTT(中國Solarbio公司);細胞周期試劑盒、Annexin-Ⅴ-APC/7AAD試劑盒(中國凱基公司);Transwell小室、細胞培養(yǎng)板、培養(yǎng)瓶、培養(yǎng)皿(美國Corning Coster公司);BCA試劑盒(上海碧云天公司);瓊脂糖(美國Promega公司);PVDF膜(美國Millipore公司);hMOF siRNA 片段和空白對照片段(上海吉瑪制藥技術(shù)有限公司)。
1.2 實驗方法
1.2.1 細胞培養(yǎng):人子宮內(nèi)膜癌Ishikawa細胞,在含10%胎牛血清的RPMI 1640培養(yǎng)基中,37 ℃、5% CO2及飽和濕度條件下進行常規(guī)培養(yǎng),每2~3 d傳代1次,用0.25%胰蛋白酶進行細胞消化,取指數(shù)生長期細胞用于實驗。
1.2.2 細胞轉(zhuǎn)染:取指數(shù)生長細胞接種于6孔板中,培養(yǎng)至融合度達到50%左右進行細胞轉(zhuǎn)染,按照轉(zhuǎn)染試劑盒說明書進行,更換Opti-MEM培養(yǎng)基,加入含有干擾片段1.5 μg的培養(yǎng)基,混勻,加入促轉(zhuǎn)染試劑3.75 μL,避光室溫放置5 min,加入混合好的轉(zhuǎn)染復合物,搖勻,繼續(xù)培養(yǎng)24 h,更換含有10%胎牛血清的培養(yǎng)基。轉(zhuǎn)染72 h后檢測干擾效果,使用轉(zhuǎn)染48~72 h的細胞進行細胞學實驗。共設(shè)3組:對照組、空白轉(zhuǎn)染對照組(siRNA-NC組)和實驗組(siRNAhMOF組)。
1.2.3 Western blotting檢測hMOF蛋白水平:取指數(shù)生長期細胞,漂洗,加入細胞裂解液,冰上靜置裂解,刮取細胞,超聲波進一步裂解,離心,留取上清,采用BCA法測∶定細胞中的總蛋白濃度,按比例稀釋蛋白樣品,煮沸蛋白變性。配制SDS-聚丙烯酰胺凝膠,蛋白上樣至孔槽中,每孔上樣量為50 μg,電壓為濃縮膠80 V、分離膠120 V條件下電泳。將PVDF膜在甲醇中浸泡5 min;4 ℃ 90 V電壓轉(zhuǎn)印1~3 h至PVDF膜。脫脂牛奶封閉,孵育一抗,hMOF鼠抗人單克隆抗體(1 ∶100),GAPDH鼠抗人單克隆抗體(1 ∶3 000),封膜,4 ℃搖床孵育過夜。室溫復溫,漂洗,孵育二抗,HRP標記的山羊抗小鼠IgG(1 ∶5 000)或山羊抗兔IgG(1 ∶5 000)室溫搖床孵育2 h。漂洗,顯色。Image J軟件測目的蛋白條帶相對蛋白表達量。
1.2.4 MTT法檢測細胞增殖能力:取指數(shù)生長期細胞,稀釋成濃度為3×103/mL的細胞懸液,接種于96孔板,每孔加入200 μL,細胞24 h充分貼壁伸展后加入小干擾試劑,繼續(xù)培養(yǎng),分別于1、2、3、4 d,每孔加入20 μL MTT(5 mg/mL),繼續(xù)培養(yǎng)4 h,吸去培養(yǎng)液,加入150 μL DMSO,震蕩10 min,酶聯(lián)檢測儀檢測吸光度(490 nm)。每組設(shè)3個重復孔,實驗重復3次,以吸光度為縱坐標制作細胞生長曲線。
1.2.5 流式細胞儀檢測細胞凋亡:采用Annexin-Ⅴ-APC/7AAD雙染法檢測細胞凋亡,按凋亡試劑盒說明書操作,用不含EDTA的胰酶消化細胞,收集細胞沉淀,重懸細胞,先后加入5 μL APC染劑和7AAD染劑,孵育,上機檢測存活、早期凋亡、晚期凋亡和死亡細胞百分比。實驗重復3次。
1.2.6 劃痕實驗檢測細胞遷移能力:取指數(shù)生長細胞接種于6孔板,融合度達90%,用移液槍頭(10 μL)在孔板中心劃取直線劃痕,PBS輕柔沖洗,更換無血清培養(yǎng)基,培養(yǎng)24 h,分別在顯微鏡下觀察劃痕寬度并拍照。實驗重復3次。
1.2.7 Transwell實驗檢測細胞遷移能力:Transwell小室上室內(nèi)鋪Matrigel膠,干燥后,下室加入500 μL 5%胎牛血清培養(yǎng)基,上室加入200 μL無血清培養(yǎng)基細胞懸液(細胞數(shù)量2×105個),37 ℃孵育72 h后取出小室。多聚甲醛固定,結(jié)晶紫染色,用棉簽將上室擦凈,顯微鏡下計數(shù)下室濾膜面浸潤細胞數(shù)。實驗重復3次。
1.3 統(tǒng)計學分析
2 結(jié)果
2.1 siRNA干擾hMOF前后子宮內(nèi)膜癌細胞hMOF蛋白水平的變化
將子宮內(nèi)膜癌Ishikawa細胞瞬時轉(zhuǎn)染siRNA靶向干擾hMOF,Western blotting檢測轉(zhuǎn)染前后hMOF蛋白水平的變化,結(jié)果顯示,siRNA-hMOF組與siRNANC組相比hMOF蛋白水平明顯下降,差異有統(tǒng)計學意義(P< 0.05),表明hMOF被有效沉默。見圖1。
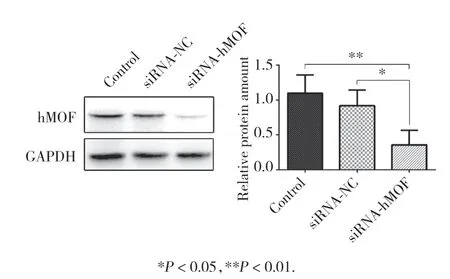
圖1 Western blotting檢測siRNA干擾hMOF前后Ishikawa細胞hMOF蛋白的表達水平Fig.1 Expression of hMOF before and after transfection of siRNA-hMOF in Ishikawa cells detected by Western blotting
2.2 干擾hMOF表達前后子宮內(nèi)膜癌細胞增殖能力的變化
檢測干擾hMOF表達前后Ishikawa細胞在不同時間點(1、2、3、4 d)的OD值,并繪制增殖曲線。MTT實驗結(jié)果表明,4 d時siRNA-hMOF組與siRNA-NC組相比細胞增殖能力明顯下降(P< 0.01),siRNA-NC組與對照組相比無明顯差異。見圖2。
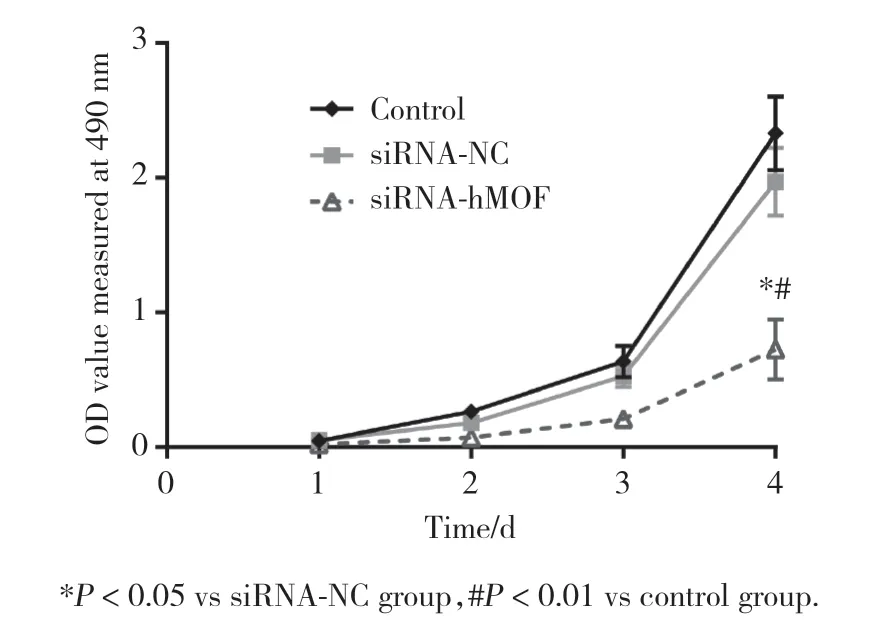
圖2 MTT實驗檢測siRNA干擾hMOF前后Ishikawa細胞增殖能力的變化Fig.2 The proliferation ability before and after transfection of siRNA-hMOF in Ishikawa cells detected by MTT assay
2.3 干擾hMOF表達前后子宮內(nèi)膜癌細胞凋亡的變化
采用流式細胞術(shù)檢測干擾hMOF表達前后Ishikawa細胞凋亡的變化,結(jié)果顯示,siRNA-hMOF組細胞的早期凋亡率和晚期凋亡率(分別為5.18%和8.28%)較siRNA-NC組(分別為3.83%和4.98%)均增加,差異均有統(tǒng)計學意義(P< 0.05)。見圖3。
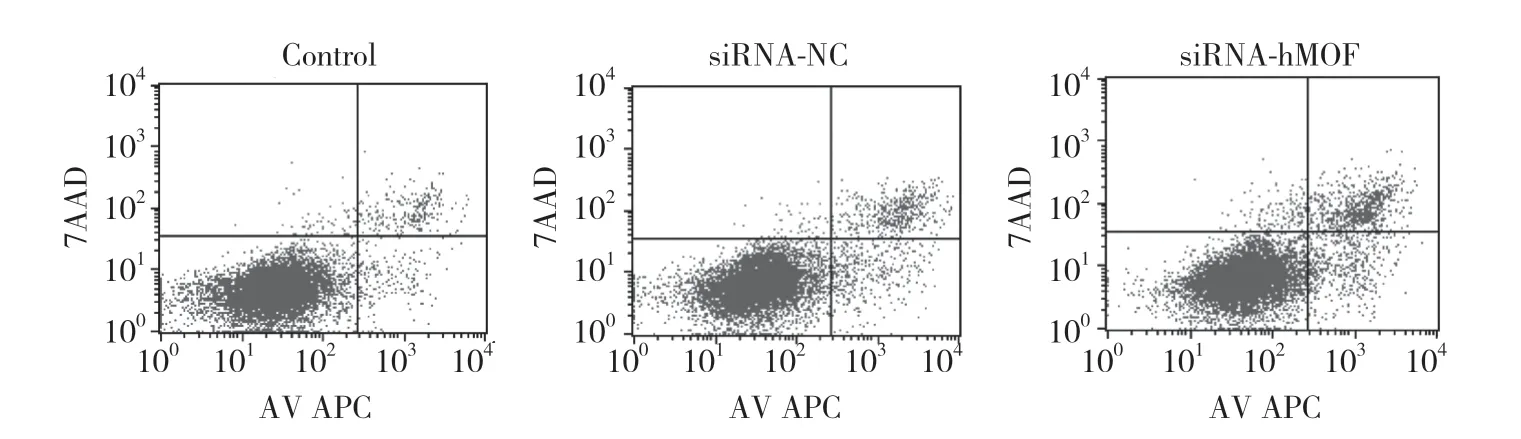
圖3 Annexin-Ⅴ-APC/7AAD雙染檢測siRNA干擾hMOF前后Ishikawa細胞凋亡的變化Fig.3 The apoptosis rates before and after transfection of siRNA-hMOF in Ishikawa cells detected by Annexin-Ⅴ-APC/7AAD assay
2.4 干擾hMOF表達前后子宮內(nèi)膜癌細胞遷移能力的變化
劃痕實驗檢測結(jié)果顯示,siRNA-hMOF組細胞遷移能力較siRNA-NC組明顯減弱,差異有統(tǒng)計學意義(P< 0.05),siRNA-NC組與對照組相比無明顯差異。見圖4。
2.5 干擾hMOF表達前后子宮內(nèi)膜癌細胞侵襲能力的變化
siRNA-hMOF組與siRNA-NC組相比穿膜細胞數(shù)明顯下降,差異有統(tǒng)計學意義(P< 0.001),siRNA-NC組與對照組相比無明顯差異。見圖5。

圖4 劃痕實驗檢測siRNA干擾hMOF前后Ishikawa細胞遷移能力的變化Fig.4 The migration ability before and after transfection of siRNA-hMOF in Ishikawa cells detected by wound healing test
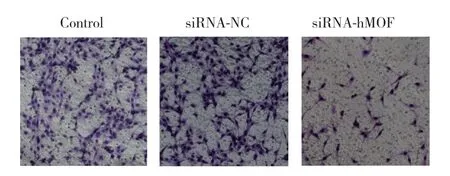
圖5 Transwell實驗檢測siRNA干擾hMOF前后Ishikawa細胞侵襲能力的變化Fig.5 The invasion ability before and after transfection of siRNAhMOF in Ishikawa cells detected by Transwell assay
3 討論
子宮內(nèi)膜癌是女性生殖系統(tǒng)的三大惡性腫瘤之一,發(fā)病率呈逐年上升趨勢,并且逐漸趨于年輕化,但其發(fā)病機制目前仍不十分明確,進一步研究其腫瘤惡性生物學行為的分子機制尤為重要,探尋更為有效的治療靶點具有臨床意義。
近年來,有學者逐漸發(fā)現(xiàn)腫瘤并非全部由基因異常引起,表觀遺傳學即非DNA水平改變導致的基因表達水平變化亦在腫瘤的發(fā)生、發(fā)展過程中發(fā)揮重要作用,故越來越受到重視。組蛋白乙酰化酶與組蛋白去乙酰化酶二者共同作用,維持著特殊位點的組蛋白賴氨酸殘基的乙酰化水平的動態(tài)平衡,導致表觀遺傳學改變,從而調(diào)控某些基因的轉(zhuǎn)錄。hMOF是三大乙酰化酶家族中MYST家族中的重要成員。組蛋白有多個乙酰化位點,但人類的正常細胞中大約有60%的H4組蛋白僅發(fā)生16位賴氨酸單一位點的乙酰化,即多種疾病與該位點的乙酰化水平存在相關(guān)性。hMOF則能特異性乙酰化組蛋白H4K16位點[9-10],與胚胎發(fā)育、維護染色質(zhì)結(jié)構(gòu)[9]、染色體穩(wěn)定性、轉(zhuǎn)錄調(diào)節(jié)[5-7]、DNA損傷修復[6]等密切相關(guān)。可見,hMOF在多種基礎(chǔ)生理過程中起著調(diào)控作用,而hMOF酶活性的喪失可能在細胞惡性轉(zhuǎn)化過程中發(fā)揮著重要作用。
已有研究表明,hMOF的表達異常與多種惡性腫瘤的發(fā)生、發(fā)展以及預后密切相關(guān),但其在不同腫瘤中的表達并不完全相同。hMOF在某些腫瘤中表達增高,表現(xiàn)為致癌作用。有研究[11]發(fā)現(xiàn),在非小細胞肺癌組織中hMOF和H4K16乙酰化水平較正常組織升高,hMOF能夠促進非小細胞肺癌細胞增殖、遷移、黏附,并通過Skp2促進腫瘤細胞進入S期,與腫瘤進展相關(guān)。還有研究[12]發(fā)現(xiàn),hMOF介導Nrf2乙酰化,促進了非小細胞肺癌細胞的增殖和耐藥。前列腺癌研究[13]發(fā)現(xiàn),hMOF與WDR5在雄激素受體靶基因上存在共定位,敲除hMOF基因后,顯著降低了雄激素受體靶基因的表達,且降低了前列腺癌細胞增殖。口腔舌鱗狀細胞癌研究[14]發(fā)現(xiàn),hMOF在癌組織中呈高表達,且與不良預后相關(guān),同時EZH2(Zeste基因增強子人類同源2)亦呈高表達,敲低hMOF降低了EZH2的表達,可見EZH2是hMOF的作用靶點之一。然而,hMOF在其他某些腫瘤中表達卻降低,表現(xiàn)為抑癌作用。腎癌、結(jié)直腸癌和胃癌研究[15]發(fā)現(xiàn),hMOF蛋白和mRNA表達水平均明顯降低,與胃癌患者的生存時間存在相關(guān)性。腎透明細胞癌、乳腺癌和髓母細胞瘤研究[16-17]發(fā)現(xiàn),hMOF的表達與H4K16位點的乙酰化水平均明顯降低,其表達下降是髓母細胞瘤患者預后的獨立危險因素。在腎透明細胞癌中,其表達還與臨床分期、病理分級密切相關(guān)[18]。在肝癌組織和細胞中hMOF蛋白和mRNA水平均顯著下降,hMOF低表達預示總生存和無病生存情況較差;敲低hMOF后則促進了肝癌細胞生長,過表達hMOF則抑制其生長[19]。本課題組的前期研究曾檢測卵巢癌組織中hMOF的表達,在上皮性卵巢癌中,其蛋白和mRNA水平均顯著降低,與分期存在密切相關(guān);且hMOF高表達患者的生存時間明顯高于低表達患者,從而說明hMOF高表達在卵巢癌中是一種保護性因素[20]。可見,hMOF在多種惡性腫瘤的發(fā)生、發(fā)展過程中發(fā)揮重要作用,但其作用并不完全相同。
hMOF在子宮內(nèi)膜癌中的表達及其與腫瘤惡性生物學行為的關(guān)系尚未見報道,因此本研究在子宮內(nèi)膜癌Ishikawa細胞中進行了檢測,發(fā)現(xiàn)hMOF呈高表達,本研究又將Ishikawa細胞瞬時轉(zhuǎn)染hMOF的小干擾片段,敲低hMOF后,表現(xiàn)為Ishikawa細胞的增殖能力明顯下降,早期凋亡率和晚期凋亡率均增加。本研究發(fā)現(xiàn),hMOF與子宮內(nèi)膜癌細胞的增殖存在相關(guān)。敲低hMOF后,Ishikawa細胞的遷移和侵襲能力均明顯下降。可見,hMOF同時又與腫瘤細胞的轉(zhuǎn)移相關(guān)。
綜上所述,本研究通過siRNA技術(shù)構(gòu)建了hMOF低表達的子宮內(nèi)膜癌細胞系,以探討hMOF在子宮內(nèi)膜癌惡性生物學行為中的作用。本研究結(jié)果提示,干擾hMOF表達后,抑制了子宮內(nèi)膜癌Ishikawa細胞的增殖、遷移和侵襲,促進了細胞凋亡。可見,hMOF在子宮內(nèi)膜癌的惡性進展中發(fā)揮重要作用,可能影響子宮內(nèi)膜癌預后。本研究僅局限在hMOF對子宮內(nèi)膜癌細胞體外惡性生物學行為的影響,與子宮內(nèi)膜癌的關(guān)系及其作用機制尚有待進一步深入研究,以期為子宮內(nèi)膜癌的治療尋找新的靶點。

