FOXO3和轉錄因子SOHLH1對卵母細胞特異性表達基因Bmp15轉錄活性的調控
劉源,杜冰,張雪,金美玉,鄭志紅
(中國醫科大學實驗動物部,沈陽 110122)
卵泡連續多階段的發育過程受多因素調節。在原始卵泡形成到原始卵泡活化階段,卵泡發育不依賴促性腺激素,而依賴于卵母細胞和顆粒細胞之間的信息傳遞[1-3],多種轉錄因子和旁分泌因子在這一階段發揮重要作用。骨形態發生蛋白15(bone morphogenetic protein 15,BMP15)屬于轉化生長因子β(transforming growth factor-β,TGF-β)家族成員,是卵泡內重要的旁分泌因子,在卵泡發育不依賴促性腺激素階段,對卵泡增殖分化、類固醇激素合成和卵丘擴張等發揮重要作用,敲除Bmp15后小鼠排卵率降低[4-5]。但卵泡內調控Bmp15的因素目前尚未明確。研究[6]表明,叉頭轉錄因子O3(forkhead box O3,Foxo3)轉基因小鼠與野生型小鼠相比,BMP15蛋白表達水平明顯下降。此外,本課題組通過對雌性精子發生和卵子發生的特定基本螺旋-環-螺旋1(spermatogenesis and oogenesis specific basic helixloop-helix 1,Sohlh1)(-/-)型小鼠卵巢的基因表達譜芯片分析,發現Bmp15基因表達水平也顯著下調,因此推測FOXO3、SOHLH1可能調控Bmp15。本研究擬探討FOXO3和轉錄因子SOHLH1是否通過調控旁分泌因子BMP15影響卵母細胞與顆粒細胞交流,旨在完善轉錄因子SOHLH1影響卵母細胞與顆粒細胞間信號交流的分子機制。
1 材料與方法
1.1 材料
實驗用SPF級C57BL/6J雌鼠均由中國醫科大學實驗動物部提供,飼養于屏障系統內,環境溫度保持在20~26 ℃之間,相對濕度40%~70%,光控交替時間12/12 h。本研究經過中國醫科大學實驗動物福利與倫理委員會及實驗動物管理和使用委員會審查通過。
主要試劑:2×Phanta Max Master 酶(中國諾唯贊Vazyme公司),AxyPrep DNA Gel Extraction Kit(美國愛思進AXYGEN公司),T4連接酶、BamHⅠ、KpnⅠ-HF、HindⅢ-HF限制性內切酶(美國NEW ENGLAND Biolabs公司),DH-5α感受態細胞(日本TaKaRa公司),lipofectamine 3000 Reagent轉染試劑盒、熒光二抗(美國Invitrogen公司),雙熒光素酶報告基因檢測試劑盒(北京普洛麥格Promega公司),EZChIP Chromatin Immunoprecipitation Kit(德國默克MERCK公司),FOXO3、SOHLH1抗體(英國Abcam公司),小鼠IgG抗體(美國賽默飛公司)。
1.2 Bmp15-pGL3.0重組質粒構建
1.2.1 獲取Bmp15基因啟動子區目的片段:應用Primer 5軟件對Bmp15啟動子-2 000 bp~+200 bp區域序列進行引物設計,上、下游引物分別添加KpnⅠ-HF(GGGTACCC)和HindⅢ-HF(GGATCC)的酶切位點。引物序列如下,Bmp15-F,5’-CGGGGTACCTAAA CGAGCATGGTAAGGGCG-3’,位于-1 279 bp~-1 264 bp;Bmp15-R,5’-CCCAAGCTTACAGGCTAA AGTAACCGAGGAG-3’,位于-447 bp~-431 bp。提取C57BL/6J小鼠卵巢組織基因組DNA作為模板,擴增Bmp15啟動子區。PCR反應體系50.0 μL,包括DNA 2.0 μL,Bmp15-F(10 μmol/L)2.0 μL,Bmp15-R(10 μmol/L)2.0 μL,2×Phanta Max Master 25.0 μL,DDW19.0 μL。PCR反應條件:95 ℃3 min;95 ℃15 s,58 ℃15 s,72℃2 min,30個循環;72 ℃退火5 min。
1.2.2 重組質粒連接及鑒定:將1.2.1得到的PCR產物進行凝膠回收純化,隨后使用KpnⅠ-HF、HindⅢ-HF限制性內切酶將PCR產物及pGL3.0-Basic載體酶切。將酶切后的Bmp15啟動子區目的片段和pGL3.0-Basic載體連接,轉化至DH5-α感受態細胞,平皿培養并測序鑒定。
1.3 Foxo3-pcDNA3.0質粒構建
應用Primer 5軟件對Foxo3CDS區進行引物設計,上、下游引物分別添加HindⅢ(GGATCC)和BamHⅠ(AAGCTT)的酶切位點。引物序列:Foxo3-F,5’-CCCAAGCTTAAGATGGCAGAGGCAC CAGC-3’;Foxo3-R,5’-CGGGATCCAGGGTCTGCTT TGCCCATTTC-3’。由于本實驗構建質粒需插入的Foxo3CDS區片段較長,為保障提取RNA的完整性,采用中國博科BioBase公司UPure Tissue RNA Kit進行RNA提取,后續步驟同1.2。
1.4 Foxo3-pcDNA3.0和Sohlh1-pcDNA3.0質粒表達分析
采用免疫熒光實驗分析Foxo3-pcDNA3.0和Sohlh1-pcDNA3.0(中國醫科大學實驗動物部前期構建)在HEK293T細胞中的表達水平。將蓋玻片放入6孔板中,每孔加入3 mL完全培養基。接種HEK293T細胞(2.5×105/孔)。12 h后,按照lipofectamine 3000 Reagent轉染試劑盒操作說明分別轉染100 μg純化后的Foxo3-pcDNA3.0和Sohlh1-pcDNA3.0質粒,培養24 h、48h后,取出6孔板內蓋玻片。冷丙酮固定生長在蓋玻片上的HEK293T細胞8 min,5%BSA室溫封閉2 h,加入用5%BSA稀釋400倍的FOXO3、SOHLH1一抗,4 ℃過夜。TBST清洗,加入熒光二抗,室溫1 h,TBST清洗,DAPI染色,封片。熒光顯微鏡下觀察FOXO3、SOHLH1蛋白在HEK293T細胞中的表達情況。
1.5 雙熒光素酶報告基因實驗檢測FOXO3、SOHLH1
對Bmp15啟動子活性的影響
37 ℃、5% CO2條件下,在24孔培養皿中培養HEK293T細胞。當細胞生長至約50%~70%時準備轉染。將細胞設為6組,每組4個復孔,每孔接種1.5×105個HEK293T細胞。第一組轉染pGL3.0-Basic載體100 ng,第二組轉染Bmp15-pGL3.0質粒100 ng,第三組轉染Bmp15-pGL3.0和Sohlh1-pcDNA3.0各100 ng,第四組轉染Bmp15-pGL3.0、Sohlh1-pcDNA3.0和Foxo3-pcDNA3.0質粒各100 ng,第五組轉染Bmp15-pGL3.0和Sohlh1-pcDNA3.0質 粒 各100 ng,Foxo3-pcDNA3.0質粒200 ng,第六組轉染Bmp15-pGL3.0和Sohlh1-pcDNA3.0質粒各100 ng,Foxo3-pcDNA3.0質粒300 ng。各組均加入TK質粒80 ng。轉染后48 h,棄除培養液,1×PBS清洗細胞。按照Promega雙熒光素酶報告基因檢測試劑盒說明書,分別檢測螢火蟲熒光值和海腎熒光值。啟動子活性用相對活性值(螢火蟲熒光值與海腎熒光值的比值)表示。
1.6 染色質免疫共沉淀(chromatin immunoprecipitation,ChIP)實驗
在GenBank數據庫中查找小鼠Bmp15基因組DNA序列,確定轉錄起始點上游2 000 bp序列,在Bmp15基因啟動子中查找SOHLH1的結合位點(CANNTG)和FOXO3的結合位點(TGTAAACA),根據結合位點位置設計ChIP-PCR引物(表1)。
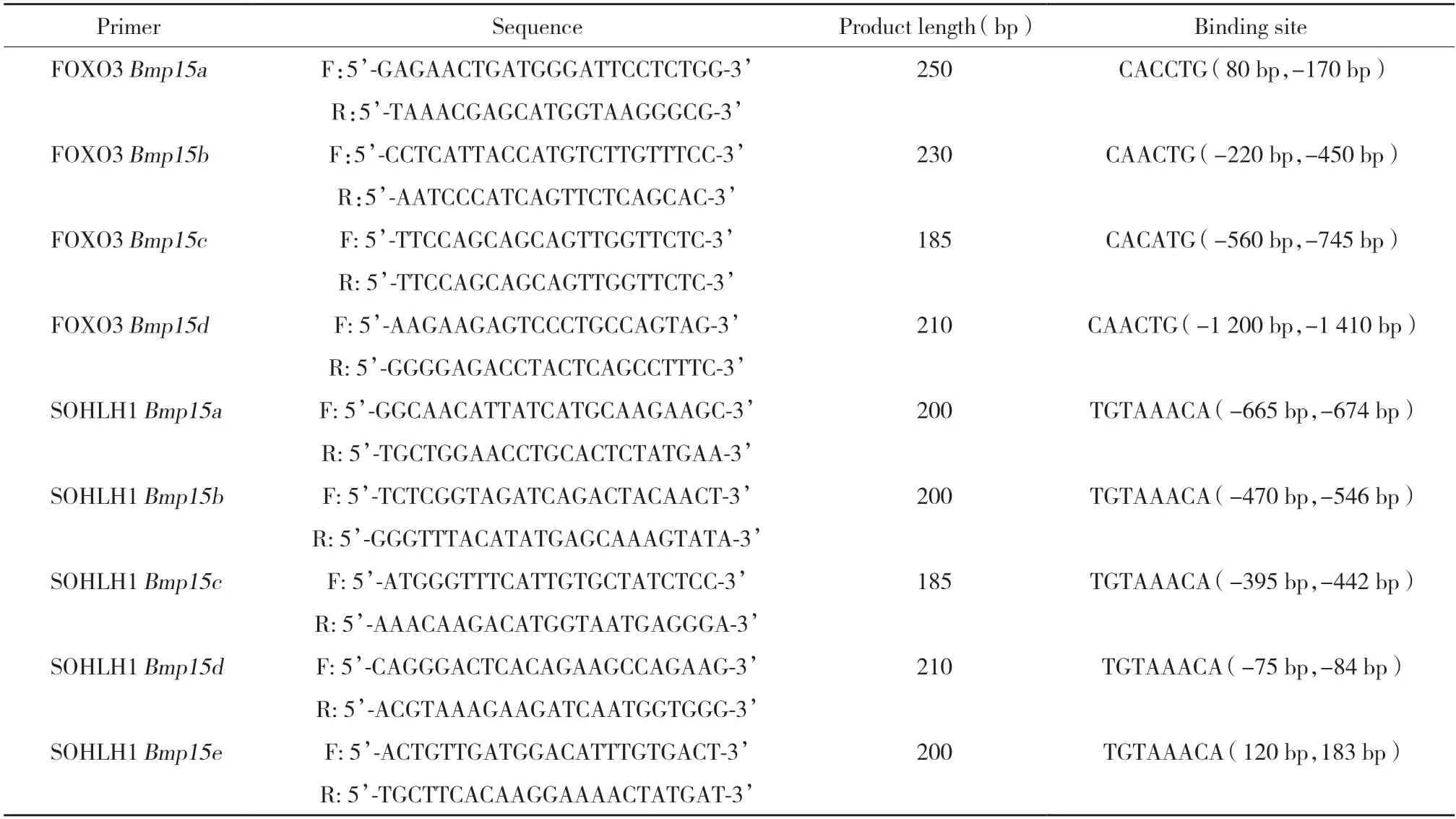
表1 ChIP-PCR引物Tab.1 Sequences of ChIP primers
超聲粉碎C57BL/6小鼠卵巢,使細胞中的DNA破碎成200~2 000 bp小片段。按照EZ-ChIP試劑盒說明進行實驗,將SOHLH1、FOXO3特異性抗體免疫沉淀產物作為ChIP實驗組,將小鼠IgG抗體免疫沉淀產物作為ChIP實驗陰性對照,PCR后通過瓊脂糖凝膠電泳檢測所得DNA產物中是否含有FOXO3和轉錄因子SOHLH1的結合位點。
1.7 統計學分析
細胞轉染和雙熒光素酶活性檢測各重復3次,應用 GraphPad Prism 5軟件對所得數據進行分析,采用t檢驗,P< 0.000 5為差異有極其顯著的統計學意義。
2 結果
2.1 Foxo3-pcDNA3.0表達質粒、Bmp15-pGLBasic重組質粒的構建
將構建好的重組質粒酶切鑒定后送測序,酶切電泳結果(圖1)與BLAST結果提示2種質粒構建成功。
2.2 Sohlh1-pcDNA3.0質粒在HEK293T細胞中的表達情況

圖1 質粒構建結果Fig.1 Plasmid construction results
將Sohlh1-pcDNA3.0質粒和Foxo3-pcDNA3.0過表達質粒轉染入HEK293T細胞中,24、48 h后分別觀察SOHLH1、FOXO3蛋白表達情況。結果發現,SOHLH1和FOXO3均可在HEK293T細胞中表達,且在細胞核、質中均有分布(圖2)。HEK193T細胞中含有內源性FOXO3蛋白,但含量極低,與過表達質粒相比,免疫熒光觀察不到(圖2)。
2.3 FOXO3抑制了SOHLH1對Bmp15的轉錄激活作用
雙熒光素酶報告基因實驗結果(圖3)顯示,SOHLH1可以上調Bmp15基因啟動子區的轉錄活性,FOXO3抑制了轉錄因子SOHLH1對Bmp15啟動子區的轉錄激活作用,且FOXO3表達水平越高,抑制作用越強。HEK293T細胞系含有內源性FOXO3,但通過免疫熒光實驗結果發現,內源性FOXO3表達微弱。
2.4 ChIP實驗證實FOXO3、SOHLH1與小鼠卵巢中Bmp15基因啟動子區結合
ChIP結果顯示,SOHLH1蛋白能與Bmp15啟動子(-170 bp,80 bp),(-450 bp,-220 bp),(-745 bp,-560 bp),(-1 410 bp,-1 200 bp)區間結合。FOXO3能與Bmp15啟動子(120 bp,183 bp),(-84 bp,-75 bp),(-442 bp,-395 bp),(-546 bp,-470 bp),(-674 bp,-665 bp)區間結合(圖4E~4I)。
2.5 FOXO3蛋白和轉錄因子SOHLH1在Bmp15啟動子區結合位點的分析
SOHLH1和FOXO3在Bmp15啟動子上有多個結合位點,并且Bmp15啟動子上相鄰的SOHLH1和FOXO3結合位點距離很近且有部分重合,相距最大距離約100 bp,在Bmp15啟動子(-400 bp,-405 bp)和(-544 bp,-546 bp)區域,SOHLH1和FOXO3的結合位點重合(圖5)。
3 討論

圖2 細胞免疫熒光結果Fig.2 Cell immunofluorescence results
卵泡發育依賴于卵母細胞和顆粒細胞之間的信息傳遞[7],卵母細胞內受體酪氨酸激酶(receptor tyrosine kinase,KIT)/磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/絲氨酸/蘇氨酸激酶(serine/threonine kinase,Akt)信號通路在原始卵泡活化階段發揮重要作用,顆粒細胞分泌受體酪氨酸激酶配體(KIT ligand,KITL)與卵母細胞表面KIT結合后激活卵母細胞內下游信號因子 PI3K,PI3K 活化后使得二磷酸肌酶磷酸化為三磷酸肌酶,進而激活Akt,活化后的Akt磷酸化FOXO3,磷酸化的FOXO3出核后,原始卵泡活化[8-9]。當原始卵泡活化發育為初級卵泡后,卵母細胞內的轉化生長因子β(transforming growth factor-β,TGF-β)/SMAD信號通路開始調控卵泡的發育。BMP15屬于TGF-β家族,在初級卵泡階段的卵母細胞中表達,BMP15和GDF9以旁分泌的形式從卵母細胞分泌至卵母細胞與顆粒細胞的間隙,與顆粒細胞上的BMP受體結合,磷酸化并激活顆粒細胞內的SMADs蛋白,SMAD1、SMAD5、SMAD8 蛋白作為通路中的信號因子,活化后磷酸化效應因子SMAD4,后者進入顆粒細胞核,調控SMAD靶基因的轉錄,促進顆粒細胞的增長與分化[10-13]。
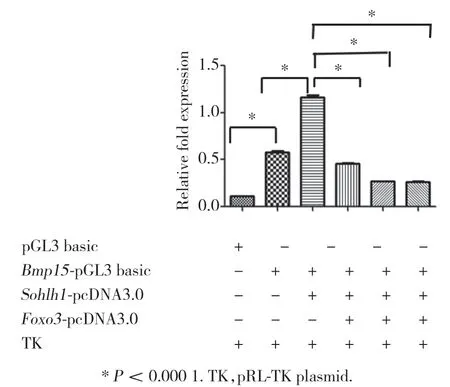
圖3 雙熒光素酶報告基因實驗結果Fig.3 Results of double luciferase reporter experiments
SOHLH1是生殖細胞特異性轉錄因子,表達于原始卵泡到初級卵泡階段,對原始卵泡的活化有重要作用[14-15]。當Sohlh1敲除后,卵母細胞中KIT/PI3K/Akt信號通路中信號因子發生顯著變化,原始卵泡無法活化[16]。本研究證實SOHLH1和FOXO3均可與Bmp15啟動子區結合,SOHLH1可以上調Bmp15基因啟動子區的轉錄活性,且FOXO3可抑制SOHLH1對Bmp15啟動子區的轉錄激活作用,且該抑制作用隨FOXO3表達量增加而逐漸增強。因此,推測FOXO3可能通過競爭性結合Bmp15的轉錄激活位點影響SOHLH1對Bmp15的轉錄調控。

圖4 ChIP實驗結果Fig.4 ChIP results
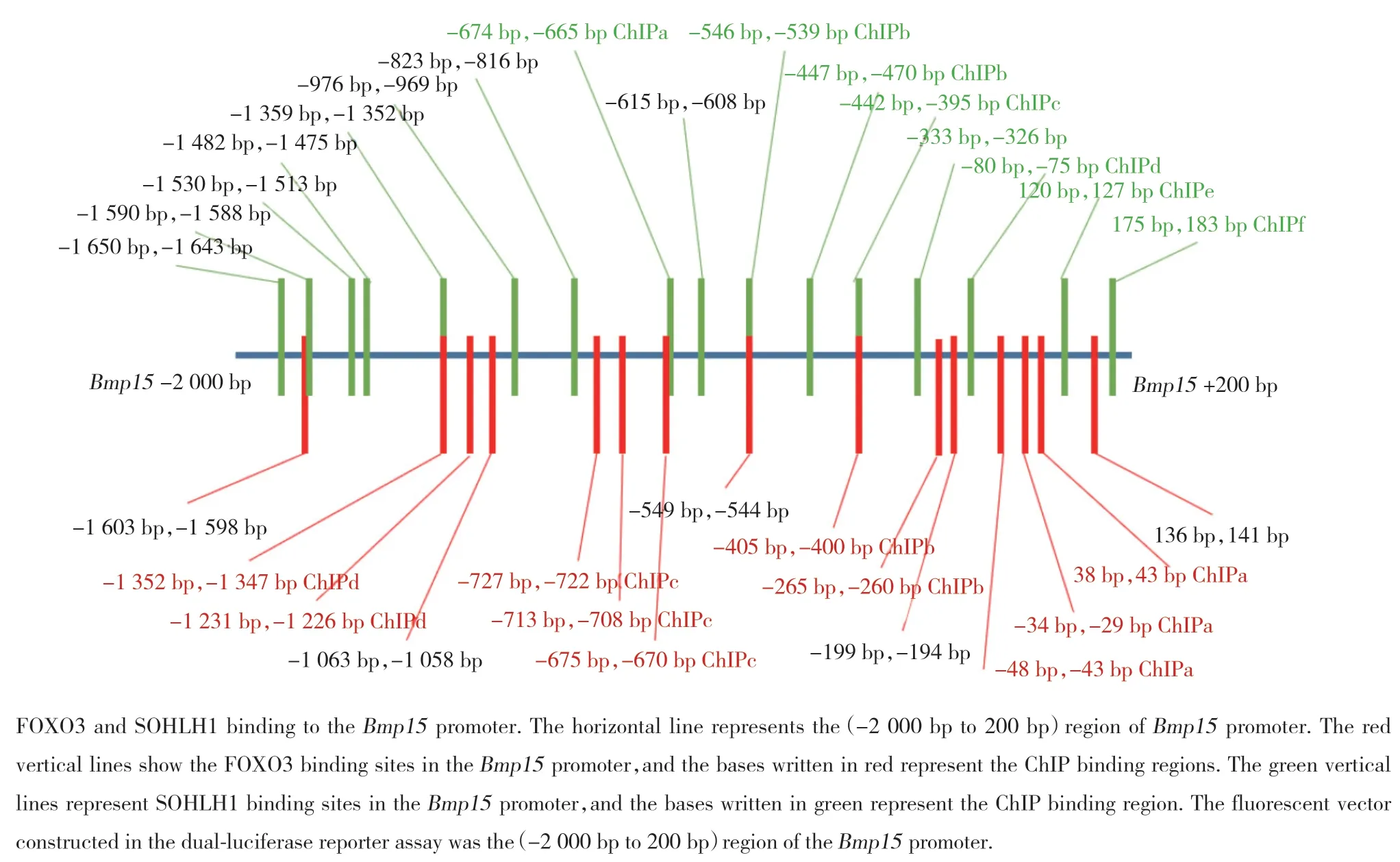
圖5 FOXO3和轉錄因子SOHLH1在Bmp15啟動子區的結合位點分析Fig.5 Analysis of the binding sites of FOXO3 and the transcription factor SOHLH1 in the promoter regions of genes Bmp15
由于SOHLH1與FOXO3都能與Bmp15啟動子結合,因此推測在卵泡組裝過程中,FOXO3入核并結合在Bmp15啟動子上,占據了SOHLH1的結合位點,并抑制其轉錄,使Bmp15在原始卵泡階段不能表達,當原始卵泡活化為初級卵泡后,FOXO3磷酸化從卵母細胞核中移出,釋放了Bmp15啟動子上SOHLH1的結合位點,使SOHLH1能夠轉錄激活Bmp15,Bmp15在初級卵泡的卵母細胞中得以表達,隨后BMP15從卵母細胞旁分泌至顆粒細胞表面,繼續參與SMAD通路,完成卵母細胞對顆粒細胞的調控;也有另外的可能就是SOHLH1與FOXO3同時結合在Bmp15啟動子上,FOXO3影響了SOHLH1對Bmp15的轉錄,或者FOXO3直接與SOHLH1結合并影響了SOHLH1對Bmp15的轉錄,具體通過何種途徑造成FOXO3阻礙了SOHLH1對Bmp15的轉錄激活,其深入機制還有待進一步研究驗證。

