巧用守恒發速解化學題
◇ 山東 苗延強
守恒思想貫穿于整個高中階段化學教材的學習.教師運用守恒定律,進行解題技巧教學時,要強調化學反應體系中某些相互反應的組分在發生化學反應前后的形態,進一步找出化學反應整體變化中某一個特定的等量關系,達到巧用守恒法速解化學題的目的.本文主要對高中階段水溶液的三大守恒定律的運用進行了闡述,并將守恒定律和相關例題結合.
1 電荷守恒
電荷守恒就是指溶液中的正電荷總數與負電荷總數相等,也可說為溶液中陽離子所帶的正電荷總量等于陰離子所帶的負電荷總量.因此,在書寫電荷守恒式時,要在全面掌握溶液中含有離子的基礎上構建等式.
例如,在構建NaHS 溶液電荷守恒式時,NaHS是可溶性鹽,在溶于水后完全電離,即NaHS=Na++HS-,基于已經學過的電離和水解平衡知識可知,水溶液中并不只存在兩種離子,因為HS-在溶液中還有弱電離和水解,即
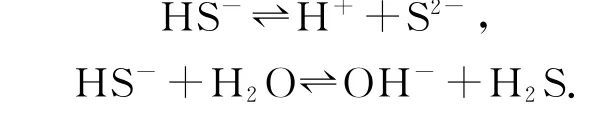
除此之外,也要考慮水自身的電離,即

在全面考慮溶液中所有離子的情況下,可以將NaHS溶液所涉及的離子進行整理,陽離子為Na+、H+,陰離子為HS-、OH-、S2-.
基于n(正電荷)=n(負電荷)可列出n(正電荷)=n(Na+)+n(H+),n(負電荷)=n(HS-)+n(OH-)+2n(S2-),從而得出初步的電荷守恒式為
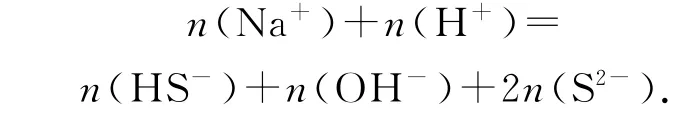
也可以用離子的濃度來表示,即

由此可以總結電荷守恒式的快速書寫步驟:
1)要準確判斷溶液中的所有離子,還要特別注意離子自身所帶的電荷量,寫出溶質的電離和水解式.
2)找出所寫溶液中的所有陽離子和陰離子,將陽離子濃度寫在等式左邊,陰離子濃度寫在等式右邊.
3)在離子濃度前寫上相應的系數,系數計算方法為該離子電荷量的絕對值.
2 物料守恒
物料守恒的概念為:電解質中原子的個數比在溶解前后是不會發生變化的.以NaHS 溶液為例,在NaHS溶液中Na原子與S原子的個數比為1∶1,那么其在溶解后兩種原子的比例是不會發生變化的,即n(Na)=n(S).
在NaHS 溶液中,S 原子總數等于HS-、S2-、H2S微粒數之和,即
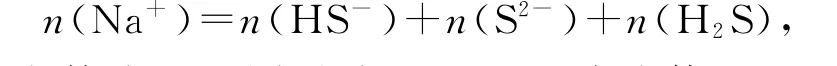
然后在等式兩邊同時除以NaHS 溶液體積,可得出NaHS溶液的物料守恒公式:

寫物料守恒式時要注意,不能用H、O 原子和其他原子的比例進行列式.
3 質子守恒
質子守恒式的含義是溶液中所有物質得到的質子總數和所有微粒失去的質子總數相等.
還是以NaHS 溶液為例,在考慮其完全電離、HS-的弱電離和水解及水的電離后,可以發現完全電離過程中不涉及質子得失,HS-弱電離和水解是失去和得到質子的過程,水電離是一個水分子失去質子,另一個水分子得到質子的過程.即
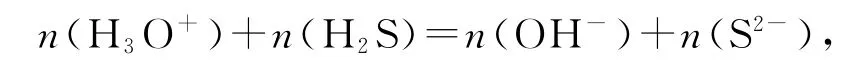
等式兩邊同時除以NaHS溶液體積得出質子守恒式
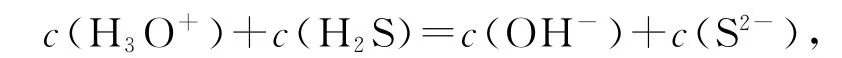
通常情況下,H3O+都會簡寫為H+,也就是
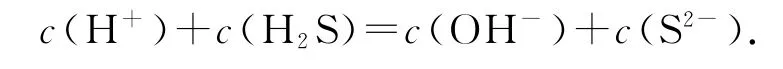
在書寫質子守恒式時,相對來說比較容易,我們可以在書寫完一種溶液的物料守恒和電荷守恒式后,再進行該溶液質子守恒式的推導,只要保證將不參與質子得失的微粒消去即可.
電荷守恒、物料守恒和質子守恒是高中階段水溶液學習的三大重要的守恒定律,同時也是高考備受青睞的知識點,高中生學好三大守恒定律,能夠有效解決高中化學階段水溶液中離子平衡學習的很多難題.

